生石花植株離體再生及組培快繁研究
牟豪杰, 王 燕, 呂永平, 汪一婷, 李海營
(浙江省農業科學院病毒學與生物技術研究所,浙江杭州 310021)
Note:Different lowercases in the same column stand for significant difference among different culture medium(P<0.05).
Note: Different lowercases in the same column stand for significant difference among different culture medium(P<0.05).
?
生石花植株離體再生及組培快繁研究
牟豪杰, 王 燕, 呂永平, 汪一婷*, 李海營
(浙江省農業科學院病毒學與生物技術研究所,浙江杭州 310021)
[目的]建立生石花植株離體再生及組培快繁體系。[方法]以生石花成熟種子為外植體,研究生石花組培快繁技術。[結果]萌發后的幼苗在MS+0.50 mg/L 6-BA+0.05 mg/L NAA培養基上被成功誘導出愈傷組織;不添加6-BA的MS培養基有利于愈傷組織的分化,不定芽誘導率為4.65;在MS +0.05 mg/L 6-BA+0.01 mg/L NAA培養基上不定芽增殖率較高,可達5.60。[結論]建立了生石花植株離體再生及快繁體系,有利于生石花種質資源保護和工廠化生產。
生石花;愈傷組織;離體再生;增殖;生根
生石花(Lithopssp.)為番杏科生石花屬植物,原產于非洲南部、南非納米比亞等極度干旱少雨的沙漠礫石地帶。生石花變態葉肥厚,形如彩石,嬌小玲瓏,新穎奇特,享有“有生命的石頭”的美稱,成為眾多愛好者收集蒔養的觀賞多肉植物[1-3]。生石花繁殖主要采用播種和分株方式,但其種子細小,生長速度緩慢,從萌發到開花至少需要3年;而分株方式繁殖率較低,實際生產栽培中使用較少[4-5]。此外,人類過度采掘和對其原產地生態環境的破壞導致生石花野生資源減少,這使其推廣和應用受到很大限制。植物組織培養方法可以在短期內使植物快速繁殖,并縮短植物生長發育周期。目前對于生石花組織培養研究仍處于探索階段,對其植株離體再生及組培快繁的研究鮮見報道[6-7]。筆者對生石花組培快繁技術進行研究,對于保存生石花種質資源和實現其規模化生產具有重要意義。
1 材料與方法
1.1 試驗材料 細紋生石花(Lithopsgracilidelineata)的自交種子由浙江省農業科學院組培中心溫室提供。
1.2 試驗方法
1.2.1 外植體的消毒及接種。以生石花種子為外植體,將其置于2 mL PE離心管中進行消毒處理,先用洗潔精浸泡0.5 h后再用自來水清洗,然后在70%乙醇和有效氯濃度為1% 的次氯酸鈉溶液中分別浸泡30 s和6 min,最后用無菌水沖洗3~5遍,每遍2 min (移液槍操作)。
將消毒處理后的種子在超凈工作臺中接種至MS基本培養基(MS+30 g/L蔗糖+7 g/L瓊脂,pH 5.8)上培養,待種子萌發后形成幼苗。
1.2.2 愈傷組織的誘導。將生石花幼苗轉接至誘導培養基上進行愈傷組織的誘導,誘導培養基:MS+30 g/L蔗糖+7 g/L瓊脂+6-BA 0.50 mg/L +NAA 0.05 mg/L,pH 5.8。
1.2.3 愈傷組織的分化。將誘導產生的愈傷組織接種至誘導培養基上進行愈傷組織的增殖,將愈傷組織接種至分化培養基上進行不定芽的分化。分化培養基: MS+30 g/L蔗糖+7 g/L瓊脂,添加不同濃度的6-BA(0、0.01、0.05、0.10 mg/L),pH 5.8。每瓶接種4塊愈傷組織,每組5瓶,35 d后觀察愈傷組織的分化情況并統計不定芽的誘導率。培養條件:溫度(23±2) ℃,光照強度40 μmol/(m2·s),光照時間10 h/d。
1.2.4 不定芽的增殖。將愈傷組織分化產生的不定芽接種至3種增殖培養基上進行繼代增殖培養,增殖培養基:MS+30 g/L蔗糖+7 g/L瓊脂,添加不同濃度的6-BA和NAA,pH 5.8。每瓶接種4個,每組5瓶,35 d后觀察不定芽的誘導情況并統計增殖率。培養條件:溫度(23±2)℃,光照強度60 μmol/(m2·s),光照時間12 h/d。
1.2.5 壯苗生根及移栽。將增殖不定芽叢分割成單株后轉接至壯苗生根培養基上培養。生根培養基:MS+30 g/L蔗糖+7 g/L瓊脂+0.10 mg/L NAA,pH 5.8。培養條件:溫度(23±2)℃,光照強度60 μmol/(m2·s),光照時間12 h/d。
將生根植株從培養基中取出并清洗后,置于陰涼通風處晾干2~5 d至表皮微皺,然后移栽至基質中。
1.3 數據處理及分析 不定芽誘導率=愈傷組織分化產生的不定芽總數/接種的愈傷組織總塊數×100%。不定芽增殖率=增殖出的不定芽總數/接種的芽數×100%。
使用SPSS統計分析軟件包(SPSS Inc, Chicago, USA)對數據進行顯著性差異分析(LSD)。
2 結果與分析
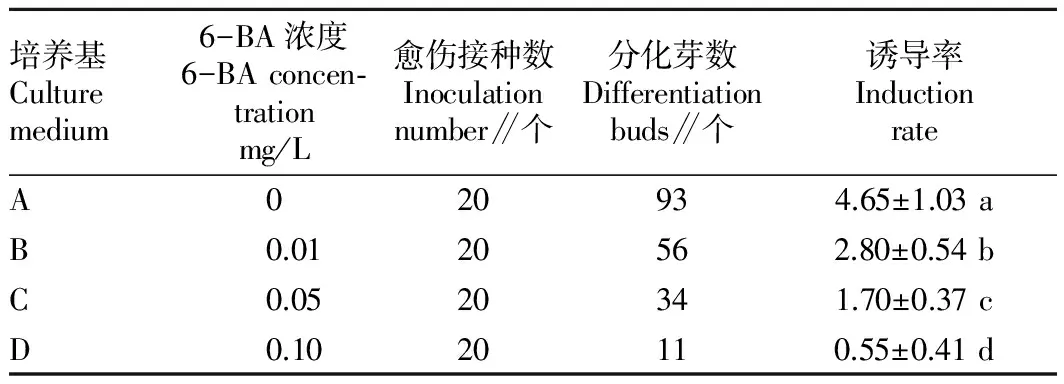
2.1 6-BA濃度對愈傷組織分化的影響 接種14~28 d生石花種子陸續萌發,培養35~49 d成為幼苗(圖1 A)。幼苗轉接至誘導培養基上培養14~21 d形成黃綠色的愈傷組織(圖1 B),培養28~35 d更換新鮮培養基進行繼代增殖,然后挑取生長狀態較好的愈傷組織置于分化培養基上進行不定芽的誘導培養(圖1 C)。培養35 d后,愈傷組織的分化情況見表1。由表1可知,愈傷組織在基本培養基A上培養時,不定芽的誘導率為4.65;在6-BA濃度為0.01 mg/L的培養基B上培養時不定芽的誘導率為2.80;隨著培養基 C、D中6-BA濃度的升高,愈傷組織的分化率逐漸降低,生石花不定芽的誘導率降低。因此,6-BA的添加不利于生石花不定芽的誘導。

注:A. 生石花幼苗;B.愈傷組織的誘導;C.不定芽的分化;D.壯苗生根。Note: A. Young seedling; B. Callus induction; C. Differentiation of adventitious bud; D. Rooting culture.圖1 生石花組培再生體系的建立Fig.1 Plantlet regeneration in vitro of L. gracilidelineata
Table 1 The effects of 6-BA concentration on the callus differentiation ofL.gracilidelineata
培養基Culturemedium6-BA濃度6-BAconcen?trationmg/L愈傷接種數Inoculationnumber∥個分化芽數Differentiationbuds∥個誘導率InductionrateA020934.65±1.03aB0.0120562.80±0.54bC0.0520341.70±0.37cD0.1020110.55±0.41d
注:同列不同小寫字母表示不同培養基間差異顯著(P<0.05)。
Note:Different lowercases in the same column stand for significant difference among different culture medium(P<0.05).
2.2 不同培養基對不定芽增殖的影響 將在培養基A中分化出的不定芽叢分割成單株后轉接至3種增殖培養基上培養,35 d后生石花不定芽的誘導情況見表2。由表2可知,不定芽在培養基E上的增殖率為3.85,在培養基F上的增殖率為5.60,且芽體生長健壯,而在培養基G中的增殖率僅為2.65,且部分增殖不定芽出現玻璃化現象。由此可知,培養基F是適合生石花增殖的培養基。
2.3 移栽成活率 將生石花的增殖不定芽叢分割成單株后轉接至壯苗生根培養基上培養,35~56 d可獲得健壯的生石花有根種苗,將生根植株從培養基中取出并清洗后,置于陰涼通風處晾干2~5 d至表面微皺,然后移栽至基質中進行栽培,移栽成活率可達90%以上(圖1D)。

表2 不同培養基對生石花不定芽增殖的影響
注:同列不同小寫字母表示不同培養基間差異顯著(P<0.05)。
Note: Different lowercases in the same column stand for significant difference among different culture medium(P<0.05).
3 結論與討論
該研究通過愈傷組織間接再生途徑獲得了生石花的再生植株,并建立了生石花的快繁體系。結果顯示,6-BA的添加不利于生石花愈傷組織的分化,而MS+0.05 mg/L 6-BA+0.01 mg/L NAA是適合生石花增殖的最佳培養基,不定芽增殖率可達5.60,且植株生長健壯。將生石花的增殖不定芽叢分割成單株后轉接至壯苗生根培養基上培養,35~56 d可獲得健壯的生石花有根種苗,將生根植株從培養基中取出并清洗后,置于陰涼通風處晾干2~5 d至表皮微皺,然后移栽至基質中進行栽培,移栽成活率可達90%以上。
目前,研究者對生石花屬植物的組織培養研究僅停留在獲得無菌材料的水平,尚無建立生石花組培快繁體系的成功報道[6-7]。該研究建立了生石花植株的離體再生及快繁體系,對促進生石花種質資源保護和工廠化生產具有重要意義。參考文獻
[1] HAMMER S.Lithops flowering stones[J]. Cactus & succulent journal,2005,77(4):194-195.
[2] 姚鴻年, 陸琰.生石花(續一)三、生石花的培植要點[J]. 中國花卉盆景,2008(1):22-23.
[3] 孫寧.播種生石花[J].中國花卉盆景,2012(6):24-25.
[4] 兌寶峰.生石花的栽培繁殖[J].中國花卉園藝,2006(24):14-16.
[5] 嚴霖, 羅清, 梁春,等.生石花屬植物栽培繁殖[J].農業研究與應用,2016(2):78-80.
[6] 徐慶華, 范冬春. 多肉類植物試管微型花卉研究初報[J].農業工程技術(溫室園藝),2009(9):62.
[7] 范麗楠, 張宗申, 劉平武.生石花種子萌發及幼苗生長最優條件的篩選[J].安徽農業科學,2016,44(18):123-126.
Plantlet Regenerationinvitroand Rapid Propagation ofLithopssp.
MOU Hao-jie, WANG Yan, LU Yong-ping, WANG Yi-ting*et al
(Institute of Virology and Biotechnology, Zhejiang Academy of Agricultural Sciences, Hangzhou, Zhejiang 310021)
[Objective] The aim was to establish plantlet regenerationinvitroand rapid propagation ofLithopssp. [Method] With mature seeds as explant, rapid propagation technique ofLithopssp. was studied. [Result] Calli were induced from the young seedling on MS medium+0.50 mg/L 6-BA+ 0.05 mg/L NAA in this study. The results showed that the basic MS medium without 6-BA benefited the callus differentiation ofLithopssp., and the induction ratio of adventitious bud was 4.65; MS+0.05 mg/L 6-BA+0.01 mg/L NAA was the optimal medium for the multiplication of adventitious bud, and the multiplication ratio was 5.60. [Conclusion] The plantlet regeneration and rapid propagation system ofLithopssp. were established, which has important guiding significance for the germplasm protection and industrial production ofLithopssp..
Lithopssp.;Callus; Regenerationinvitro; Proliferation; Rooting
引進國際先進農業科學技術計劃(948)項目(2011-G31);浙江省農業科學院青年人才培養項目(2015R21R08E08)。
牟豪杰(1977- ),男,浙江杭州人,助理研究員,從事植物組培產業化研究。*通訊作者,副研究員,碩士,從事生物技術方面的研究。
2016-10-12
S 604
A
0517-6611(2016)33-0143-02

