線性探針技術在貴州地區耐藥結核病診斷中的應用價值
鄭雯琳 張銘 袁薇 陳依江
(貴州省疾病預防控制中心,貴州 貴陽 550004)
?
線性探針技術在貴州地區耐藥結核病診斷中的應用價值
鄭雯琳 張銘 袁薇 陳依江
(貴州省疾病預防控制中心,貴州 貴陽 550004)
結核分枝桿菌; 線性探針; 耐藥性
結核病是全球嚴重的公共衛生問題之一,據世界衛生組織(WHO)報告[1],每年有約145萬人死于該病。我國近年來結核病的發病率也日趨上升,現已有結核病人450萬例,且每年病死13萬例。其中耐多藥結核病是我國現階段結核病防控工作面臨的最大挑戰之一[2]。為了進一步推進耐多藥結核病防治工作,近年來我國已經開始引進耐藥結核分枝桿菌分子生物學快速檢測技術以代替耗時的需借助于培養基的常規檢測方法。本研究對貴州本地200例分離培養結核分枝桿菌菌株進行檢測,與傳統比例法結果進行對比,探討該方法針對貴州地區的耐藥結核分枝桿菌的應用價值。
1 材料與方法
1.1 研究對象 貴州羅甸200株痰培養陽性菌株。
1.2 研究方法
1.2.1 傳統藥物敏感性試驗 利用傳統藥物敏感試驗檢測結核分枝桿菌對利福平、異煙肼兩種一線抗結核藥物的耐藥性,作為診斷試驗的金標準。
1.2.2 線性探針技術提取DNA 取500 μL處理后痰標本加入1.5 mL離心管內,10 000×g 離心15 min;棄上清,加入500 μL去離子水,渦旋震蕩重懸沉淀物。10 000×g離心15 min;95 ℃水浴中孵育20 min;超聲裂解15 min。12 000×g 離心10 min,取5 μL上清液用于PCR檢測。
1.2.3 擴增 采用德國Hain LifescienceGmbH 公司生產的GenoType MTBDRplus試劑盒在PCR儀上對結核桿菌DNA 模板進行擴增。擴增體系:35 μL PNM,5 μL 10×buffer,0.2 μL DNA聚合酶,2 μL MgCl2溶液,2.8 μL ddH2O,5 μL DNA模板,最終容積達到50 μL。擴增條件:95 ℃,15 min;(95 ℃,30 s,58 ℃,2 min),10個循環;(95 ℃,25 s,53 ℃,40 s,70 ℃,40 s),30個循環;70 ℃,8 min,4 ℃,1 h。
1.2.4 雜交 將PCR 擴增產物和變性裂解液(DEN)各20 μL混勻加入雜交反應板,孵育5 min,然后加入雜交緩沖液(HYB)1 mL,混勻,將標記好的探針試條加入槽中,在雜交儀上45 ℃孵育30 min后將雜交液徹底吸出,再加入1 mL嚴格漂洗液(STR),45 ℃雜交儀孵育15 min。在每個槽中加入1 mL按1∶100稀釋的標志物,雜交儀振動平臺上孵育30 min。再向每個槽中1∶100稀釋的底物并靜止避光孵育5~10 min。將試條取出置于吸水紙上干燥,然后粘貼在判讀表上。
1.3 結果判讀 線性雜交技術結果試紙條共有27 個反應條帶,分為4個區域,第一區為對照質控帶,其他區為耐藥相關基因探針區,其中第二區是利福平耐藥相關rpoB 基因探針區,第三和第四區分別為異煙肼耐藥相關的KatG、inhA 基因探針區,當野生條帶均顯色而突變條帶無顯色時為藥物敏感,野生條帶缺失、突變條帶顯色或不顯色均為耐藥。
1.4 統計學方法 采用SPSS 17.0軟件進行數據處理,檢測結果的真實性采用敏感度和特異度對其進行評價,以P<0.05 為差異有統計學意義。
2 結 果
2.1 比例法藥敏結果 利福平耐藥27例,利福平敏感173例,異煙肼耐藥18例,異煙肼敏感182例。
2.2 線性探針技術結果 利福平耐藥27例,利福平敏感173例,異煙肼耐藥18例,異煙肼敏感182例。
2.3 兩種方法比較 兩種方法對利福平檢測結果一致的有200例,兩種方法均為耐藥的27例,均為敏感的173例; 兩種方法對異煙肼檢測結果一致的有200例,兩種方法均為耐藥的18例,均為敏感的182例。線性探針GenoType MTBDRplus方法檢測利福平耐藥的靈敏度為100%,特異度為100%,陽性預測值為1,陰性預測值為1 ; 檢測異煙肼的靈敏度為100%,特異度為100%,陽性預測值為 1 ,陰性預測值為1 。線性探針技術技術與傳統藥敏實驗檢測所得利福平耐藥結核病發生率、異煙肼耐藥結核病發生率和耐多藥結核病發生率比較差異均無統計學意義(P>0.05)。
2.4 基因突變頻率分布 對GenoType MTBDRplus 檢測耐利福平及耐異煙肼的突變位點進行了分析,耐利福平基因突變頻率最高的是S531L(66.7%),耐異煙肼基因突變頻率最高的為 S315T1(88.9%)。見表1。
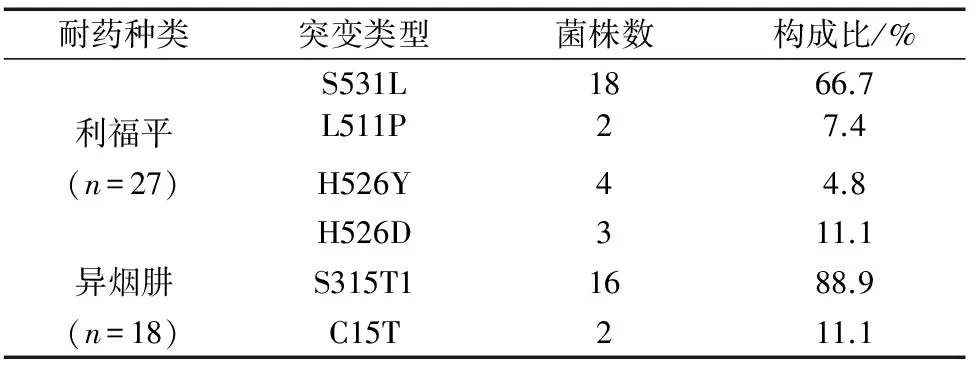
表1 線性探針技術檢測利福平和異煙肼耐藥基因的突變頻率分布
3 討 論
線性探針雜交技術檢測作為分子診斷,其原理是基于對基因序列的分析而進行的結核分枝桿菌及其耐藥性診斷。實驗方法與傳統的藥物敏感性實驗相比簡單,且檢測速度較快,目前已在很多國家使用。但有研究顯示,耐藥水平的高低會影響HAIN技術的檢測效果[3]。WHO 2014 年版《耐藥結核病規劃管理指南伙伴手冊》對藥敏試驗進行了更新,指出藥敏試驗包括了表型藥敏試驗(即傳統藥敏試驗) 和基因型藥敏試驗; 結核分枝桿菌對利福平的耐藥定義為表型或基因型藥敏試驗發現利福平耐藥[4]。說明分子檢測對耐藥結核病診斷的重要性,意味著一旦發現利福平基因型耐藥,就需要考慮其為耐藥結核的可能性[5]。
本研究中,GenoType MTBDR plus 檢測利福平耐藥的靈敏度達100%,與此前國外的研究結果一致[6-7]。已有研究顯示利福平耐藥由編碼RNA聚合酶β亞單位的rpoB 基因核心區的基因突變引起。本研究檢測利福平耐藥表現出較高的靈敏度和特異度。由于不同地區結核分枝桿菌耐利福平的基因突變位點突變頻率均不同,本研究顯示,耐利福平基因突變頻率最高的是rpoB S531L,故提示貴州地區利福平耐藥主要以rpoB S531L 為主。異煙肼耐藥主要與katG 和inhA 基因有關,katG 基因突變與高水平耐藥相關, inhA 耐藥與低水平耐藥相關。本研究顯示,異煙肼耐藥主要基因突變為katG S315T1,提示貴州地區88.9%的耐異煙肼病例為高水平耐藥。
[1] World Health Organization. Global tuberculosis control: WHO report 2011[R]. Geneva: World Health Organization, 2011.
[2] 衛生部.全國結核病耐藥性基線調查報告(2007-2008年)[M].北京:人民衛生出版社,2010.
[3] World Health Organization. Compannion handbook to the WHO guidelines for the programmatic management of drug-resistant tubercuosis[R]. Geneva: World Health Organization, 2014.
[4] 段鴻飛. WHO 2014 年版《耐藥結核病規劃管理指南伙伴手冊》解讀之六[J]. 中國防癆雜志,2015,37(6):658-659.
[5] Causse M, Ruiz P, Gutierrez JB,et al.Evaluation of new Geno-Type MTBDRplus for detection of resistance in cultures and direct specimens of Mycobacterium tuberculosis [J].Int J Tuberc Lung Dis,2008,12(12):1456-1460.
[6] Lacoma A, Garcia-Sierra N, Prat C, et al. GenoType MTBDRplus assay for molecular detection of rifampin and isoniazid resistance in Mycobacterium tuberculosis strains and clinical samples [J]. J Clin Microbiol,2008,46(11):3660-3667.
[7] Miotto P, Piana F, Cirillo DM, et al.Genotype MTBDRplus: a further step toward rapid identification of drug-resistant Mycobacterium tuberculosis [J]. J Clin Microbiol, 2008,46(1):393-394.
貴州省疾病預防控制中心基金項目(2015-E2-4)
R52
B
1000-744X(2016)11-1214-02
2016-06-08)

