納豆激酶檢測體系的建立及其跨膜轉運途徑初探*
李敏惠,陳 瑜,蔣玉亮,李 艷,余 赟,毛明星,林定彪,楊亞瓊,楊 平△
1.成都醫(yī)學院 科研實驗中心(成都,610083);2.成都醫(yī)學院 生物醫(yī)學系(成都,610083);3.成都醫(yī)學院 基礎醫(yī)學院(成都,610083)
?
·論 著·
納豆激酶檢測體系的建立及其跨膜轉運途徑初探*
李敏惠1,陳 瑜2,蔣玉亮2,李 艷2,余 赟3,毛明星2,林定彪2,楊亞瓊3,楊 平3△
1.成都醫(yī)學院 科研實驗中心(成都,610083);2.成都醫(yī)學院 生物醫(yī)學系(成都,610083);3.成都醫(yī)學院 基礎醫(yī)學院(成都,610083)
目的 建立納豆激酶(nattokinase,NK)酶聯(lián)檢測體系,探討其跨膜轉運機制。方法 采用雜交瘤技術篩選抗NK的單克隆抗體,競爭抑制法鑒定單抗識別的抗原表位,Western Blot測定單抗特異性,雙抗夾心ELISA法進行單抗靈敏度測定,Caco-2細胞模型探討NK跨膜轉運機制,生物信息學預測NK穿膜相關序列。結果 篩選得到穩(wěn)定分泌抗體且特異性識別NK的雜交瘤細胞6株,其中3株單抗識別相近的抗原表位,其余單抗識別不同的抗原表位;6株單抗檢測NK的最小靈敏度分布為0.78~20.00 ng/mL;Caco-2細胞模型顯示,胞吞作用不是NK跨膜轉運的主要途徑;生物信息學提示,NK中含有3段穿膜相關序列。結論 基于NK單抗建立的酶聯(lián)檢測體系,可有效監(jiān)控NK跨膜轉運過程,NK可能是依據(jù)蛋白轉導結構域直接介導而實現(xiàn)其腸道吸收轉運。
納豆激酶;單克隆抗體;跨膜轉運;蛋白轉導結構域
藥物在體內(nèi)的生物利用度與藥物胃腸粘膜通透性相關聯(lián),蛋白質(zhì)、肽類等大分子藥物因其膜透過性不甚理想,影響其生物利用度,限制了該類藥物的應用[1]。此外,很多具有應用前景的藥物受到人體內(nèi)各種天然屏障(如血腦屏障)的限制也難以到達靶器官或靶細胞發(fā)揮藥效,可見藥物的跨膜轉運是藥理學研究中一個不可忽視的重點[2]。
納豆激酶(nattokinase,NK)是具有纖溶活性的絲氨酸蛋白酶,對交聯(lián)纖維蛋白具有高效、特異的水解活性。更為重要的是,NK在胃腸道內(nèi)穩(wěn)定,可保留活性經(jīng)腸道粘膜上皮細胞吸收入血,具有穿越腸絨毛膜屏障的特性[3-4]。作為潛在的溶栓藥,NK可降低血栓患者出血風險,口服生物利用度高,具有很好的應用前景[5]。然而,盡管既往研究已明確NK可以經(jīng)腸道吸收入血,卻未對NK穿越腸壁屏障的分子機制進行研究。本研究擬基于NK的單克隆抗體建立檢測體系,利用Caco-2細胞模型探討NK跨膜轉運途徑,為NK臨床藥用奠定基礎。
1 材料與方法
1.1 實驗材料
雌性6~8 w齡BALB/c小鼠及新西蘭兔購自四川達碩公司;小鼠骨髓瘤細胞Sp2/0-Ag14、人Caco-2細胞為成都醫(yī)學院科研實驗中心傳代保存;弗氏佐劑、胸腺嘧啶核苷(T)、次黃嘌呤(H)、氨基蝶呤(A)、聚乙二醇4000(PEG4000)購自Sigma公司。RPMI 1640及胎牛血清購自GIBCO公司;HRP標記試劑盒(EZ-Link?Plus Activated Peroxidase,31489),抗體亞型鑒定試劑盒(Rapid Isotyping Kit,37503)購自Pierce公司;HRP化學發(fā)光底物購自Millipore公司;HRP-Goat anti Mouse IgG抗體購自CST公司;Protein A/G 親和柱、β-巰基嘧啶親和柱購自GE公司;NK由成都地奧九泓制藥廠提供。
1.2 抗NK鼠雜交瘤細胞的篩選
以2 mL完全弗氏佐劑乳化等體積的NK(NK溶解于PBS,濃度為0.5 mg/mL)作為抗原,以50 μL/只腹腔注射免疫BALB/c小鼠;2 w后,用不完全弗氏佐劑乳化抗原加強免疫;頜下靜脈取血,間接ELISA法檢測血清免疫效價,當血清效價>1∶105時,抗原直接免疫,3 d后取免疫鼠脾細胞與SP2/0-Ag14細胞在PEG4000介導下融合;融合細胞用間接ELISA法及有限稀釋克隆法篩選HAT抗性的陽性雜交瘤細胞。秋水仙素法對雜交瘤細胞進行染色體分析:秋水仙素(0.4 μg/mL)特異破壞紡錘絲而獲得中期分裂相細胞;再用0.075 mol/L KCl 溶液等低滲處理,使細胞膨脹,體積增大,染色體松散;經(jīng)甲醇-冰醋酸溶液固定,即可觀察。
1.3 NK兔多抗的制備、純化及鑒定
以2 mL完全弗氏佐劑乳化等體積的NK(NK溶解于PBS,濃度為0.5 mg/mL)作為抗原,以500 μL/只皮下多點免疫新西蘭兔;2 w后加強免疫(不完全弗氏佐劑乳化抗原);耳靜脈取血,間接ELISA法檢測血清效價;當血清效價>1∶105時,收集血清,Protein A親和柱純化IgG抗體;HRP標記試劑盒用于HRP與抗體的偶聯(lián),標記兔多抗。
1.4 單克隆抗體的鑒定
1.4.1 抗體亞型鑒定及抗體純化 雜交瘤細胞擴大培養(yǎng),培養(yǎng)上清用于抗體鑒定。亞型鑒定試劑盒檢測抗體亞型:將抗體稀釋液以50 μL/孔加入已包被的酶聯(lián)板,再加入HRP標記的Goat Anti-Mouse IgG/IgA/IgM,室溫1 h,TMB顯色,450 nm測定吸光度,判定抗體重鏈及輕鏈類型。根據(jù)抗體亞型選擇純化體系純化抗體:IgG用Protein A親和柱,IgM用β-巰基嘧啶親和柱純化。抗體純化效果以SDS-PAGE電泳檢測,檢測還原樣品時加二硫蘇糖醇(DTT)還原。
1.4.2 Western blot檢測抗體特異性 以抗原NK做SDS-PAGE電泳,分離膠濃度為15%,轉印于PVDF膜,封閉后與檢測單抗4 ℃孵育過夜,再加入HRP標記的兔抗鼠二抗,37 ℃孵育2 h,HRP化學發(fā)光底物顯色、成像。
1.4.3 NK酶聯(lián)檢測體系的建立及單抗檢測靈敏度測定 NK雙抗夾心酶聯(lián)體系建立:以表位單抗為包被抗體,加入NK或檢測樣品,PBS為空白對照,以檢測樣品Buffer為陰性對照,HRP-兔抗NK的多抗為檢測抗體。測定單抗靈敏度時,用表位抗體包被過夜,洗滌、加入倍比稀釋的NK,37 ℃孵育2 h,以HRP-兔抗NK的IgG為檢測抗體,TMB顯色,450 nm測定吸光度。以測定值與對照值之比[(OD樣品-OD陰性)/OD陰性]≥2.1時的最大稀釋度為NK最小檢測靈敏度。
1.4.4 抗體HRP標記及單克隆抗體識別位點的比較 HRP標記試劑盒用于HRP和單抗的偶聯(lián),競爭抑制法測定抗體識別位點。NK包被過夜,洗滌,抗體(倍比稀釋)與酶標抗體等體積混合,37 ℃孵育,洗滌,TMB顯色,測定450 nm的OD值。競爭抑制率=(1-加入競爭抗體孔/對照)×100%。以抗體自身競爭抑制率50%對應的未標記抗體濃度為標準,比較未標記抗體與該酶標抗體競爭時50%抑制率對應的濃度,二者水平越接近說明兩者的識別位點越相似甚至相同。
1.5 Caco-2細胞模型構建及鑒定
成熟的Caco-2細胞即可形成與腸上皮細胞相同的細胞極性和致密的單細胞層組織,是研究藥物吸收轉運機制、預測體內(nèi)吸收的一個較理想的體外模型,本研究選用Caco-2細胞模型研究NK的轉運過程[6]。
1.5.1 建立Caco-2細胞模型 以2×105/mL的密度接種Caco-2細胞于Transwell小室內(nèi),加入1 640完全培養(yǎng)基培養(yǎng)。采用激光共聚焦顯微鏡觀察細胞微絨毛結構及細胞間緊密連接情況,確定是否建立Caco-2單細胞層;跨膜電阻(trans-epithelial electrical resistance,TEER)值驗證單細胞層的完整性(滿足TEER為300~500 Ω/cm2)。
1.5.2 AKP檢測Caco-2細胞模型的通透性 堿性磷酸酶AKP是腸上皮細胞的標志性酶,測定刷狀緣(apical side,AP)側和基底(basolateral side,BL)側的AKP酶活性并加以比較,可作為衡量單細胞層極化程度的指標。分別從Transwell小室的AP側和BL側吸取培養(yǎng)液,按照試劑盒(凱基生物KGT043)檢測流程,在492 nm處檢測并計算出相應的AKP活性,當AP側的酶活性遠大于BL側時,表明細胞生長已經(jīng)形成了極性,具有通透性,Caco-2細胞模型可用于藥物吸收實驗。
1.6 NK轉運途徑初探
經(jīng)典理論認為,大分子蛋白保留活性進入細胞,胞吞是主要的途徑[7]。我們利用低溫條件下,細胞胞吞功能被阻斷的特性,在Caco-2細胞模型中,觀察NK在4 ℃和37 ℃條件下透過細胞膜的情況,并用酶聯(lián)檢測細胞模型中AP側和BL側NK的含量,探討NK跨膜轉移機制。
2 結果
2.1 抗NK單克隆抗體制備及鑒定
BALB/c小鼠經(jīng)NK免疫后,通過細胞融合及篩選得到穩(wěn)定分泌抗體的細胞株6株(命名為:C3/G11/F4/A7/H2/E5)。
2.1.1 雜交瘤細胞的染色體分析 6株細胞的染色體數(shù)目均在100~120之間,接近脾細胞與骨髓瘤細胞染色體數(shù)的總和;細胞大多數(shù)為端著絲粒染色體,偶可見中部著絲粒染色體,符合雜交瘤細胞株的特點(圖1)。
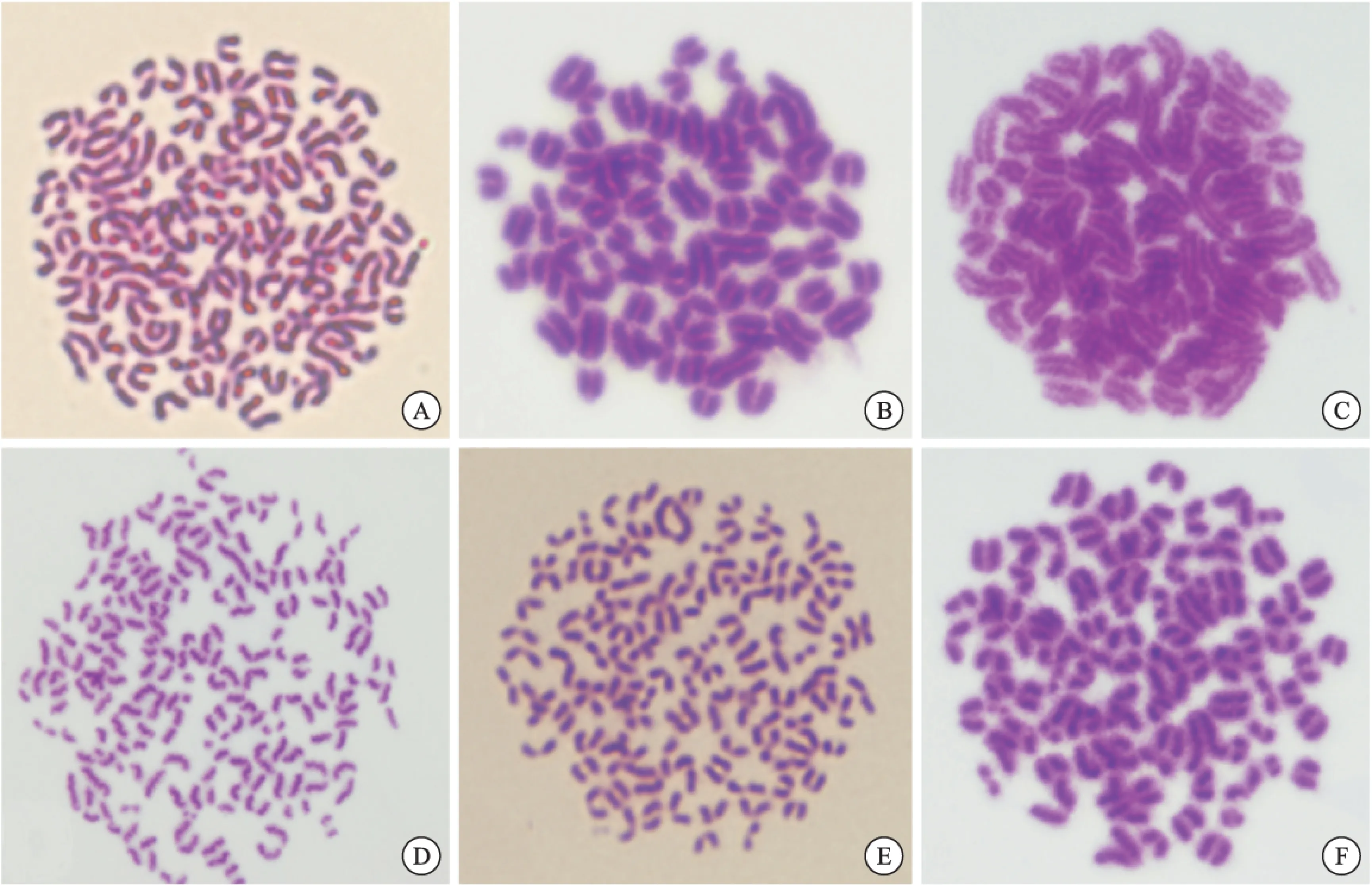
圖1 雜交瘤細胞染色體分析
注:A:C3;B:G11;C:F4;D:A7;E:H2;F:E5
2.1.2 單克隆抗體的抗體類型鑒定及抗體純化 5株單抗的重鏈是IgG1,1株重鏈是IgM,輕鏈均為κ型(表1);根據(jù)抗體亞型選擇純化體系純化抗體,純化結果如圖2所示。
2.1.3 抗體識別表位鑒定 當競爭抑制率為50%時,H2/A7/E5濃度接近,即它們識別的位點相似或相同,而H2/G11/C3/F4在競爭抑制率為50%時的濃度差異均大于400倍,說明它們識別表位不同(圖3)。

表1 單克隆抗體亞型鑒定
圖2 NK單抗純度檢測
注:A.未還原;B.還原;M: Marker;1:C3;2:G11;3:F4;4:A7;5:H2;6:E5
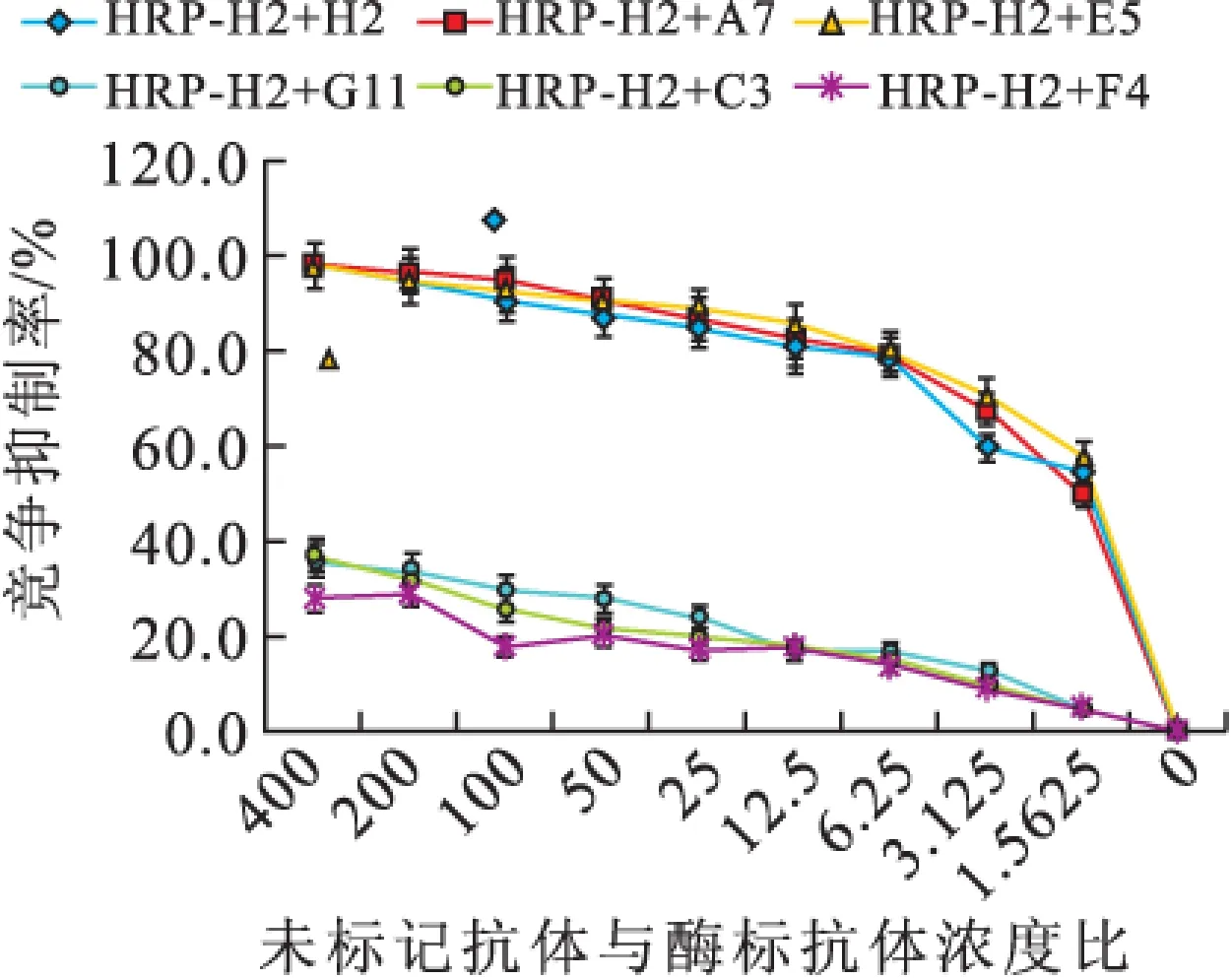
圖3-1 未標記單抗對HRP-H2結合NK的競爭抑制(n=3)
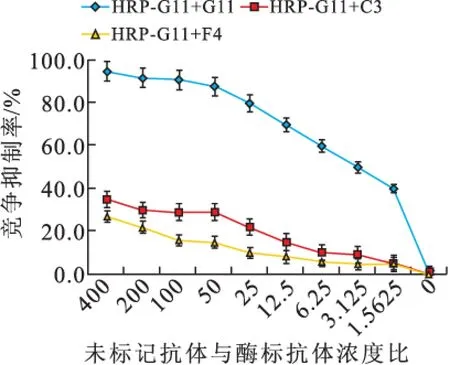
圖3-2 未標記單抗對HRP-G11結合NK的競爭抑制(n=3)
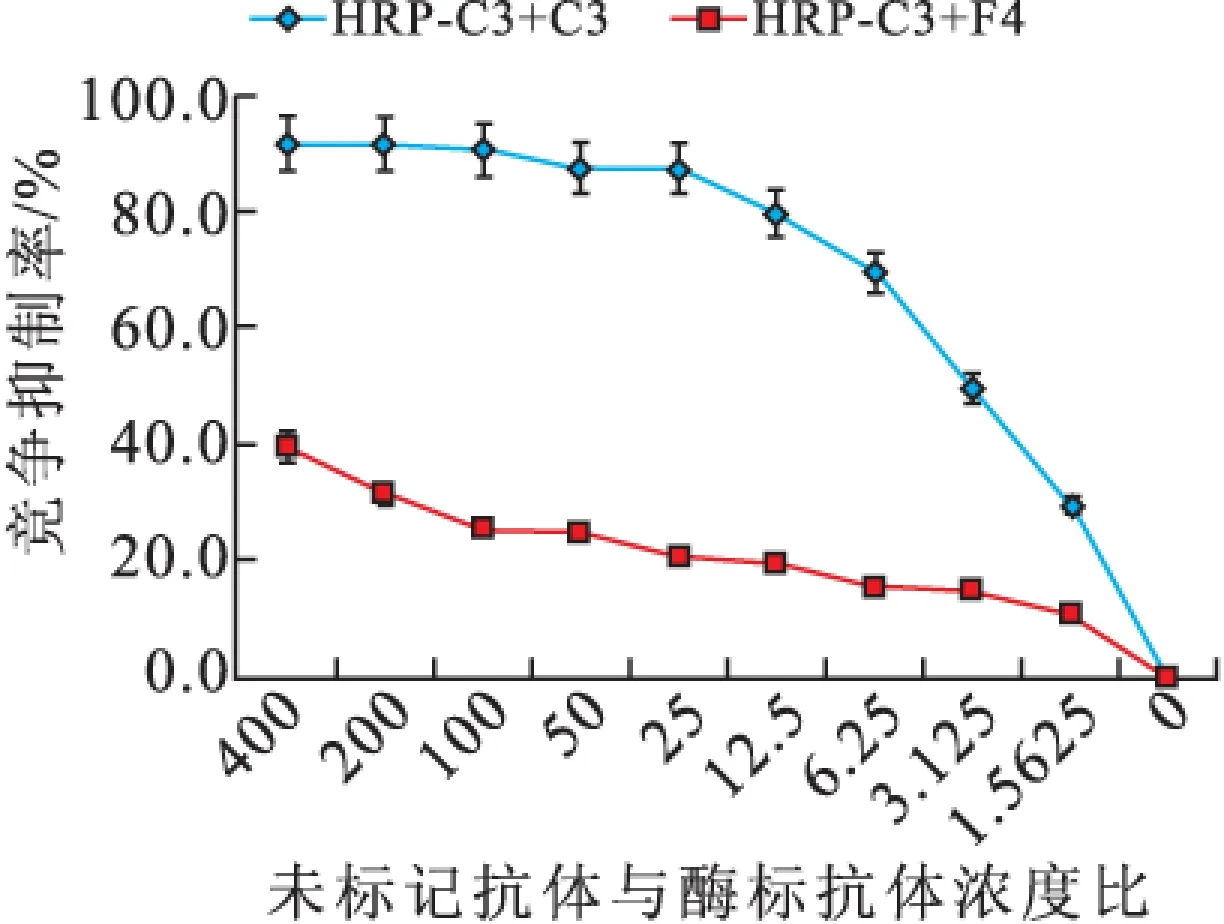
圖3-3 未標記單抗對HRP-C3結合NK的競爭抑制(n=3)
2.1.4 Western Blot檢測抗體特異性 6株單抗在27.5 KD處都有特異性條帶,說明得到的抗體是抗NK的特異性抗體(圖4)。
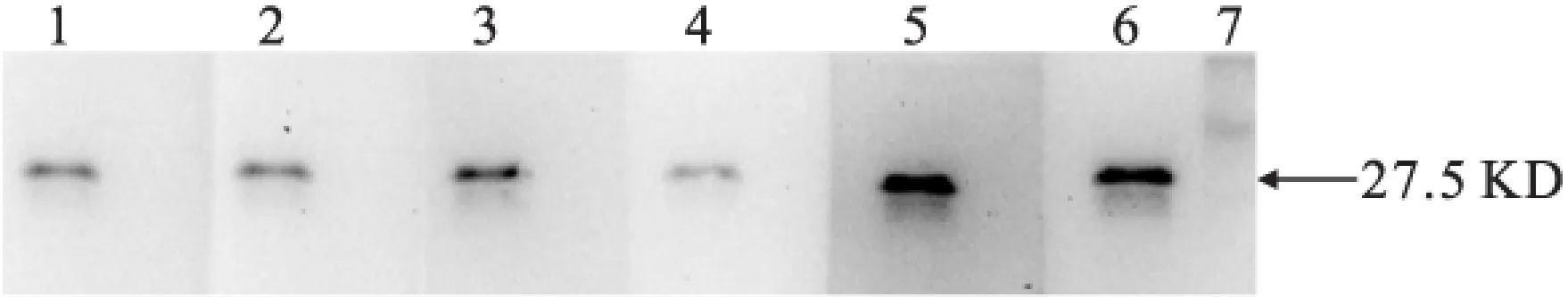
圖4 單抗特異性檢測
注:泳道1:C3;泳道2:G11;泳道3:F4;泳道4:A7;泳道5:H2;泳道6:E5;泳道7:Marker
2.2 NK酶聯(lián)檢測體系的建立及單抗檢測靈敏度測定
6株單抗檢測NK的最小靈敏度不同,分布在0.781~20 ng/mL之間,表明建立的酶聯(lián)體系可以有效檢測NK,并監(jiān)控其跨膜轉運過程。
2.3 NK跨膜轉運途徑初探
Caco-2細胞模型建立后,激光共聚焦顯微鏡觀察細胞微絨毛結構及細胞間緊密連接情況,結果顯示,細胞呈“鋪路石”狀,規(guī)則,多邊形,排列緊密,緊密連接清晰可見;且跨膜電阻TEER為360 Ω/cm2;提示已形成完整的細胞單層,且細胞膜完整性良好。AKP檢測顯示AP側的酶活性遠大于BL側,表明細胞生長已形成極性,具有通透性,可用于模擬小腸粘膜上皮細胞的吸收實驗。經(jīng)典理論認為,大分子蛋白保留活性進入細胞,胞吞是主要的途徑。而低溫條件下,細胞胞吞功能將被阻斷。酶聯(lián)結果顯示,在Caco-2細胞模型中,NK在4 ℃ 和37 ℃都能有效穿透細胞膜屏障;可見,NK腸道吸收過程中胞吞作用不是主要途徑。我們推測,NK活性肽段很有可能是通過分子內(nèi)的蛋白轉導結構域(Protein transduction domain,PTD)直接介導而實現(xiàn)其腸道吸收轉運。
2.4 NK蛋白轉導結構域PTD預測
鑒于PTD在既往大分子蛋白質(zhì)跨膜轉運過程中所發(fā)揮的非經(jīng)典胞吞介導作用[8],我們不禁產(chǎn)生這樣的疑問:同樣通過非經(jīng)典胞吞作用實現(xiàn)跨膜轉運的NK分子上是否也存在PTD結構域?NK經(jīng)腸吸收的特性是否也與PTD結構域介導有關?為探究上述問題,課題組對NK分子的結構進行了生物信息學檢索和建模工作,借助NCBI、SWISS MODEL、SOFTBERRY等軟件對NK的三維構象、功能結構域進行預測,結果顯示:NK至少含有3段穿膜相關序列(transmembrane segments),分別位于肽鏈的第72~94 Aas處、第142~156 Aas處和第225~238 Aas處,長度小于30 Aas,且富含疏水性氨基酸(Ala最多),空間構象多為α螺旋,與穿膜肽的特征相吻合(圖5)[9]。
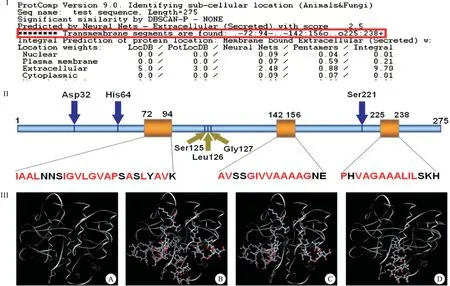
圖5 NK穿膜肽段預測及三維結構圖
注:I:SOFTBERRY預測結果,框內(nèi)為穿膜肽段;II:NK結構域示意圖,箭頭表示催化位點及底物結合位點,框內(nèi)表示可能的穿膜結構域;III-A:swiss model預測的NK三維預測圖;III-B:3個穿膜域;III-C:第1個和第2個穿膜域,III-D:第3個穿膜域(從N端到C端)
3 討論
細胞穿膜肽(cell-penetrating peptide,CPP)是近年來備受關注的蛋白轉導肽,是一種具有跨膜轉導功能的PTD,其長度小于30個氨基酸殘基,可通過巨胞飲而非經(jīng)典胞吞作用攜帶蛋白質(zhì)、多肽、核酸等大分子物質(zhì),通過無受體介導、無耗能的方式,進入哺乳動物細胞,轉導效率高且不會造成細胞損傷。利用穿膜肽作為靶向導入載體,將有利于增加蛋白質(zhì)、肽類等大分子藥物的膜透過性,在細胞生物學、基因治療、藥物體內(nèi)轉運、臨床藥效評價等研究領域,均具有誘人的應用前景[8,10]。
本研究以NK單抗為探針,建立其酶聯(lián)檢測體系,監(jiān)控Caco-2細胞模型中NK的跨膜轉運過程,進而探討NK獨特的跨小腸粘膜吸收機制。研究已證實,NK不以經(jīng)典胞吞方式跨膜轉運,課題組后續(xù)研究將著重篩選及證實候選NK分子中PTD 是否具有跨膜轉運特性及其攜帶大分子蛋白進入細胞的能力,并明確NK 的PTD 定位及其穿膜機制,獲得來自NK的CPP。
迄今為止,有關CPP成功應用于肽類口服藥物載體改造的報道還不多,主要原因在于目前所發(fā)現(xiàn)的天然CPP種類和數(shù)量還很少,限制了它的選擇和應用。追溯天然CPP的研發(fā)歷程,不難發(fā)現(xiàn),CPP大多是從具有跨膜轉導功能的天然蛋白質(zhì)的蛋白轉導結構域PTD中鑒定出來的,如Tat和VP22等[8]。因此,闡明具有轉導特性的天然蛋白NK的跨膜轉運特性,篩選和鑒定介導蛋白跨膜運輸?shù)腜TD就成為獲得新型穿膜肽的有效手段,為研發(fā)以穿膜肽為基礎的高性能藥物運輸新載體奠定基礎。
[1]Fasinu P,Pillay V,Ndesendo V M,etal.Diverse approaches for the enhancement of oral drug bioavailability[J].Biopharm Drug Dispos,2011,32(4):185-209.
[2]張志榮,董爾丹,吳鐳,等.生物大分子藥物遞送系統(tǒng)研究現(xiàn)狀與前沿方向[J].中國基礎科學,2014,16(5):3-8.
[3]Fujita M,Hong K,Ito Y,etal.Transport of nattokinase across the rat intestinal tract[J].Biol Pharm Bull,1995,18(9):1194-1196.
[4]Kamiya S,Hagimori M,Ogasawara M,etal.In vivo evaluation method of the effect of nattokinase on carrageenan-induced tail thrombosis in a rat model[J].Acta Haematol,2010,124(4):218-224.
[5]Dabbagh F,Negahdaripour M,Berenjian A,etal.Nattokinase: production and application[J].Appl Microbiol Biotechnol,2014,98(22):9199-9206.
[6]黃海智,陳健樂,程煥,等.Caco-2細胞模型預測活性物質(zhì)吸收代謝的研究進展[J].中國食品學報,2015,15(1):164-172.
[7]楊帆,李淑丹.對胞吞和胞吐有關知識的再討論[J].中學生物教學,2014(10):64.
[8]Kurrikoff K,Gestin M,Langel ü.Recent in vivo advances in cell-penetrating peptide-assisted drug delivery[J].Expert Opin Drug Deliv,2016,13(3):373-387.
[9]曹贊霞,董川,趙立嶺,等.細胞穿膜肽的穿膜活性與序列特征的關系[J].生物化學與生物物理進展,2016,43(1):75-82.
[10] 范博,金明姬,黃偉,等.細胞穿膜肽在藥物遞送系統(tǒng)中的研究進展[J].藥學學報,2016,51(2):264-271.
A Study on the Detection System and Transmembrane Transport Mechanism of Nattokinase
Li Minhui1, Chen Yu2, Jiang Yuliang2, Li Yan2, Yu Yun3, Mao Mingxing2, Lin Dingbiao2, Yang Yaqiong3, Yang Ping3△.
1. Center for Scientific Research, Chengdu Medical College, Chengdu 610083, China; 2. School of Biomedical Sciences, Chengdu Medical College, Chengdu 610083, China;3. School of Basic Medical Sciences, Chengdu Medical College, Chengdu 610083, China
Objective To establish the detection system of nattokinase (NK) and explore its transmembrane transport mechanism. Methods The anti-NK monoclonal antibodies were screened by hybridoma technology. The monoclonal antibody epitopes were identified by competitive inhibition assay. The monoclonal specificity was tested by Western Blot. The monoclonal antibody sensitivities were evaluated by the Sandwich ELISA method. The transmembrane segments of NK were revealed by bioinformatics. Results Six hybridoma cell lines with stable secrete and anti-NK antibodies were obtained, among which three monoclonal antibodies recognize similar antigen epitopes and the others recognize the different antigen epitopes. The minimum detection sensitivity of NK ranged from 0.78 ng/mL to 20.00 ng/mL. Caco-2 cell model results indicated that endocytosis was not the main way of NK transmembrane transport. Bioinformatics showed that NK contained three transmembrane segments. Conclusion The ELISA system for NK based on the monoclonal antibodies could monitor the transmembrane transport process of NK effectively and NK may cause its intestinal absorption with the mediation of the protein transduction domain.
Nattokinase; Monoclonal antibodies; Transmembrane transport; Protein transduction domain
http://www.cnki.net/kcms/detail/51.1705.R.20160613.1051.012.html
10.3969/j.issn.1674-2257.2016.05.003
四川省教育廳項目(No:13ZB0220);四川省科技廳項目(No:2015JY0205);四川省衛(wèi)生廳項目(No:130302,130298) ;成都醫(yī)學院科研基金(No:CYZ11-005);國家級大學生創(chuàng)新項目(No:201313705007,201313705003,201413705005)
R977.3
A
△通信作者:楊平,E-mail:920192655@qq.com

