白花丹參水提物對糖尿病大鼠心肌損傷的影響及機制
宋曉,黃東輝,郭征東,李菁,唐先格
(泰山醫學院附屬醫院,山東泰安271000)
?
白花丹參水提物對糖尿病大鼠心肌損傷的影響及機制
宋曉,黃東輝,郭征東,李菁,唐先格
(泰山醫學院附屬醫院,山東泰安271000)
目的 觀察白花丹參水提物對糖尿病大鼠心肌損傷的治療作用,探討其作用機制。方法 選取健康雄性Wistar大鼠72只,隨機選出12只作為空白對照組;余60只以高糖、高脂飲食喂養并尾靜脈注射鏈脲佐菌素建立糖尿病模型。選取48只造模成功的大鼠隨機均分為四組,分別為白花丹參低劑量組,灌胃給予白花丹參15 g/(kg·d);白花丹參高劑量組,灌胃給予白花丹參30 g/(kg·d);吡格列酮組灌胃給予吡格列酮 10 mg/(kg·d);模型組灌胃給予等量生理鹽水;均連續給藥4周。各組于末次給藥后禁食12 h,檢測空腹血糖(FPG),采用ELISA試劑盒檢測瘦素(Leptin)、脂聯素(APN)、TNF-α、IL-6;處死大鼠取心肌組織進行HE染色,顯微鏡下觀察心肌組織病理變化。結果 模型組FPG及血清Leptin、TNF-α、IL-6水平均高于其他各組,血清APN水平均低于其他各組;白花丹參低劑量組及高劑量組FPG均高于吡格列酮組;白花丹參高劑量組血清APN水平高于吡格列酮組和低劑量組,血清Leptin、TNF-α、IL-6水平均低于吡格列酮組和低劑量組;各指標組間比較P均<0.01。模型組心肌細胞排列迂曲紊亂,細胞壞死及炎細胞浸潤,細胞間成纖維細胞及膠原纖維增生;與模型組比較,吡格列酮組、白花丹參低劑量組心肌細胞排列相對整齊,局部可見心肌纖維互相融合;白花丹參高劑量組心肌細胞排列整齊,偶見細胞壞死及少量炎細胞浸潤。結論 白花丹參水提物對糖尿病大鼠心肌損傷有治療作用;抑制體內炎癥反應可能是其作用機制。
糖尿病;白花丹參;瘦素;脂聯素;腫瘤壞死因子α;白細胞介素6
糖尿病是一種慢性代謝紊亂性疾病,心肌損傷是其常見并發癥。其發生機制主要為氧化應激、脂肪炎癥因子增多、糖基化終末產物形成等。白花丹參是丹參的變種,主產于泰山,具有很強的抗脂質過氧化、清除自由基、調節血脂和血糖等作用[1],目前已經用于防治冠心病、腦血管病和外周血管病等,但其對糖尿病心肌損傷影響的報道較少。2014年10月~2015年3月,本研究觀察了白花丹參水提物對糖尿病大鼠心肌損傷的影響,現分析結果并探討其作用機制。
1 材料與方法
1.1 材料 健康雄性Wistar大鼠(20141112號)72只,體質量200~220 g,購自山東魯抗公司實驗動物中心。白花丹參,產自萊蕪苗山白花丹參種植基地。白花丹參水溶性提取物:稱取白花丹參根適量,切片后加蒸餾水浸泡2 h,加熱煮沸,開始用強火,沸騰后改用文火,保持微沸30 min,攪拌,趁熱過濾,留取濾液;藥渣再加蒸餾水同法煮沸30 min,過濾,留取濾液;合并濾液,經旋轉蒸發儀濃縮,加蒸餾水稀釋至所需濃度,灌封,4 ℃冰箱保存備用。鏈脲佐菌素(STZ),購自北京博愛科貿有限責任公司,用0.1 mol/L(pH 4.5)枸櫞酸鈉緩沖液稀釋,濃度為10 g/L,隨用隨配。吡格列酮,購自成都宇洋高科技發展有限責任公司。瘦素(Leptin)、脂聯素(APN)、TNF-α、IL- 6檢測試劑盒(ELISA法)均購自北方生物技術研究所。
1.2 模型制作及處理 72只大鼠均適應性喂養7天,禁食12 h,自由飲水。隨機選出12只作為空白對照組,標準飼料喂養。余60只制備糖尿病模型:高脂飼料(2.5%膽固醇、10%豬油、20%蔗糖、1%膽酸鹽、66.5%常規飼料)喂養1個月;一次性尾靜脈注射STZ 10 g/L(35 mg/kg)作用72 h;尾尖取血,檢測血糖。將血糖≥16.7 mmol/L大鼠確定為糖尿病模型成功[2]。共造模成功55只,選取48只隨機均分為模型組、白花丹參低劑量組、白花丹參高劑量組、吡格列酮組,其余備用。白花丹參低劑量組及高劑量組分別灌胃給予白花丹參15、30 g/(kg·d),吡格列酮組灌胃給予吡格列酮 10 mg/(kg·d),模型組灌胃給予等量生理鹽水,均連續給藥4周。1.3 相關指標觀察 各組于實驗的第4周末在末次給藥后禁食12 h,斷尾采血,檢測空腹血糖(FPG);留取血液樣本5 mL,室溫下靜置30 min,3 000 r/min離心15 min,取血清,采用ELISA試劑盒檢測Leptin、APN、TNF-α、IL-6。處死大鼠,取心肌組織,常規切片,行HE染色,顯微鏡下觀察心肌組織病理變化。
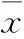
2 結果
2.1 各組FPG及血清Leptin、APN、TNF-α、IL-6水平比較 給藥第4周末,模型組FPG及血清Leptin、TNF-α、IL-6水平均高于其他各組,血清APN水平均低于其他各組;白花丹參低劑量組及高劑量組FPG均高于吡格列酮組;白花丹參高劑量組血清APN水平高于吡格列酮組和低劑量組,血清Leptin、TNF-α、IL-6水平均低于吡格列酮組和低劑量組,各指標組間比較P均<0.01。見表1。
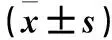
表1 各組血清FPG、leptin、APN、TNF-α、IL-6水平比較
注:與模型組比較,*P<0.01;與吡格列酮組比較,△P<0.01;與白花丹參低劑量組相比,#P<0.01。
2.2 各組心肌組織病理學變化 空白對照組心肌結構清晰,肌纖維無斷裂,心肌細胞排列整齊。模型組心肌細胞邊界模糊,排列迂曲紊亂,細胞核濃縮、深染、呈不規則狀;心肌細胞間成纖維細胞及膠原纖維增生,間隙增寬,存在不同程度的細胞壞死及炎細胞浸潤。與模型組比較,吡格列酮組、白花丹參低劑量組心肌細胞排列相對整齊,局部可見心肌纖維互相融合,可見嗜酸性變的心肌纖維呈多灶性分布,間隙略增寬;白花丹參高劑量組心肌細胞排列整齊,間隙略增寬,偶見細胞壞死及少量炎細胞浸潤。
3 討論
近年研究發現,炎癥反應參與了糖尿病的發生。2型糖尿病(T2DM)患者體內高糖狀態可誘導多種炎癥相關因子水平明顯升高,導致體內慢性炎癥的長期存在,與胰島素抵抗、內皮功能障礙、細胞凋亡、動脈粥樣硬化等密切相關,參與糖尿病及其并發癥如糖尿病心肌損傷的發生、發展[3,4]。
TNF-α是一種多效的炎癥因子,主要由單核細胞、巨噬細胞和T細胞產生,急性期可通過誘導纖維化、誘導機體氧化應激反應、損傷腎臟上皮細胞和腎小球基底膜(GBM),進而促進糖尿病腎病的發生[5]。研究發現,TNF-α參與糖尿病心肌損傷的發生,其可與心肌細胞膜TNF-α受體結合形成信號轉導復合物,激活絲裂原蛋白激酶,誘導細胞死亡[6];TNF-α亦可引起心肌間質膠原纖維堆積、膠原蛋白沉積、間質纖維化等[7]。IL-6主要由免疫活性細胞、脂肪細胞和肌肉細胞產生,可促進纖維蛋白原、纖溶酶原激活物抑制因子1(PAI-1)和CRP分泌,促進炎癥反應和胰島素抵抗的發生,被認為是T2DM發病的獨立危險因素[8]。高糖狀態促進IL-6分泌,進而刺激血管內皮因子釋放,使平滑肌細胞過度增生,內皮通透性增強,血管受損,促進動脈硬化的發生、發展;IL-6亦可誘導成纖維細胞增殖,產生大量血小板源性生長因子,增加血管阻力,促進心肌損傷的發展。
APN是一種由脂肪細胞分泌的特異蛋白質,在脂肪組織中高表達,在血漿中其濃度亦相對較高,具有抗炎、抗動脈粥樣硬化和增加胰島素敏感性等作用。流行病學調查發現,血漿APN濃度降低是T2DM發生的獨立危險因素[9],APN被認為是一種糖尿病的保護性因子[10]。糖尿病心肌病患者血清APN水平較正常組明顯下降,且與糖基化終末產物(AGEs)水平呈負相關[11],提示APN參與了糖尿病心肌損傷的發生。Leptin是由脂肪細胞分泌的一種肽類激素。正常水平的Leptin具有抑制食欲、減少食物攝入、增加能量代謝等作用,亦可對抗心肌纖維化、抑制心臟左心室重構等[12]。有研究證明, T2DM患者由于Leptin抵抗,外周Leptin相對不足,導致脂質在心肌細胞沉積,損傷心肌細胞;高Leptin血癥可使交感神經活性增強,加重心臟負荷和心肌細胞代謝紊亂,亦可通過上調交感神經活性,導致心臟負荷加重和脂肪氧化增加,促進糖尿病心肌病變的發生[13]。
丹參的有效成分主要為脂溶性的菲醌類衍生物和水溶性的酚酸類成分,其水溶性成分具有較好的降糖、調脂、改善血流變等作用。白花丹參主要含有酚酸類、黃酮類及多種微量元素,具有普通丹參的藥理作用,其丹參酮ⅡA的含量是普通丹參的兩倍,隱丹參酮、丹酚酸以及微量元素的含量比普通丹參高出數倍。目前,白花丹參已經廣泛用于防治冠心病、腦血管病和外周血管病等;近年來采用傳統工藝與現代技術相結合的方法精制成的白花丹參茶,可降低膽同醇、高血壓,預防血栓及冠心病等。
本研究結果顯示,空白對照組心肌結構正常;模型組在高血糖環境下,心肌結構損傷嚴重,吡格列酮組、白花丹參各治療組心肌細胞損傷均輕于模型組,而以高劑量組最輕,說明白花丹參水提物、吡格列酮均可減輕高糖對心肌的損傷。模型組血清Leptin、TNF-α、IL-6水平均高于其他各組,血清APN水平均低于其他各組,說明脂肪炎癥因子的紊亂是促進糖尿病心肌損傷的發生、發展的因素之一。白花丹參高劑量組血清APN水平高于吡格列酮組和低劑量組,血清Leptin、TNF-α、IL-6水平均低于吡格列酮組和低劑量組,吡格列酮組和低劑量組之間無明顯差異,說明白花丹參水提物可有效抑制TNF-α、IL-6、Leptin分泌,促進APN分泌,減輕糖尿病大鼠的慢性炎癥反應,進而抑制細胞凋亡、膠原纖維堆積、間質纖維化、平滑肌過度增生、心肌細胞脂質沉積等,延緩糖尿病心肌損傷發生、發展,且隨劑量增加效果更加明顯。
綜上所述,白花丹參水提物可抑制糖尿病大鼠心肌損傷的發生,抑制體內炎癥反應可能是其作用機制。
[1] 李大偉,夏青,夏作理.白花丹參對高脂血癥大鼠血脂和血糖的調節作用[J].時珍國醫國藥,2007,4(18):794-795.
[2] 郭嘯華,劉志紅,李恒,等.高糖高脂飲食誘導的2型糖尿病大鼠模型及其腎病特點[J].中國糖尿病雜志,2002,10(5):290-294.
[3] Yudkin JS. Insulin resistance and the metabolic syndrome-or the pitfalls of epidemiology[J]. Diabetologia, 2007,50(8):1576-1586.
[4] Kajitani N, Shikata K, Nakamura A, et al. Microinflammation is a common risk factor for progression of nephropathy and atherosclerosis in Japanese patients with type2 diabetes[J]. Diabetes Res Clin Pract, 2010,88(2):171-176.
[5] Zhang B, Ramesh G, Norbury CC, et al. C13isplatin-induced nephrotoxicity is mediated by tumor necrosis factor-alpha produced by renal parenchymalcells[J]. Kidney Int, 2007,72(1):37-44.
[6] Grunenfelder J, Nminiati D, Murata S, et al. Up regulation of Bcl-2 through hyperbaric pressure transfection of TGF-β1: ameliorates is chemi-areperfusion injury in rat cardiac allo-Grafts[J]. J Heart Lung Transplant, 2004,21(2):244-250.
[7] Sun Y, Zhang J, Zhang JQ, et al. Local angiotensin Ⅱ and transforming growth factor-beta1 in renal fibrosis of rats[J]. Hypertension, 2004,35(5):1078-1084.
[8] Joachim S, Anja K, Matthias M, et al. Inflammatory cytokine and the risk to develop type 2 diabetes. Result of the prospective population based European prospective investigation into cancer and nutrition-otsdam study[J]. Diabetes, 2003,52(3):812.
[9] Gonon AT, Widegren U, Bulhak A, et al. Adiponectin protects againstmyocardial ischaemia-reperfusion injury via AMP-activated proteinkinase, Akt, and nitric oxide[J]. Cardiovasc Res, 2008,78(1):116-122.
[10] Tsai WC, Lin CC, Chen JY, et al. Association of adiponectin with procollagentype Ⅰ carboxyterminal propeptide in non-diabetic essential hypertension[J]. Blood Press, 2008,17(4):233-238.
[11] Li J, Su S, Zong X. Analysis of the association between adiponectin, adiponectin receptor 1 and diabetic cardiomyopathy[J]. Exp Ther Med, 2014,7(4):1023-1027.
[12] Lieb W, Sullivan LM, Araqam J, et al. Relation of serum leptin with cardiac mass and left atrial dimension in individuals >70 years of age[J]. Am J Cardiol, 2009,104(4):602-605.
[13] Bell DSH.Use of beta blockers in patients with diabete.Endocrinologist, 2003(13):116-123.
·作者·編者·讀者·
攜手《山東醫藥》 共創品牌形象
《山東醫藥》創刊于1957年,是山東省衛生廳主管的醫學類學術期刊,國內外公開發行。本刊是中國學術期刊綜合評價數據庫來源期刊,是廣大醫務人員進行學術交流的主要陣地,在全國有較大影響。本刊注重理論與實踐相結合,醫藥學術研究與醫療臨床實踐相結合,面向廣大醫療單位及醫藥科研與生產單位。歡迎各級各類衛生單位和醫療器械、醫用軟件等生產單位與《山東醫藥》合作,宣傳管理經驗,樹立品牌形象。
聯系電話:0531-88957404
山東省高等學校科技計劃項目(J12LL03)。
黃東輝(E-mail: ahuang1115@126.com)
10.3969/j.issn.1002-266X.2016.36.012
R587.1
A
1002-266X(2016)36-0040-03
2015-11-05)

