糖尿病腎病大鼠腎組織MMP-9表達及意義
凌厲,陳立波,勞國娟,張長寧
(1廣東醫學院附屬深圳南山醫院,廣東深圳518052;2中山大學孫逸仙紀念醫院)
?
·基礎研究·
糖尿病腎病大鼠腎組織MMP-9表達及意義
凌厲1,陳立波1,勞國娟2,張長寧1
(1廣東醫學院附屬深圳南山醫院,廣東深圳518052;2中山大學孫逸仙紀念醫院)
目的 探討基質金屬蛋白酶9(MMP-9)在糖尿病腎病發生、發展中的作用。方法 將60只Wistar大鼠隨機分為兩組,對照組24只、模型組36只,模型組一次性腹腔注射鏈脲佐菌素(150 mg/kg)制備糖尿病模型,成模24只;對照組注射等量的檸檬酸緩沖液。給藥1、2、4、8周時,兩組分別隨機選擇6只大鼠,取其腎組織觀察病理學變化,標本行HE染色,采用免疫組化法檢測腎組織MMP-9表達,計數每個腎小球內MMP-9染色陽性的足細胞(MMP-9陽性足細胞)數量。采用RT-PCR法檢測腎組織TET1蛋白、活化因子蛋白1(AP-1 )mRNA相對表達量。結果 模型組給藥1、2、4、8周時可見腎小球體積逐漸增大,基底膜逐漸增厚,毛細血管袢逐漸擴張,伴隨腎小管擴張或萎縮,可見輕度纖維化。對照組給藥1周時 MMP-9陽性足細胞數量為(0.47±0.31)個;模型組給藥1、2、4、8周時MMP-9染色陽性足細胞數量分別為(2.75±1.29)、(4.59±1.63)、(7.95±2.36)、(15.61±2.77)個,呈逐漸增高趨勢,且均高于對照組,組間及組內比較P均<0.05。模型組給藥后1、2、4、8周時腎組織AP-1、TET1相對表達量呈逐漸增高趨勢,且均高于同時間點對照組,組間及組內比較P均<0.05。結論 MMP-9高表達參與了糖尿病腎病的發生、發展,激活AP-1、TET1基因可能是其作用機制。
糖尿病腎病;基質金屬蛋白酶9;活化因子蛋白1;TET1蛋白
糖尿病及其慢性并發癥是目前嚴重的社會問題。炎癥反應及代謝異常是糖尿病慢性并發癥的主要發病機制[1,2]。糖尿病腎病是一種常見的糖尿病微血管并發癥,是導致糖尿病患者死亡的原因之一,但其發生機制仍不明確。持續微量蛋白尿是糖尿病腎病早期主要臨床表現。Vestra等[3]發現,糖尿病腎病早期階段腎足突狀細胞的密度和數量與尿白蛋白排泄率呈正相關。正常生理條件下,腎臟內基質金屬蛋白酶9(MMP-9)主要來源于足細胞,對維持基底膜正常結構的動態平衡具有重要作用,但其與糖尿病腎病發生、發展的關系尚不明確。2015年3~11月,我們觀察了糖尿病腎病大鼠腎組織MMP-9表達,探討其對糖尿病腎病的影響及作用機制。
1 材料與方法
1.1 材料 60只體質量為220~250 g的健康雄性Wistar大鼠,購自廣東省醫學實驗動物中心[動物許可證編號:SYXK(粵)20130002]。鏈脲佐菌素(STZ)購自Sigma公司。鼠抗MMP-9單克隆抗體購自北京博奧森生物技術有限公司。活化因子蛋白1(AP-1)、ET1蛋白 PCR引物及試劑盒購自Invitrogen公司。
1.2 模型制作與處理 將60只大鼠隨機分為兩組,對照組24只、模型組36只。模型組一次性腹腔注射STZ(150 mg/kg)制備糖尿病模型,對照組注射相同劑量的檸檬酸緩沖液。給藥72 h時模型組尾靜脈采血檢測血糖,血糖≥16.7 mmol/L判定為造模成功。取造模成功的24只大鼠。在給藥1、2、4、8周時兩組分別隨機選擇6只大鼠,結扎腎動脈后取腎組織,-80 ℃冰箱保存。
1.3 腎組織病理學觀察 取兩組各時間點腎組織標本,4%多聚甲醛固定,脫水,透明,石蠟包埋,切片,HE染色,觀察腎組織病理變化。
1.4 腎組織MMP-9表達 采用免疫組化法。取兩組各時間點腎組織切片,常規處理后加入鼠抗MMP-9單克隆抗體(1∶500),4 ℃過夜;PBS緩沖液清洗,逐滴加入適量稀釋的辣根過氧化物標記的二抗,37 ℃或室溫下孵育10~15 min;PBS沖洗,顯色劑顯色,顯微鏡下觀察MMP-9表達。以PBS替代一抗作為陰性對照。每張切片隨機選擇30個不重疊視野,計數每個腎小球內MMP-9染色陽性(棕黃色)足細胞數量。
1.5 腎組織TET1、AP-1 mRNA表達 采用RT-PCR法。取兩組各時間點腎組織標本,TRIzol法提取總蛋白。參照PrimeScript RT試劑盒方法進行cDNA合成及反轉錄實驗。TET1 引物:上游5′-TGCCTGAATCGCTACCTCTACC-3′,下游5′-CTTGCGCCGAAGGTAGTCTTAT-3′;AP-1引物:上游5′-AGGCGGACATTCTGGAAATG-3′,下游5′-TCGTTCATGCACTCGCTGA-3′;GAPDH引物:上游5′-TGCTGATGTACCAGTTGCCG-3′,下游5′-GCACGGACACTCACAATGTTC-3′。計算TET1、AP-1基因相對表達量。每個實驗均重復3次,取平均值。
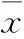
2 結果
2.1 腎組織病理學變化 對照組各時間點腎小球、腎小管及腎間質結構均清楚,未見明顯病理學改變。模型組給藥1周時腎小球體積略有增大,基底膜未見明顯增厚;2周時可見毛細血管袢擴張,腎小球肥大;4周時可見腎小球顯著增生,基底膜增厚、增寬,系膜基質顯著增多,伴隨腎小管擴張或萎縮,腎小管區可見炎癥細胞浸潤;8周時可見腎小球及腎小管病變進一步加重,腎小管區開始出現輕度纖維化。見插頁Ⅰ圖1。
2.2 腎組織MMP-9表達 對照組各時間點腎小球均僅有極少量MMP-9陽性表達細胞,因此僅選取對照組給藥1周時進行腎小球內MMP-9染色陽性足細胞數量計數。對照組給藥1周時MMP-9陽性足細胞數量為(0.47±0.31)個;模型組給藥1、2、4、8周時MMP-9陽性足細胞數量分別為(2.75±1.29)、(4.59±1.63)、(7.95±2.36)、(15.61±2.77)個,呈逐漸增高趨勢,且均高于對照組,組間及組內比較P均<0.05。見插頁Ⅰ圖2。
2.3 腎組織TET1、AP-1 mRNA表達 模型組給藥后1、2、4、8周時腎組織AP-1、TET1相對表達量呈逐漸增高趨勢,且均高于同時間點對照組,組間及組內比較P均<0.05。見表1。
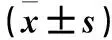
表1 腎組織TET1、AP-1 mRNA相對表達量
注:與對照組同時間點比較,*P<0.05;與同組給藥1周時比較,△P<0.05;與同組給藥2周時比較,#P<0.05;與同組給藥4周時比較,▲P<0.05。
3 討論
糖尿病腎病患者一旦發生臨床蛋白尿,腎臟病變難以逆轉,現有治療手段有限,療效不理想,最終發展為慢性腎功能衰竭。糖尿病腎病的發生、發展涉及多因素、多環節,糖脂代謝異常、腎臟血流動力學改變以及多種炎癥物質和細胞因子的產生一直被認為是導致糖尿病腎病的基本機制。建立穩定、有效的糖尿病腎病動物模型對于研究糖尿病腎病的機制具有重大意義。目前,研究糖尿病腎病動物模型均由糖尿病大鼠模型獲得[4],國際上常采用STZ誘導糖尿病建立糖尿病腎病模型。本研究模型組給藥1~8周時觀察到腎小球體積逐漸增大,基底膜逐漸增厚,毛細血管袢逐漸擴張,伴隨腎小管擴張或萎縮,可見輕度纖維化;以上病理改變印證糖尿病腎病動物造模成功。
MMP-9又稱明膠酶B,通過調節Ⅳ型膠原和層黏連蛋白的降解。在糖尿病患者及糖尿病動物模型的腎臟病理切片中發現,MMP-9可能在浸潤的巨噬細胞、小管上皮細胞、足突狀細胞、小球系膜細胞等處高表達[5]。高糖環境可誘導體外培養的足細胞高表達MMP-9[5]。本研究發現,MMP-9在糖尿病大鼠模型腎組織中表達明顯高于對照組,且隨著給藥時間的延長,MMP-9表達呈逐漸增高趨勢,提示MMP-9表達升高可能參與了糖尿病腎病的發生、發展。
AP-1通過賴氨酸拉鏈結構與DNA結合,這一結構屬于DNA結合蛋白中的堿性賴氨酸拉鏈結構[6]。AP-1和一些生長因子、細胞因子的基因轉錄有關,其活化可能參與一系列生物學改變,如細胞癌變、增殖與凋亡等,進而引起相應的生理和病理改變[7,8]。對胃癌細胞的研究發現,抑制AP-1激活可導致MMP-9表達增高,參與腫瘤的侵襲和轉移[9,10]。心肌梗死患者心肌組織AP-1激活可影響MMP-9表達[11]。Desnet等[12]研究發現,腎小管損傷程度及蛋白尿程度均與AP-1活性緊密相關。在急性或慢性炎癥損傷腎組織中,AP-1表達升高[13]。TET蛋白家族是一類在DNA主動去甲基化過程中發揮重要作用的酶蛋白家族,可催化甲基化胞嘧啶羥基化轉化為5-羥甲基胞嘧啶,進而脫甲基[14],是近年來表觀遺傳調控研究的熱點。TET蛋白家族有3個成員,TET1主要表達于胎兒組織及干細胞,TET2在造血系統中含量較高,TET3主要表達于結腸和肌肉等組織[15]。已有研究表明,在缺血再灌注損傷的小鼠腎臟中檢測到TET1基因表達異常,且與目的蛋白的DNA去甲基化調控相關[16]。在一項針對MCF-7乳腺癌細胞株的研究發現,敲除TET1基因可導致MMP-9表達異常及細胞侵襲性增強[17]。另一項針對人骨關節炎軟骨細胞的研究證實,炎癥因子通過改變TET1表達而影響MMP-1/MMP-3轉錄活性[18]。本研究結果顯示,糖尿病腎病大鼠腎組織AP-1、TET1相對表達量均高于對照組,且隨著腎損傷加重,二者的表達量均逐漸增加,提示二者的高表達可能參與了MMP-9啟動子的脫甲基化,促進MMP-9過度表達,進而參與糖尿病腎病的發生、發展。
綜上所述, MMP-9高表達參與了糖尿病腎病的發生、發展,激活AP-1、TET1基因可能是其作用機制。
[1] Du P, Fan B, Han H, et al. NOD2 promotes renal injury by exacerbating inflammation and podocyte insulin resistance in diabetic nephropathy[J]. Kidney International, 2013,84(2):265-276.
[2] Villeneuve L, Natarajan R. The role of epigenetics in the pathology of diabetic complications [J]. Am J Physiol Renal Physiol, 2010,299(1):14-25.
[3] Vestra M, Masiero A, Roiter A, et al. Is podocyte injury relevant in diabetic nephropathy? studies in patients with type 2 diabetes[J]. Diabetes, 2003,52(4):1031-1035.
[4] 李佑生,王文建. 嚙齒類糖尿病腎病動物模型研究進展[J].中國中醫基礎醫學雜志,2006,12(7):530-532
[5]Okada R, Kawai S, Naito M, et al. Matrix metalloproteinase-9 gene polymorphisms and chronic kidney disease[J]. Am J Nephrol, 2012,36(5):444-450.
[6] Shaulian E, Karin M. AP-1 as a regulator of cell life and death[J]. Nat CellBiol, 2002,4(5):E131-E136.
[7] Vesely PW, Staber PB, Hoefler G, et al. Translational regulation mechanisms of AP-1 proteins [J]. Mutat Res, 2009,682(1):7-12.
[8] Shin S, Asano T, Yao Y, et al. Activator protein-l has an essential role in pancreatic cancer cells and is regulated by a novel Akt-mediated mechanism[J]. Mol cancer Res, 2009,7(5):745-754,
[9] Osna N, Elliott K, Chaika O, et al. Histamine utilizes JAK-STAT pathway in regulating cytokine preduction[J]. Int Immunophartnacol, 2001(1):759-762.
[10] Wagner EF. AP-1 Introductory remarks[J]. Oncogene, 2001,20(19):2333-2497.
[11] Nakamura Y, Hoshino U. TH2 cytokines and associated transcription factors as therapeutic targets in asthma[J]. Curr Drug Targets Inflamm A1lergy, 2005,4(2):267-270.
[12] Desmet C, Gosset P,Henry E,et al.Treatment of experimental asthma by decoy-mediated local inhibition of activator protein-1[J]. Am J Respir Crit Care Med, 2005,172(6):671-678.
[13] Lee MJ, Rao YK, Chen K, et al. Andrographolide and 14-deoxy-11,12-didehydroandrographolide from andrographis paniculata attenuate high glucose-induced fibrosis and apoptosis in murine renal mesangeal cell lines[J]. J Ethnopharmacol, 2010,132(2):497-505.
[14] Bhutani N, Burns DM, Blau HM. DNA Demethylation Dynamics[J]. Cell, 2011,146(6):866-872.
[15] Ito S, D′alessio AC, Taranova OV, et al. Role of TET1 proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification[J]. Nature, 2010,466(7310):1129-1133.
[16] Huang N, Tan L, Xue Z, et al. Reduction of DNA hydroxymethylation in the mouse kidney insulted by ischemia reperfusion[J]. Biochem Biophys Res Commun, 2012,422(4):697-702.
[17] Lu HG, Zhan W, Yan L, et al. TET1 partially mediates HDAC inhibitor-induced suppression of breast cancer invasion[J]. Mol Med Rep, 2014,10(5):2595-600.
[18] Taylor SE, Smeriglio P, Dhulipala L, et al. A global increase in 5-hydroxymethylcytosine levels marks osteoarthritic chondrocytes[J]. Arthritis Rheumatol, 2014,66(1):90-100.
Expression and mechanism of MMP-9 in kidney tissues of rats with diabetic nephropathy
LINGLi1,CHENLibo,LAOGuojuan,ZHANGChangning
(1ShenzhenNanshanHospitalAffiliatedtoGuangdongMedicalCollege,Shenzhen518052,China)
Objective To investigate the effect of matrix metalloproteinase 9 (MMP-9) expression in the occurrence and development of diabetic nephropathy of rats.Methods Sixty Wistar rats were randomly divided into two groups: the control group (n=24) and the model group (n=36). Rats in the model group received intraperitoneal injection of STZ (150 mg/kg) to establish the diabetes models while rats in the control group received equal dose of citrate buffer. At 1, 2, 4, and 8 weeks after treatment, 6 rats were randomly selected from each group and their renal tissues were collected and analyzed by HE staining, immunohistochemistry for MMP-9 expression. And we counted the sertoli cells with MMP-9 positive staining in glomeruli (MMP-9 positive sertoli cells). RT-PCR was used to detect the TET1 and AP-1 mRNA expression. Results At 1, 2, 4, and 8 weeks after drug administration, rats of the model group showed gradually enlarged renal glomeruli, thickened basement membrane, and expanded capillary loops, with visible tubular dilatation or atrophy and mild fibrosis. MMP-9-positive cells in each renal glomerulus of the control group was 0.47±0.31 at 1 week after drug administration; while this number of the model group was 2.75±1.29, 4.59±1.63, 7.95±2.36 and 15.61±2.77 respectively at 1, 2, 4, and 8 weeks after drug administration, which showed an increasing tendency and was significantly higher than that of the control group (allP<0.05). The relative mRNA levels of AP-1 and TET1 of the model group showed an increasing tendency, which were also significantly higher than those of the control group at the same time (allP<0.05). Conclusion The high expression of MMP-9 may play a significant role in the development and progression of diabetic nephropathy, possibly through the activation of AP-1 and TET1.
diabetic nephropathy; matrix metalloproteinase 9; activation factor protein 1; TET1 protein
國家自然科學基金青年科學基金資助項目(81400818);深圳市衛生計生系統科研項目(201402128)。
陳立波(E-mail: Chenlibo_1979@126.com)
10.3969/j.issn.1002-266X.2016.36.008
R587.1
A
1002-266X(2016)36-0028-04
2016-01-02)

