原發性肝細胞癌組織中NLK蛋白表達與患者臨床病理特征的關系
陳宏偉,李宗鋒,張紅娟,裴柳,劉洪偉,金亮,王東,李軍良
(秦皇島市第一醫院,河北秦皇島066000)
?
原發性肝細胞癌組織中NLK蛋白表達與患者臨床病理特征的關系
陳宏偉,李宗鋒,張紅娟,裴柳,劉洪偉,金亮,王東,李軍良
(秦皇島市第一醫院,河北秦皇島066000)
目的 觀察原發性肝細胞癌(HCC)組織中nemo樣激酶(NLK)蛋白的表達,并探討其與患者臨床病理特征的關系。方法 以自身配對法分別留取HCC患者腫瘤切除后肝癌及癌旁肝組織各136例,采用免疫組化法檢測NLK蛋白,分析NLK蛋白表達與HCC臨床病理特征的關系。結果 在HCC及癌旁肝組織NLK蛋白陽性表達率分別為96.32%、5.15%,兩者比較P<0.01;HCC組織中NLK蛋白表達與腫瘤Edmondson-Steiner分級(P=0.002)、腫瘤直徑(P=0.022)、結節數目(P<0.001)有關,但與患者其他臨床病理參數不相關(P均﹥0.05)。結論 在HCC組織中NLK蛋白表達明顯升高,NLK可能在HCC的發生發展過程中起重要作用。
原發性肝細胞癌;絲氨酸/蘇氨酸蛋白激酶超家族;nemo樣激酶
Nemo樣激酶(NLK)屬于絲氨酸/蘇氨酸蛋白激酶超家族成員,是細胞周期蛋白依賴性激酶和絲裂原活化蛋白激酶/胞外信號調節激酶同源性成員之一[1]。盡管NLK蛋白在原發性肝細胞癌(HCC)組織中的表達情況已有所研究[2],但有關NLK蛋白與HCC患者臨床病理特征的關系,尚未見相關文獻報道。本研究觀察了HCC及配對癌旁肝組織中NLK蛋白的表達水平,并分析其與患者臨床病理特征的關系。
1 資料與方法
1.1 臨床資料 收集2008年4月~2010年8月秦皇島市第一醫院收治的136例HCC患者,術前均未行放化療,術中留取肝癌及癌旁肝組織,術后均經病理科2位以上的資深醫師確診。其中,男108例,女28例;年齡31~76歲,中位年齡45.0歲;腫瘤直徑>5 cm 36例,腫瘤直徑≤5 cm 100例;多發腫瘤結節60例,單發腫瘤結節76例;Edmondson-SteinerⅠ級39例,Ⅱ級63例,Ⅲ、Ⅳ級34例;HBsAg陰性29例,HBsAg陽性107例;無肝硬化76例,合并肝硬化60例;116例無轉移,20例有轉移(包括門靜脈癌栓、淋巴結轉移及遠處轉移)。本研究由醫院倫理委員會審核批準,并征得患者及家屬知情同意。
1.2 NLK蛋白檢測方法 將肝癌及癌旁肝組織標本用石蠟包埋,4 μm連續切片。免疫組化染色采用SP法,試劑盒購于北京中杉金橋公司,嚴格按照試劑盒說明書操作。NLK蛋白陽性定位于細胞質和細胞核,以出現棕黃或棕褐色顆粒作為陽性反應。陽性細胞百分數>75%、>50%~75%、>25%~50%、≤25%分別計4、3、2、1分,染色程度強染色、中等強度染色、弱染色、無染色分別計4、3、2、1分。兩項得分相乘>4為陽性表達,≥9為高表達,≤8為低表達[3]。
1.3 統計學方法 采用SPSS18.0統計軟件。計數資料以率表示,比較采用χ2檢驗、Fisher確切概率法。P<0.05為差異有統計學意義。
2 結果
2.1 HCC癌組織及癌旁肝組織中NLK蛋白表達比較 NLK在HCC癌組織及癌旁肝組織陽性表達率分別為96.32%(131/136)、5.15%(7/136),兩者比較差異有統計學意義(χ2=226.167,P<0.01)。
2.2 NLK蛋白表達與HCC患者臨床病理特征的關系 NLK蛋白表達與HCC患者Edmondson-Steiner分級(P=0.002)、腫瘤直徑(P=0.022)和腫瘤結節數目(P<0.001)有關,而與其他的臨床病理因素無關。見表1。
3 討論
NLK是一種進化上保守的促分裂原活化蛋白激酶類似的激酶,也是經典的Wnt/β-catenin信號通路中的一個非常重要的調節因子[4]。最近研究表明,NLK表達失調在多種人類惡性腫瘤的發生、發展和預后評估方面都有重要作用,有望成為腫瘤基因治療的新靶點。NLK在多條通路中起著不同的調控作用,在人類腫瘤發生發展過程中也扮演著不同的角色。在一些人類腫瘤中,NLK發揮抑癌基因作用。一項關于神經膠質瘤的研究[5]顯示,低級別的星形細胞瘤(Ⅱ級)中NLK表達明顯高于間變性星形細胞瘤(Ⅲ級)和多形性膠質母細胞瘤(Ⅳ級),低表達NLK患者預后較差;Cox多因素分析顯示,NLK可作為神經膠質瘤患者獨立的預后指標。同時發現,神經膠質瘤細胞株U87MG、U251、LN229和T98G過表達NLK后Caspase-3表達水平也升高,表明NLK通過活化Caspase-3而誘導神經膠質瘤細胞凋亡。Lv等[4]研究發現,與正常肺組織相比,NLK在非小細胞肺癌組織中的表達明顯降低,且與非小細胞肺癌的病理組織學分級、臨床分期、淋巴結轉移與否、Ki-67表達明顯相關;并且,證實NLK可通過抑制Wnt信號通路下游靶基因c-myc、Cyclin D1而參與非小細胞肺癌的調控。Huang等[6]研究發現,NLK在乳腺癌組織中的表達低于正常乳腺組織,且與c-myb、Ki-67的表達呈負相關。在MCF-7乳腺癌細胞株中,NLK可能與c-myb直接結合并使其降解,引起其靶基因c-myc和Bcl-2的表達下調,從而阻滯細胞周期的進程,誘導乳腺癌細胞凋亡。Han等[7]證實,NLK在結腸癌組織中的表達明顯低于相應癌旁組織,NLK低表達與結直腸患者淋巴結轉移、靜脈侵襲、肝轉移、TNM分期明顯相關,且NLK低表達者預后較差。Yasuda等[8]研究證實,過表達NLK能夠誘導結腸癌DLD-1細胞凋亡,抑制細胞增殖。Zhang等[1]研究表明,NLK表達在卵巢癌組織中低于正常卵巢組織,且隨著卵巢癌病理組織學分級增加,NLK表達也逐漸降低;而且,NLK表達與卵巢癌細胞的增殖呈負相關,能夠增加化療藥順鉑誘導的卵巢癌細胞的凋亡。Emami等[9]研究表明,與正常的前列腺上皮和原發性前列腺癌相比,前列腺癌轉移灶中NLK的核定位表達程度明顯減弱;而且,過表達NLK能夠抑制前列腺癌細胞增殖,誘導其凋亡,尤其對雄激素受體陽性的前列腺癌細胞作用更加明顯。
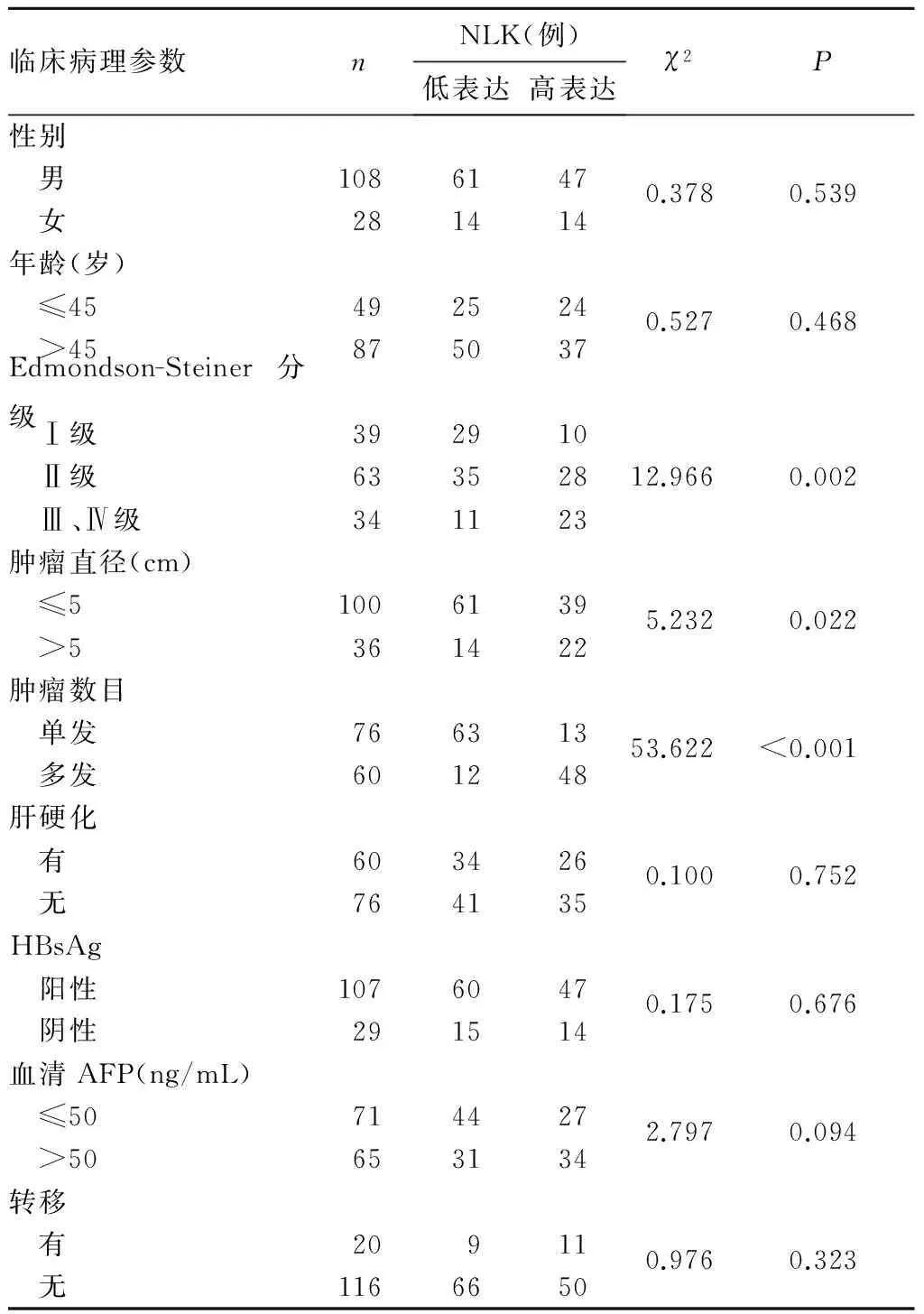
表1 NLK蛋白表達與HCC患者臨床病理 參數的關系
另一方面,NLK在一些腫瘤中發揮癌基因作用。Chen等[10]研究證實,NLK陽性的鼻咽癌患者無瘤生存率和總體生存率更低,而復發率更高。Zhang等[11]發現,在口腔鱗癌CAL-27細胞中,敲低內源性NLK表達能夠明顯抑制CAL-27細胞的增殖及集落形成能力,阻滯細胞周期從G0/G1期到S期的轉變。Li等[12]研究表明,NLK在膽囊癌組織中的表達高于正常膽囊組織,且NLK過表達與膽囊癌的組織學分級、TNM分期、神經周圍侵襲與否密切相關。而且,高表達NLK的膽囊癌患者預后更差。Tan等[13]也證實,在膽囊癌細胞中沉默NLK基因可以抑制其增殖、腫瘤形成和遷移能力。本研究表明,NLK蛋白在HCC癌組織中的表達明顯高于癌旁肝組織,且與HCC腫瘤直徑、Edmondson-Steiner分級以及腫瘤結節數有關。可能與NLK高表達能上調Cyclin D1和CDK2轉錄水平,從而促進腫瘤細胞增殖有關[2]。因此,NLK蛋白可能在HCC的發生發展過程中扮演著重要角色,有望成為HCC治療的新靶點。
[1] Zhang Y, Peng C, Wu G, et al. Expression of NLK and its potential effect in ovarian cancer chemotherapy[J]. Int J Gynecol Cancer, 2011,21 (8):1380-1387.
[2] Jung KH, Kim JK, Noh JH, et al. Targeted disruption of Nemo-like kinase inhibits tumor cell growth by simultaneous suppression of cyclin D1 and CDK2 in human hepatocellular carcinoma[J]. J Cell Biochem, 2010,110 (3):687-696.
[3] Kaur R, Yuan X, Lu ML, et al. Increased PAK6 expression in prostate cancer and identification of PAK6 associated proteins[J]. Prostate, 2008,68 (14):1510-1516.
[4] Lv L, Wan C, Chen B, et al. Nemo-like kinase (NLK) inhibits the progression of NSCLC via negatively modulating WNT signaling pathway[J]. J Cell Biochem, 2014,115 (1): 81-92.
[5] Cui G, Li Z, Shao B, et al. Clinical and biological significance of nemo-like kinase expression in glioma[J]. J Clin Neurosci, 2011,18 (2):271-275.
[6] Huang Y, Jiang Y, Lu W, et al. Nemo-like kinase associated with proliferation and apoptosis by c-Myb degradation in breast cancer[J]. PLoS One, 2013,8 (7):e69148.
[7] Han Y, Kuang Y, Xue X, et al. NLK, a novel target of miR-199a-3p, functions as a tumor suppressor in colorectal cancer[J]. Biomed Pharmacother, 2014,68 (5):497-505.
[8] Yasuda J, Tsuchiya A, Yamada T, et al. Nemo-like kinase induces apoptosis in DLD-1 human colon cancer cells[J]. Biochem Biophys Res Commun, 2003,308 (2):227-233.
[9] Emami KH, Brown LG, Pitts TE, et al. Nemo-like kinase induces apoptosis and inhibits androgen receptor signaling in prostate cancer cells[J]. Prostate, 2009,69 (14):1481-1492.
[10] Chen S, Ma Z, Chen X, et al. Prognostic significance of nemo-like kinase in nasopharyngeal carcinoma[J]. Mol Med Rep, 2014,10 (1):131-136.
[11] Zhang B, Li KY, Chen HY, et al. Lentivirus-based RNA silencing of Nemo-like kinase (NLK) inhibits the CAL-27 human adenosquamos carcinoma cells proliferation and blocks G0/G1phase to S phase[J]. Int J Med Sci, 2013,10 (10):1301-1306.
[12] Li M, Zhang S, Wang Z, et al. Prognostic significance of nemo-like kinase (NLK) expression in patients with gallbladder cancer[J]. Tumour Biol, 2013,34(6):3995-4000.
[13] Tan Z, Li M, Wu W, et al. NLK is a key regulator of proliferation and migration in gallbladder carcinoma cells[J]. Mol Cell Biochem, 2012,369(1-2):27-33.
河北省秦皇島市科學技術研究與發展計劃項目(201502A158)。
10.3969/j.issn.1002-266X.2016.38.032
R735.7
B
1002-266X(2016)38-0088-03
2016-05-10)

