多酚對豬肉肌原纖維蛋白氧化和凝膠特性的影響
張慧蕓,吳靜娟,郭新宇
(河南科技大學食品與生物工程學院,河南 洛陽 471023)
多酚對豬肉肌原纖維蛋白氧化和凝膠特性的影響
張慧蕓,吳靜娟,郭新宇
(河南科技大學食品與生物工程學院,河南 洛陽 471023)
采用羥自由基氧化體系研究添加不同質量分數多酚化合物——鞣酸(tannic acid,TA)、沒食子酸(gallic acid,GA)對豬肉肌原纖維蛋白氧化和凝膠特性的影響。結果表明:與對照組相比,添加0.05% TA和0.25% GA可顯著抑制肌原纖維蛋白中羰基和二聚酪氨酸含量的增加(P<0.05),提高肌原纖維蛋白的最大熱變性溫度和凝膠保水性(P<0.05)。掃描電子顯微鏡觀察表明,不同酚類化合物對肌原纖維蛋白凝膠微觀結構影響有顯著差異,添加0.05%氧化TA后形成的肌原纖維蛋白凝膠結構更加致密。結論:多酚的添加抑制了肌原纖維蛋白氧化,改善了肌原纖維蛋白的熱穩定性、凝膠保水性和凝膠強度。
多酚;肌原纖維蛋白;蛋白氧化;結構;凝膠性
豬肉是我國產量最大、消費最普遍的肉類。由于肉中富含較高濃度的不飽和脂肪酸、亞鐵血紅素、金屬催化劑等其他促氧因子,使其在加工與貯藏過程中極易氧化變質[1]。肌原纖維蛋白作為蛋白質的主要成分對肉蛋白功能的凝膠性起著主要作用,這類蛋白在熱誘導作用下能夠形成三維網狀結構,賦予肉制品較好的感官、質構、保水及保油性[2]。研究表明,肉制品中的蛋白氧化可能是其品質劣化的重要原因[3];蛋白氧化會降低肉的嫩度、風味、保水及保油性[4],使肉的質地變差,縮短產品的貨架期[5]。因此,控制豬肉制品蛋白氧化,提高肉糜的凝膠強度是目前開發高品質豬肉所需解決的首要問題。
多酚既可抑制微生物生長,同時亦是一種天然抗氧化劑,主要存在于植物的硬組織中,如谷物顆粒的外殼、水果的細胞壁、咖啡豆、茶葉以及根莖類[6]。多酚雖然是植物組織中一種廣泛分布的次要成分,但在提高蛋白質的交聯方面有著很好的效果[7]。研究發現,多酚通過向活潑自由基提供氫,阻斷其鏈式反應,進而延緩了油脂中不飽和脂肪酸的自動氧化[8]。Balange等[9]研究表明,向大眼鯛魚糜中分別添加0.05%鞣酸、0.15%咖啡酸、0.2%月桂酸、0.05%兒茶酸可提高其凝膠特性。Murcia等[10]研究表明,植物酚類物質的抗氧化能力與其所含酚羥基數目成正比。Estévez等[11]研究發現植物酚類物質的抗氧化活性存在復雜的化學機制,一些植物酚類化合物隨著體系中Fe3+和高鐵肌紅蛋白含量的變化,其活性由抗氧化轉變為促氧化。Maqsood等[12]研究發現,經鞣酸處理并使用高氧氣調包裝可以保持肉的紅色并減少脂肪氧化和微生物生長。然而有關蛋白質氧化的研究目前主要集中在臨床醫藥方面,在肉品領域相對較少。雖然國外已將多酚化合物用來提高蛋白質的交聯,但是關于多酚化合物對豬肉肌原纖維蛋白結構和凝膠特性影響的研究卻鮮有報道。本研究采用羥自由基氧化體系,通過測定羰基和二聚酪氨酸含量、蛋白質熱穩定性及凝膠保水性,觀察凝膠微觀結構變化,研究多酚對豬肉肌原纖維蛋白氧化與凝膠特性的影響,以期為多酚在肉類生產加工過程中的實際應用提供理論依據。
1 材料與方法
1.1 材料與試劑
冷鮮豬后腿肉 洛陽市丹尼斯超市;丁羥基茴香醚(butylated hydroxyanisole,BHA)、鞣酸、沒食子酸 合肥博美生物有限公司;牛血清白蛋白(bovine serum albumin,BSA) 上海生工生物工程股份有限公司;乙二醇-雙-(2-氨基乙醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)鄭州久是生物技術有限責任公司;2,4-二硝基苯肼 河南普金生物技術有限公司;其他試劑均為分析純,購于洛陽奧龍化玻有限公司。
1.2 儀器與設備
UV754N紫外-可見分光光度計、AL-104型精密電子天平 上海佑科儀器儀表有限公司;JSM-5610LV掃描電子顯微鏡 日本JEOL公司;PHS-3C pH計上海精密科學儀器有限公司;Cary Eclipse熒光分光光度計美國Aglient公司;XW-80A微型旋渦混合儀 上海瀘西分析儀器廠有限公司;DHG-9140A型鼓風干燥箱 上海一恒科學儀器有限公司;H1850R高速冷凍離心機 湖南湘儀實驗室儀器開發有限公司;DZKW-S-4型電熱恒溫水浴鍋 北京市永光明醫療儀器有限公司;差示掃描量熱儀(differential scanning calorimetry,DSC) 瑞士Mettler-Toledo公司。
1.3 方法
1.3.1 豬肉肌原纖維蛋白的提取
肌原纖維蛋白提取參照Wu Mangang等[13]所述方法:取冷鮮豬后腿肉,去除脂肪和結締組織,切成小塊后,加入pH 7.0的4 倍提取緩沖液(10 mmol/L K2HPO4、0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EGTA)勻漿1 min后,用冷凍離心機8 000 r/min離心15 min,棄上清液取沉淀,重復以上步驟2 次;然后將粗提的肌原纖維蛋白沉淀加入4 倍體積的0.1 mol/L NaCl溶液,勻漿機勻漿1 min后,用冷凍離心機8 000 r/min離心15 min,此操作重復1 遍;將得到的沉淀加入8 倍體積的0.1 mol/L NaCl溶液,勻漿機勻漿1 min后,4 層紗布過濾,用0.1 mol/L HCl將濾液的 pH值調到6.0,濾液用冷凍離心機8 000 r/min離心15 min,所得蛋白膏為提純的肌原纖維蛋白,將蛋白膏貯存在密閉的玻璃瓶中并保持在冰上,在48 h內使用。
蛋白質質量濃度采用雙縮脲法測定,以BSA作為標準蛋白。
1.3.2 羥自由基氧化體系
實驗采用的羥自由基氧化體系(hydroxyl radicalgenerating system,HRGS)主要由FeCl3、抗壞血酸和H2O2組成,該體系可以產生活性氧自由基(reactive oxygen species,ROS)。本實驗主要采用固定體系:使H2O2的濃度為20 mmol/L,抗壞血酸為0.1 mmol/L;FeCl3為0.l mmol/L[3,5]。
1.3.3 多酚對肌原纖維蛋白氧化的影響
將不同的酚類化合物以不同質量分數分別加入到肌原纖維蛋白中混勻(多酚的添加量以蛋白質含量為基準),實驗分為7組,第1組為空白對照(不加多酚),第2~6組中分別加入質量分數0.05%、0.10%、0.15%、0.20%、0.25%的多酚。第7組中加入質量分數0.02%的BHA作為陽性對照。將已加入多酚的肌原纖維蛋白溶解在50 mmol/L pH 6.0含有羥自由基氧化體系的磷酸鹽緩沖液中,使得蛋白質的質量濃度為40 mg/mL。然后將所有樣品在旋渦混合儀上振蕩混勻1 min,4℃條件下放置1 h,使樣品發生不同程度的氧化。加入1 mmol/L的BHATrolox-EDTA終止反應。氧化產物用冷凍離心機8 000 r/min離心處理10 min,得到的沉淀用于測定下列指標。
1.3.3.1 羰基含量的測定
參照Oliver等[14]所述的方法:將1 mL質量濃度為2 mg/mL的肌原纖維蛋白溶液與1 mL 10 mmol/L的2,4-二硝基苯肼溶液加入離心管中,室溫下反應1 h,空白樣品中不含2,4-二硝基苯肼。然后加入1 mL 20%的三氯乙酸,用冷凍離心機8 000 r/min離心10 min,將得到的蛋白沉淀用1 mL的乙酸乙酯-乙醇(1∶1,V/V)洗滌3次后,加入3 mL 6 mol/L的鹽酸胍溶液,置于37 ℃條件下水浴保溫30 min,再將所有樣品用冷凍離心機8 000 r/min離心6 min除去不溶物質。以空白為對照,于370 nm波長處測定上清液吸光度。羰基含量(nmol/mg pro)使用摩爾吸光系數(22 000 L/(mol·cm))計算。
1.3.3.2 二聚酪氨酸含量的測定
參照Pacifici等[15]的方法略做修改。精確稱取肌原纖維蛋白樣品10 mg溶解于10 mL pH 6.0的20 mmol/L磷酸鹽緩沖液中(含0.6 mol/L的KCl),過濾除去不溶性物質,采用雙縮脲法測定蛋白質量濃度。利用熒光分光光度計測定二聚酪氨酸的含量,激發波長325 nm,發射波長420 nm,狹縫寬度10 nm。利用所測定的吸光度除以蛋白質量濃度得到最終的二聚酪氨酸含量,用相對熒光值表示,單位為AU。
1.3.3.3 蛋白熱穩定性的測定
采用DSC分析蛋白質結構穩定性的變化。準確稱取肌原纖維蛋白樣品(12~15 mg)放入涂有聚合物的鋁盤中,封好蓋子,取一個空盤作對照,調整好DSC儀器后,將樣品放入儀器的樣品支持器上。對于熱掃描的樣品,實驗采用的加熱速率為10 ℃/min,測定溫度范圍為30~90 ℃。采用STARe軟件進行數據處理和分析得到DSC曲線,焓值的變化可能與蛋白質的變性有關,通過曲線與基線之間的面積確定;峰值點溫度為蛋白質的變性溫度[16]。每個樣品重復3 次,取平均值。
1.3.4 多酚對肌原纖維蛋白凝膠特性的影響
1.3.4.1 氧化酚溶液的制備
將鞣酸、沒食子酸用蒸餾水溶解,參考Strauss等[17]的方法,用6 mol/L HCl或NaOH調節多酚溶液至pH 8.0。將制備好的多酚溶液放到40 ℃水浴鍋中,通入氧氣,持續起泡1 h,使多酚類化合物被氧化成醌,再將溶液的pH值用6 mol/L HCl調至7.0。
1.3.4.2 凝膠的制備
將質量濃度不同的氧化酚溶液分別加入到氧化后的肌原纖維蛋白中,使肌原纖維蛋白的最終質量濃度為30 mg/mL。攪拌均勻后取15 mL放入直徑30 mm、高度50 mm的密閉玻璃瓶中,將所有的樣品放在80 ℃水浴中加熱30 min,形成凝膠后,立即取出,冰浴冷卻30 min,將玻璃瓶中多余的水分用濾紙吸干后,蓋上蓋子,把制備好的凝膠于4 ℃的冰箱中過夜備用。
1.3.4.3 凝膠保水性的測定
參考Xia Xiufang等[18]的方法,精確稱取5 g制備好的凝膠樣品,置于50 mL離心管底部,用冷凍離心機4 ℃、6 000 r/min離心10 min后,將離心管中多余的水分用濾紙吸干,用電子天平稱量離心前后凝膠的質量。每個樣品重復3 次取平均值。公式如下:
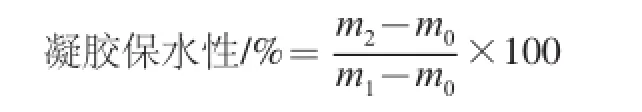
式中:m0是離心管質量/g;m1是離心前離心管和凝膠蛋白質量/g;m2是離心后離心管和凝膠蛋白質量/g。
1.3.4.4 凝膠微觀結構的觀察
參考P a l k a等[19]的方法,將凝膠樣品切成約3 mm×3 mm×5 mm的小條,用體積分數2.5%的戊二醛固定,置于4 ℃冰箱中過夜,再用pH 6.8的0.1 mol/L磷酸緩沖液洗滌3 次,然后分別用體積分數為50%、70%、80%、90%、100%的乙醇梯度脫水;之后用氯仿脫脂1 h;再分別用乙醇-叔丁醇(1∶1,V/V)和叔丁醇各置換1 次;用液氮干燥后,粘樣,鍍膜后用于掃描電子顯微鏡微觀結構觀察。
1.4 數據分析
本實驗除電子顯微鏡實驗外,均為3 次獨立的重復實驗。數據分析使用DPS程序,使用繪圖軟件Origin 8.5進行處理。
2 結果與分析
2.1 多酚對肌原纖維蛋白中羰基含量的影響
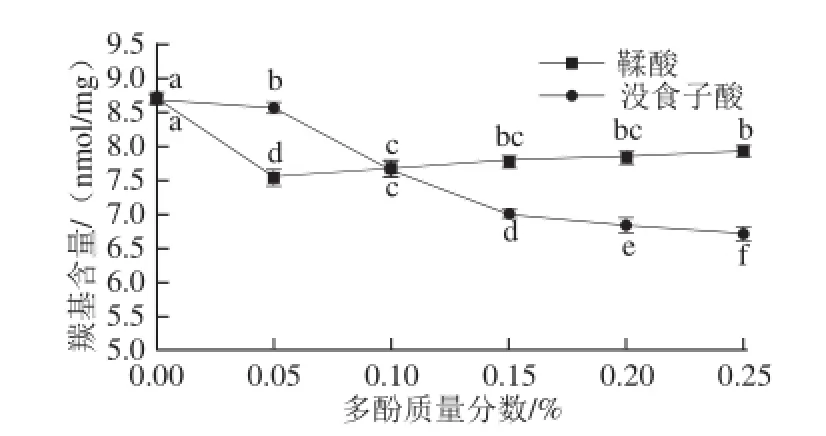
圖1 多酚對肌原纖維蛋白羰基含量的影響Fig. 1 Effect of polyphenols at various concentrations on the carbonyl content of MP after oxidation
蛋白質發生羰基化可作為蛋白質氧化的一個重要指標,羰基主要由活性氧所致肽鏈的斷裂及活性氧攻擊氨基酸分子的氨基或亞氨基產生[20]。Dean等[21]研究表明,羰基含量越高蛋白質氧化損傷程度越高。由圖1可知,與對照組相比,添加多酚降低了樣品中的羰基含量(P<0.05)。對照組的羰基含量為8.68 nmol/mg。添加鞣酸質量分數為0.05%時,羰基含量最低為7.39 nmol/mg,與對照組相比差異顯著(P<0.05),這是因為鞣酸中羥基含量較高,羥基可被轉化為具有交聯作用的醌[22]。隨著鞣酸質量分數的增加,羰基含量反而逐漸升高,這可能與鞣酸的自我聚集有關,當積累到一定程度時,將破壞與蛋白質的交聯能力,抵消鞣酸原有的抗氧化活性。Balange等[23]報道當鞣酸的質量分數為0.05%時,具有較高的蛋白交聯能力(P<0.05)。與對照組相比,隨著沒食子酸質量分數的增加肌原纖維蛋白中羰基含量逐漸降低,當添加量為0.25%時肌原纖維蛋白中羰基含量最低(P<0.05),這是因為沒食子酸中羥基含量較少、溶解度較低,與肌原纖維蛋白反應比較困難,但當濃度增加時,羥基含量也會增加,從而提高了與蛋白質相互反應的程度[24]。豬肉肌原纖維蛋白中添加0.02%的BHA(陽性對照)時羰基含量為7.29 nmol/mg,顯著低于對照組(P<0.05)且與添加0.05%鞣酸的抗氧化效果相當,但低于添加0.25%沒食子酸的抗氧化活性。
2.2 多酚對肌原纖維蛋白中二聚酪氨酸含量的影響
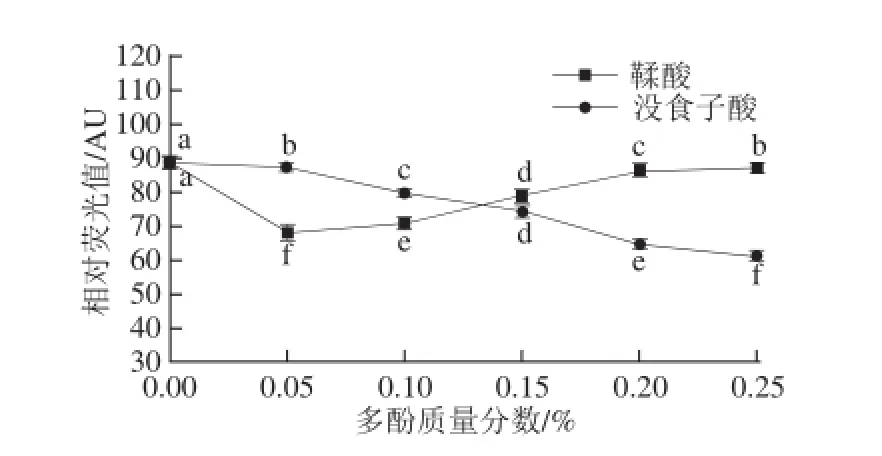
圖2 多酚對肌原纖維蛋白二聚酪氨酸含量的影響Fig. 2 Effect of polyphenols at various concentrations on the bityrosine content of MP after oxidation
如圖2所示,與對照相比,當鞣酸質量分數為0.05%時,二聚酪氨酸含量最低,隨著質量分數的增加,二聚酪氨酸含量又逐漸升高;這可能與鞣酸的自我聚集有關,在油脂中使用時會因溶解性較差而影響其功能的發揮。隨著沒食子酸添加量的增加,二聚酪氨酸含量逐漸降低,當質量分數為0.25%時二聚酪氨酸含量最低(P<0.05)。對照組二聚酪氨酸含量較高,表明氧化蛋白質的聚集也與其他共價鍵或非共價鍵生成有關[25]。Kristensen等[26]研究發現,肌球蛋白氧化后二聚酪氨酸含量增加。Morzel等[27]也證實骨骼肌肌纖維蛋白氧化后二聚酪氨酸的含量增加。添加0.02% BHA(陽性對照組的肌原纖維蛋白二聚酪氨酸含量為61.33 AU,顯著低于對照組(P<0.05),且與添加0.05%鞣酸、0.25%沒食子酸差異不顯著(P>0.05)。這說明豬肉肌原纖維蛋白中添加一定濃度的多酚化合物能抑制二聚酪氨酸含量的增加。
2.3 多酚對肌原纖維蛋白熱穩定性的影響
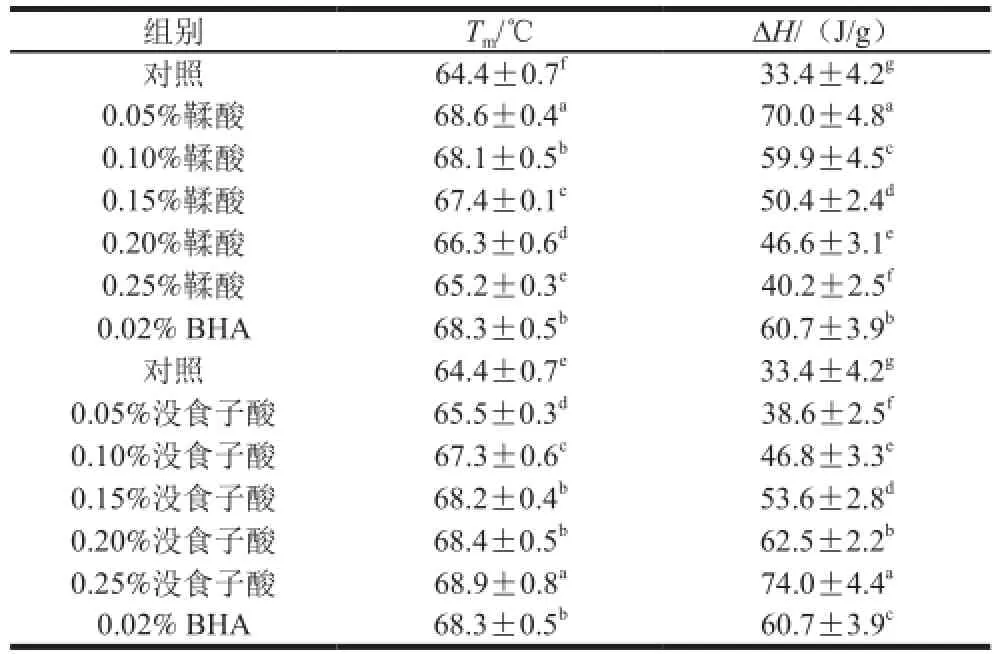
表1 不同多酚添加量對肌原纖維蛋白氧化后最大變性溫度(Tm)和焓值(ΔH)的影響Table 1 Effect of polyphenols at various concentrations on the maximum transition temperature (Tm) and ehthalph (ΔH) of MP
如表1所示,添加多酚的處理組樣品最大熱變性溫度和熱焓值均高于對照組(P<0.05)。當鞣酸和沒食子酸的質量分數為0.05%和0.25%時能最大程度改變蛋白質熱變性溫度和焓值。研究表明豬肉肌原纖維蛋白變性程度越大,熱穩定性越差,焓值降低越多[28]。而添加一定量的多酚后豬肉肌原纖維蛋白變性溫度和吸熱量都發生了不同程度的提高,說明多酚化合物可與蛋白質以離子鍵或氫鍵的形式結合,從而起到抗氧化作用,在整體上提高了蛋白的熱穩定性。李艷青等[16]報道向魚糜肌原纖維蛋白中添加抗氧化劑可以提高蛋白質的熱穩定性。
2.4 多酚對肌原纖維蛋白凝膠保水性的影響
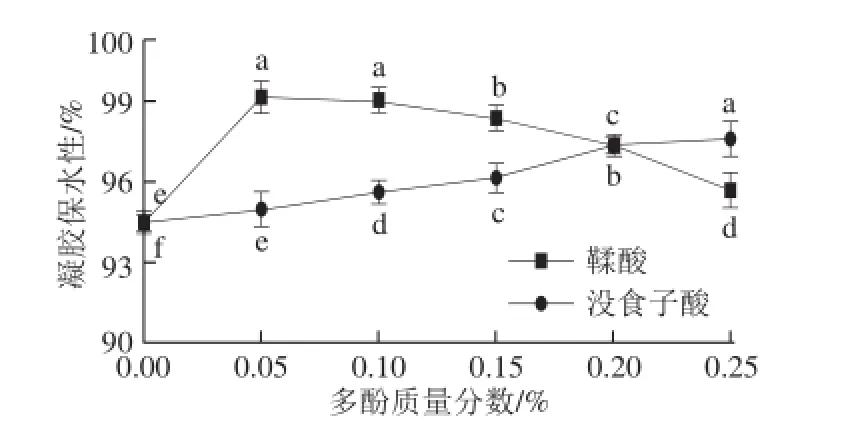
圖3 多酚對肌原纖維蛋白凝膠保水性的影響Fig. 3 Effect of polyphenols at various concentrations on the WHC of MP gel
如圖3所示,與對照相比,隨著沒食子酸質量分數的增加,樣品肌原纖維蛋白凝膠保水性逐漸升高,差異顯著(P<0.05)。隨著鞣酸質量分數的增加,樣品肌原纖維蛋白凝膠保水性先升高后降低,鞣酸的質量分數為0.05%時,樣品肌原纖維蛋白凝膠保水性最大,與對照相比差異顯著(P<0.05)。這表明添加適量氧化酚類化合物能夠增強蛋白質的交聯能力,導致形成更強的網絡具有更大的持水能力。這可能是由于多酚羥基與蛋白質二硫鍵、非二硫鍵之間產生相互作用,形成更穩定的結構[29]。添加0.02% BHA(陽性對照)的肌原纖維蛋白凝膠保水性為95.46%,與添加0.25%沒食子酸的效果相當,但低于添加0.05%鞣酸的凝膠保水性(P>0.05)。Balange等[23]報道向魚肌原纖維蛋白中添加0.05%鞣酸能顯著提高魚糜的凝膠保水性。
2.5 多酚對肌原纖維蛋白凝膠微觀結構的影響
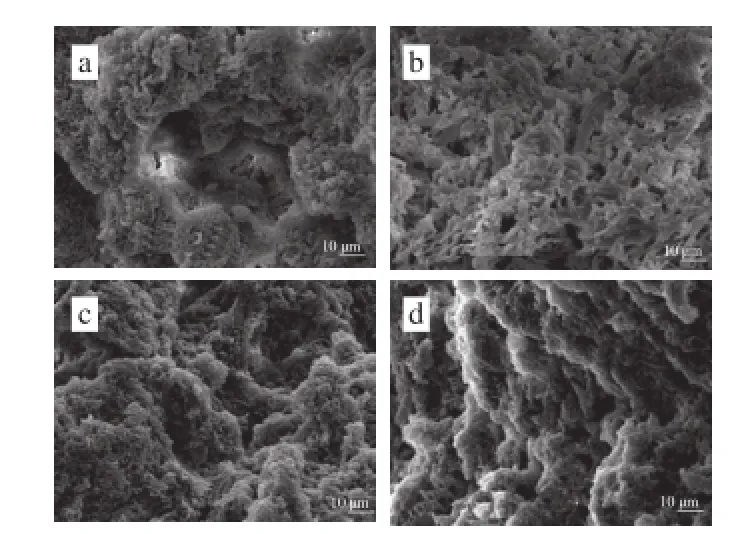
圖4 多酚對肌原纖維蛋白凝膠微觀結構的影響Fig. 4 Effect of polyphenols on the microstructure of MP gel
圖4a中(沒有添加氧化酚類化合物)形成的凝膠網狀結構粗糙,質地疏松、不緊密,有一些不規則的空洞,還有蛋白質的聚集;而添加氧化酚類化合物和BHA組的肌原纖維蛋白形成的凝膠(圖4b~d)結構致密、空隙較小、形狀規則且分布均勻。這說明氧化酚類化合物對最終凝膠的微觀結構有很大的影響,不同氧化酚類化合物對肌原纖維蛋白凝膠微觀結構影響差異顯著,其中添加0.05%鞣酸后(圖4b)形成的凝膠網狀結構更加致密、分布均勻,這可能是因為鞣酸有較多的結合位點與蛋白質發生交聯,在基質中形成較大膠束,提高凝膠彈性[30]。三維網狀結構的形成使得凝膠中能夠容納的水分更多,這與凝膠的保水性增強一致(圖3)。與Balange等[9]向魚糜中添加氧化酚類化合物使魚糜凝膠特性增強所得的研究結果相似。
3 結 論
添加一定質量分數的多酚化合物可有效抑制豬肉肌原纖維蛋白氧化,對肌原纖維蛋白凝膠特性具有顯著影響。與對照相比,添加0.05%鞣酸和0.25%沒食子酸,可顯著抑制肌原纖維蛋白羰基和二聚酪氨酸含量的增加;提高肌原纖維蛋白的熱穩定性、凝膠保水性,效果與0.02% BHA相當。對肌原纖維蛋白凝膠微觀結構研究表明,添加多酚可減少蛋白質聚合,使凝膠微觀結構更加致密、光滑、分布均勻。可見,多酚對羥自由基引起的肌原纖維蛋白氧化起到了一定的抑制作用。因此,可通過向肉及肉制品中添加多酚化合物防止蛋白質氧化,同時提高蛋白質的功能特性。
[1] 黃莉, 孔保華, 李菁, 等. 氧化引起肉及肉制品品質劣變的機理及影響因素[J]. 食品科學, 2011, 32(9): 319-320.
[2] LIU G, XIONG Youling L., BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey-and soyprotein isolates[J]. Journal of Food Science, 2000, 65(5): 811-818. DOI:10.1111/j.1365-2621.2000.tb13592.x.
[3] PARK D, XIONG Youling L.. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2): 607-616. DOI:10.1016/ j.foodchem.2006.09.004.
[4] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radicalgenerating system[J]. Journal of Agricultural and Food Chemistry, 1997, 45(2): 310-320. DOI:10.1021/jf960367g.
[5] 李銀, 李俠, 張春輝, 等. 羥自由基導致肉類肌原纖維蛋白氧化和凝膠性降低[J]. 農業工程學報, 2013, 29(12): 286-292. DOI:10.3969/ j.issn.1002-6819.2013.12.036.
[6] 王鈺, 王錫昌, 劉源. 植物多酚在肉制品加工中的應用[J]. 肉類研究, 2013, 27(2): 37-40.
[7] RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chemistry, 2002, 78(4): 443-455. DOI:10.1016/S0308-8146(02)00155-3.
[8] 陳洪生, 孔保華, 刁靜靜, 等. 氧化引起的肌肉蛋白質功能性變化及其控制技術的研究進展[J]. 食品科學, 2015, 36(11): 215-219. DOI:10.7506/spkx1002-6630-201511041.
[9] BALANGE A K, BENJAKUL S. Effect of oxidised phenolic compounds on the gel property of mackerel (Rastrelliger kanagurta) surimi[J]. LWT-Food Science and Technology, 2009, 42(6): 1059-1064. DOI:10.1016/j.lwt.2009.01.013.
[10] MURCIA M A, MARTíNEZ-TOMé M. Antioxidant activity of resveratrol compared with common food additives[J]. Journal of Food Protection, 2001, 64(3): 379-384.
[11] ESTéVEZ M, HEINONEN M. Effect of phenolic compounds on the formation of α-aminoadipic and γ-glutamic semialdehydes from myofibrillar proteins oxidized by copper, iron, and myoglobin[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4448-4455. DOI:10.1021/jf903757h.
[12] MAQSOOD S, BENJAKUL S. Preventive effect of tannic acid in combination with modified atmospheric packaging on the quality losses of the refrigerated ground beef[J]. Food Control, 2010, 21(9): 1282-1290. DOI:10.1016/j.foodcont.2010.02.018.
[13] WU Mangang, XIONG Youling L., CHEN Jie. Rheology and microstructure of myofibrillar protein-plant lipid composite gels: effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324. DOI:10.1016/ j.jfoodeng.2011.05.022.
[14] OLIVER C N, AHN B W, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. The Journal of Biological Chemistry, 1987, 262(12): 5488-5491.
[15] PACIFICI R E. Protein damage and degradation by oxygen radicals[D]. Los Angeles: University of Southern California, 1991: 9895-9901.
[16] 李艷青. 蛋白質氧化對鯉魚蛋白結構和功能性的影響及其控制技術[D]. 哈爾濱: 東北農業大學, 2013: 24. DOI:10.7666/d.Y2295487.
[17] STRAUSS G, GIBSON S M. Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J]. Food Hydrocolloids, 2004, 18(1): 81-89. DOI:10.1016/ S0268-005X(03)00045-6.
[18] XIA Xiufang, KONG Baohua, XIONG Youling L., et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science, 2010, 85(3): 481-486. DOI:10.1016/j.meatsci.2010.02.019.
[19] PALKA K, DAUN H. Changes in texture, cooking losses, and myofibrillar structure of boving M. semitendinosus during heating[J]. Meat Science, 1999, 51(3): 237-243. DOI:10.1016/S0309-1740(98)00119-3.
[20] STADTMAN E R. Protein oxidation and aging[J]. Science, 1992, 257: 1220-1224. DOI:10.1126/science.1355616.
[21] DEAN R T, FU S L, STOCKER R, et al. Biochemistry and pathology of radical-mediated protein oxidation[J]. Biochemical Journal, 1997, 324: 1-18. DOI:10.1042/bj3240001.
[22] ZHANG Xiaoqing, DO M D, CASEY P, et al. Chemical cross-linking gelatin with natural phenolic compounds as studied by high-resolution NMR spectroscopy[J]. Biomacromolecules, 2010, 11: 1125-1132. DOI:10.1021/bm1001284.
[23] BALANGE A, BENJAKUL S. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2009, 113(1): 61-70. DOI:10.1016/ j.foodchem.2008.07.039.
[24] de FREITAS V, MATEUS N. Structural features of procyanidin interactions with salivary proteins[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 940-945. DOI:10.1021/jf000981z.
[25] SRINIVASAN S, XIONG Youling L., BLANCHARD S P. Effects of freezing and thawing methods and storage time on thermal properties of freshwater prawns (Macrobrachium rosenbergii)[J]. Journal of the Science of Food and Agriculture, 1997, 75: 37-44. DOI:10.1002/ (SICI)1097-0010(199709)75:1<37::AID-JSFA838>3.0.CO;2-L.
[26] KRISTENSEN L, M?LLER A J, ANDERSEN H J. Degradation myosin by cathepsin B. comparison of native and oxidatively modified protein[C]//Proceedings of 43rd International Congress of Meat Science and Technology, 1997: 412-413.
[27] MORZEL M, GATELLIER P, SAYD T, et a1. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar protein[J]. Meat Science, 2006, 73: 536-543. DOI:10.1016/ j.meatsci.2006.02.005.
[28] PARK D, XIONG Youling L., ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2006, 101: 1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[29] RATTAYA S, BENJAKUL S, PRODPRAN T. Properties of fish skin gelatin film incorporated with seaweed extract[J]. Journal of Food Engineering, 2009, 95(1): 151-157. DOI:10.1016/ j.jfoodeng.2009.04.022.
[30] 呂宏宇, 許曉曦. 氧化酚類化合物對鯉魚魚糜凝膠特性影響的研究[J]. 食品工業科技, 2011, 32(5): 149-150. DOI:10.13386/ j.issn1002-0306.2011.05.107.
Effect of Polyphenols on the Oxidation and Gel Properties of Pork Myofibrillar Protein
ZHANG Huiyun, WU Jingjuan, GUO Xinyu
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
The objective of this study was to investigate the effects of different concentrations of polyphenol compounds including tannic acid (TA) and gallic acid (GA) on the oxidation and gel properties of pork myofibrillar protein (MP) in hydroxyl radical oxidation system. Results indicated that treatments with 0.05% TA and 0.25% GA could significantly inhibit the increase of carbonyl and bityrosine content (P < 0.05), increase the maximum transition temperature (Tm) and waterholding capacity (WHC) of MP, and their effect was equivalent to that of the 0.02% BHA treatment group. Scanning electron microscopy results revealed that different phenolic compounds had different influence on MP gel microstructure. MP gel structure became more compact after adding 0.05% TA. In conclusion, polyphenols can inhibit MP oxidation and improve thermal stability, WHC and gel strength of MP.
polyphenol; myofibrillar proteins; protein oxidation; structure; gelation
10.7506/spkx1002-6630-201621008
TS251.51
A
1002-6630(2016)21-0043-05
張慧蕓, 吳靜娟, 郭新宇. 多酚對豬肉肌原纖維蛋白氧化和凝膠特性的影響[J]. 食品科學, 2016, 37(21): 43-47.
DOI:10.7506/spkx1002-6630-201621008. http://www.spkx.net.cn
ZHANG Huiyun, WU Jingjuan, GUO Xinyu. Effect of polyphenols on the oxidation and gel properties of pork myofibrillar protein[J]. Food Science, 2016, 37(21): 43-47. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621008. http://www.spkx.net.cn
2016-01-03
國家自然科學基金-河南人才培養聯合基金項目(C2003)
張慧蕓(1977—),女,副教授,博士,主要從事天然產物活性研究。E-mail:zhanghuiyun21@163.com

