固相萃取-表面增強拉曼光譜法測定奶粉中三聚氰胺
陳小曼,雷皓宇,胡玉玲,李攻科
(中山大學 化學與化學工程學院,廣東 廣州 510275)
?
固相萃取-表面增強拉曼光譜法測定奶粉中三聚氰胺
陳小曼,雷皓宇,胡玉玲,李攻科*
(中山大學 化學與化學工程學院,廣東 廣州 510275)
建立了固相萃取-表面增強拉曼光譜法(SPE-SERS)測定奶粉中三聚氰胺的分析方法。待測物經乙腈提取、活性碳吸附及氫氧化鈉溶液洗脫后進行SERS檢測。該方法的線性范圍為0.005 0~1.6 mg/L,檢出限為0.100 mg/kg,回收率為75.3%~125%,相對標準偏差(RSD,n=5) 不大于9.3%。該法靈敏度高、雜質干擾小、結果準確可靠,能滿足奶粉中三聚氰胺的快速檢測,在奶粉質量監控方面具有良好的應用潛力。
表面增強拉曼光譜法;固相萃取;奶粉;三聚氰胺
三聚氰胺俗稱密胺、蛋白精,含氮量為67%,摻入乳制品中能造成蛋白質含量達標的假象。2008年三鹿奶粉事件中,三聚氰胺造成多名嬰幼兒患腎、輸尿管結石病甚至腎衰竭死亡。隨后政府規定嬰兒配方食品中三聚氰胺的限量值為1 mg/kg,其它食品中三聚氰胺的限量值為2.5 mg/kg,但依然無法杜絕三聚氰胺違法添加行為。目前,三聚氰胺的檢測方法主要有高效液相色譜法(HPLC)[1-2]、液相色譜-質譜聯用法(LC-MS)[3-4]、氣相色譜-質譜聯用法(GS-MS)[5]、比色法[6]、酶聯免疫法[7]。其中,HPLC和GC-MS是國家標準方法,但存在操作復雜、分析耗時等問題,不利于現場快速檢測。因此,建立一種快速有效的三聚氰胺分析方法對規范乳制品市場具有重要意義。
表面增強拉曼光譜(Surface-enhanced Raman spectroscopy,SERS)是一種新型的光譜分析技術,有快速、高效、簡單及無損分析等特點,可用于現場實時檢測,已在生物檢測[8-9]、食品檢驗[10-12]、環境監測[13-15]等領域廣泛應用。Yang等[16]建立了奶粉中三聚氰胺分析的SERS法,但該法檢出限為1.2 mg/kg,定量下限大于4 mg/kg,高于國家標準對嬰兒配方食品中三聚氰胺的限量值。Sun等[17]使用固相萃取-表面增強拉曼光譜聯用技術測定農用環境水體中的水胺硫磷殘留,獲得了良好的結果。本文結合固相萃取和表面增強拉曼光譜法,使用乙腈提取三聚氰胺并通過活性碳吸附,氫氧化鈉溶液洗脫,降低了雜質對三聚氰胺檢測的影響,適用于各類奶粉中三聚氰胺含量的分析。
1 實驗部分
1.1 儀器與試劑
Delta Nu Inspector便攜式拉曼光譜儀(美國Delta Nu);KQ-300DE型數控超聲波清洗器(昆山市超聲儀器有限公司);MIULAB微型離心機(杭州米歐儀器有限公司)。
三聚氰胺(分析純,上海阿拉丁生化科技股份有限公司);SERS增強試劑CP-1(廈門市普識納米科技有限公司);氯化鈉、氫氧化鈉、乙腈、鹽酸、硝酸、硫酸(分析純,廣州化學試劑廠);活性碳粉(分析純,天津市福晨化學試劑廠);硅膠(分析純,煙臺黃務硅膠開發試驗廠);硅藻土(分析純,天津市凱通化學試劑有限公司);十八烷基硅烷鍵合硅膠(上海博勢生物科技有限公司);標準奶粉購自廣州市質量技術監督局;其他奶粉樣品購自廣州市海珠區某商場。
三聚氰胺標準溶液的配制:用超純水配制濃度為500 mg/L 的三聚氰胺標準儲備液,并用0.1 mol/L氫氧化鈉溶液將儲備液逐級稀釋得到0.005 0,0.025,0.10,0.40,0.80,1.2,1.6 mg/L 的系列濃度標準溶液。
1.2 儀器分析條件
拉曼光譜儀器條件:測試模式為Soft Ware,積分時間為15 s,測定次數為5,每次測試扣除暗電流1 s,激光功率為High,結果為Average,分辨率為Low。
1.3 樣品前處理
取0.1 g奶粉樣品,加入10 mL乙腈,300 W下超聲提取5 min,9 000 r/min下離心5 min;上清液轉移至含有0.05 g活性碳粉末的離心管中,超聲、離心各1 min;移除上清液并在沉淀中加入10 mL 0.1 mol/L氫氧化鈉溶液,超聲提取、離心各1 min,靜置待測。移取300 μL SERS增強試劑CP-1于拉曼管中,加入50 μL待測液和7.5 μL 2 mol/L氯化鈉溶液,混勻后進行SERS檢測。
2 結果與討論
2.1 樣品前處理條件的優化
2.1.1 提取條件優化 本實驗優化了奶粉中三聚氰胺提取的超聲時間和離心時間。在300 W超聲功率下,超聲時間分別設置為1,3,5 min。結果顯示,超聲5 min對應的峰信號最強。在9 000 r/min離心條件下,離心時間分別設置為1,3,5 min。結果表明,離心5 min對應的峰信號最強。繼續延長超聲時間至7 min和10 min,峰信號的強度基本不變,所以提取階段超聲時間和離心時間設置為5 min。
2.1.2 吸附條件優化 分別考察了活性碳、硅膠、硅藻土、十八烷基硅烷鍵合硅膠作為吸附劑對奶粉中三聚氰胺吸附效果的影響。結果表明,僅活性碳能吸附三聚氰胺,且吸附效果良好。Shen等[18]研究發現活性碳對三聚氰胺的吸附大致符合BET模型,吸附三聚氰胺速率的變化符合擬二級動力學模型。實驗探究了活性碳用量分別為0.01,0.02,0.05 g時對三聚氰胺檢測信號的影響,結果表明,當活性碳用量為0.05 g時,三聚氰胺的檢測信號最強。進一步對吸附階段的超聲時間和離心時間進行優化,結果表明,當超聲時間和離心時間均為1 min時,效果最好。
2.1.3 洗脫條件優化 分別考察了0.1 mol/L 鹽酸、硝酸、硫酸及氫氧化鈉溶液作為洗脫液時對三聚氰胺洗脫效果的影響。結果表明,當洗脫液為0.1 mol/L氫氧化鈉時,洗脫效果最好。可能是因為氫氧化鈉對活性碳具有腐蝕作用,在洗脫過程中將碳表面細孔體積擴大[19],使三聚氰胺得以脫離并進入洗脫液中。本實驗進一步優化了超聲時間和離心時間,得到的最優時間均為1 min。
2.1.4 團聚劑用量的優化 同時使用氫氧化鈉與氯化鈉溶液,可大幅提高三聚氰胺的檢測信號,并降低檢出限[16]。以0.1 mol/L氫氧化鈉溶液為洗脫液時,采用2 mol/L氯化鈉溶液作團聚劑,考察了團聚劑用量分別為5,7.5,10,12.5,15,20 μL時對檢測信號的影響。實驗結果表明,團聚劑用量為7.5 μL時峰信號最強。

圖1 三聚氰胺標準溶液的SERS圖譜Fig.1 SERS spectra of melamine standard solution melamine concentration(a-h): 0,0.005,0.025,0.10,0.40,0.80,1.2,1.6 mg/L
2.2 奶粉中三聚氰胺的分析
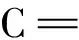
配制濃度分別為 0.005 0,0.025,0.10,0.40,0.80,1.2,1.6 mg/L的系列三聚氰胺標準溶液,在優化條件下以1 432 cm-1處特征峰峰面積(Y)對應標準溶液濃度(X,mg/L)繪制標準曲線。結果如圖1所示,三聚氰胺在0.005 0~1.6 mg/L濃度范圍內具有良好的線性關系,線性方程為Y=5.774×104X+1.487×104,r2=0.997 9。以空白奶粉加標0.250 mg/kg的拉曼響應為基礎,檢出限(LOD)為3倍信噪比對應的濃度,則LOD為0.100 mg/kg。
2.2.2 干擾物的測定 考察了奶粉中雜質對0.05 mg/L三聚氰胺分析的干擾。以1 432 cm-1峰強度變化為評價標準,若加入干擾物后峰強無明顯變化,則視為不干擾檢測。由于奶粉中大多數糖類、蛋白質、有機酸及離子不溶于乙腈,主要考察了維生素C及維生素B1對檢測的影響。結果表明,當維生素C和維生素B1濃度為三聚氰胺濃度的2 000倍時,1 432 cm-1處的峰面積無明顯變化,表明奶粉中該類物質不干擾三聚氰胺的測定。

圖2 奶粉中三聚氰胺檢測的拉曼圖譜Fig.2 SERS spectra of melamine detection in milk powder
2.2.3 實際樣品分析 選取三聚氰胺標準奶粉進行SERS分析,三聚氰胺檢測值為17.5 mg/kg,相對標準偏差(RSD)為5.2%,三聚氰胺分析的拉曼圖譜如圖2所示。HPLC法測定的標準值為16.2 mg/kg,RSD為0.2%,SERS法測定值與HPLC法測定值的比值為1.05,比對結果符合度良好。為了驗證該分析方法在不同奶粉中的可行性,從商場中隨機抽取4種類型(嬰兒、學生、女士、中老年)奶粉進行SERS分析,均未發現陽性樣品。以空白實際樣品添加三聚氰胺進行回收率實驗(見表1),三聚氰胺的回收率為75.3%~125%,RSD(n=5)為1.3%~9.3%,數據結果表明該方法準確可靠。

表1 奶粉中三聚氰胺回收率的測定
3 結 論
本文建立了奶粉中三聚氰胺分析的固相萃取-表面增強拉曼光譜法,對標準奶粉進行了SERS分析,同時使用國家標準HPLC方法進行比對。結果表明,SERS方法定性判定與HPLC方法判定結果一致,且SERS測試結果達到HPLC方法的1.05,不存在顯著差異。該法在奶粉樣品中雜質去除效果良好,降低了雜質對三聚氰胺分析的干擾。相對于國家標準的HPLC及GC-MS方法,該法可大幅減少實驗時間、簡化實驗過程、降低實驗成本,具備現場快速檢測能力,具有良好的應用前景。
[1] Figueiredo L,Santos L,Alves A.Adv.Polym.Technol.,2015,34(4): 21506-21513.
[2] Zhu L,Xu G H,Wei F D,Yang J,Hu Q.J.ColloidInterf.Sci.,2015,454: 8-13.
[3] He D,Zhang X,Gao B,Wang L,Zhao Q,Chen H,Wang H,Zhao C.FoodControl,2014,36: 36-41.
[4] Abernethy G,Higgs K.J.Chromatogr.A,2013,1288: 10-20.
[5] Lutter P,Savoy-Perroud M,Campos-Gumenez E,Meyer L,Goldmann T,Bertholet M,Mottier P,Dermarchelier A,Monard F,Perrin C,Robert F,Delatour T.FoodControl,2011,22: 903-913.
[6] Cao X Y,Shen F,Zhang M W,Guo J J,Luo Y L,Li X,Liu H,Sun C Y,Liu J B.FoodControl,2013,34(1): 221-229.
[7] Cao B Y,Yang H,Song J,Chang H F,Li S Q,Deng A P.Talanta,2013,116: 173-180.
[8] Vangala K,Yanney M,Hsiao C T,Wu W W,Shen R F,Zou S,Sygula A,Zhang D M.Anal.Chem.,2010,82(24): 10164-10171.
[9] Feng S Y,Chen R,Lin J Q,Pan J J,Wu Y N,Li Y Z,Chen J S,Zeng H S.Biosens.Bioelectron.,2011,26(7): 3167-3174.
[10] Betz J F,Cheng Y,Rubloff G W.Analyst,2012,137(4): 826-828.
[11] Zhang K G,Hu Y L,Li G K.Talanta,2013,116: 712-718.
[12] Chen Y,Zhang K G,Hu Y L,Li G K.J.Instrum.Anal.(陳漾,張凱歌,胡玉玲,李攻科.分析測試學報),2014,33(4): 432-436.
[13] Ye Y J,Liu H L,Yang L B,Liu J H.Nanoscale,2012,4(20): 6442-6448.
[14] Sun B,Jiang X X,Wang H Y,Song B,Zhu Y,Wang H,Su Y Y,He Y.Anal.Chem.,2015,87(2): 1250-1256.
[15] Fateixa S,Soares S F,Daniel-Da-Silva A L,Nogueira H I S,Trindade T.Analyst,2015,140(5): 1693-1701.
[16] Yang Q Q,Liang F H,Wang D,Ma P Y,Gao D J,Han J Y,Li Y L,Yu A M,Song D Q,Wang X H.Anal.Methods,2014,6(20): 8388-8395.
[17] Sun H D,Xie F,Chen B B,Ma N,Zhong X.Environ.Chem.(孫海達,謝鋒,陳蓓蓓,馬寧,仲雪.環境化學),2014,33(4): 689-690.
[18] Shen K Y,Xu B,Xia S J,Li W,Gao N Y,Qin C.Water &WastewaterEngineering(沈開源,徐斌,夏圣驥,李偉,高乃云,覃操.給水排水 ),2011,37: 55-60.
[19] Ding C S,Ni F M,Zeng H M,Zou Y L,Zhu Q F.Carbon(丁春生,倪芳明,曾海明,鄒應龍,諸錢芬.炭素),2010,144(4): 8-12.
[20] Hong C,Liu B H,Guan G J,Zhang Z P,Han M Y.Analyst,2010,135(5): 1070-1075.
[21] Liu J W,Zhang B Y,Li S F,Wang L M.J.LightScattering(劉景旺,張博洋,李樹峰,王立明.光散射學報),2010,22(3): 291-297.
Determination of Melamine in Milk Powder by Solid-phase Extraction Coupled with Surface-enhanced Raman Spectroscopy
CHEN Xiao-man,LEI Hao-yu,HU Yu-ling,LI Gong-ke*
(School of Chemistry and Chemical Engineering,Sun Yat-sen University,Guangzhou 510275,China )
A new analytical method was developed for the determination of melamine in milk powder by solid-phase extraction coupled with surface-enhanced Raman spectroscopy.The melamine in sample was extracted with acetonitrile,then adsorbed with activated carbon and eluted with sodium hydroxide solution.The results showed that the linear range for melamine was in the range of 0.005 0-1.6 mg/L,with a limit of detection of 0.100 mg/kg.While the method was applied in the analysis of melamine in milk powder,the recoveries for melamine were in the range of 75.3%-125%,and the relative standard deviations(n=5) were not more than 9.3%.With a remarkable effect in removing impurities,this method is accurate,reliable and sensitive in the rapid determination of melamine in milk powder,showing a great potential in monitoring the quality of milk powder.
surface-enhanced Raman spectroscopy;solid-phase extraction;milk powder;melamine
2016-05-01;
2016-05-11
國家重大科學儀器設備開發專項(2011YQ03012409);國家自然科學基金(21575168,21277176,21475153);廣東省自然科學基金(015A030311020);廣東省公益研究與能力建設專項(2015A030401036);廣州市科技計劃項目(201604020165)
10.3969/j.issn.1004-4957.2016.10.022
O657.3;TS252.51
A
1004-4957(2016)10-1343-04
*通訊作者:李攻科,教授,研究方向:色譜、光譜分析、樣品前處理技術及裝置研制,Tel: 020-84110922,E-mail: cesgkl@mail.sysu.edu.cn

