家養野豬源EMCV VP1基因的原核表達及其間接ELISA方法的建立和應用
劉慧敏,常洪濤,賀秀媛,陳 陸,楊 霞,王新衛,李永濤,趙 軍,王川慶
?
家養野豬源EMCV VP1基因的原核表達及其間接ELISA方法的建立和應用
劉慧敏1,常洪濤2,賀秀媛2,陳 陸2,楊 霞2,王新衛2,李永濤2,趙 軍2,王川慶2
目的 以原核表達的腦心肌炎病毒(EMCV)VP1蛋白作為檢測抗原,建立間接ELISA方法用來檢測EMCV抗體。方法 應用原核表達載體pET-28a構建家養野豬源EMCV VP1基因的重組表達質粒,并在感受態細胞BL21中表達,將該重組蛋白純化后作為包被抗原,建立間接ELISA標準化檢測程序,并應用于臨床檢測。結果 經雙酶切、PCR和測序鑒定,重組質粒pET-28a-VP1構建成功,轉化后誘導表達,經SDS-PAGE電泳分析得到高效表達的VP1蛋白,該重組蛋白可被EMCV陽性血清特異性識別,具有良好的反應原性;通過優化反應條件,確定抗原濃度為1.25 ug/mL、待檢血清以1∶80倍稀釋為最佳抗原包被濃度和待檢血清最佳稀釋度,5%脫脂乳作為封閉液,待檢血清的最佳作用時間為37 ℃作用60 min,酶標抗體稀釋度的最佳工作濃度和最佳作用時間分別為1∶8 000和37 ℃ 30 min,底物最佳顯色時間為20 min,特異性強,敏感性較高,重復性良好;應用該間接ELISA方法分別檢測河南省126個豬場送檢的1 618份血清和527份PCV-2抗體陽性血清,發現陽性場檢出率為65.87%,血清總陽性率為45.30%,不同規模和不同階段豬群均存在EMCV感染,中小型豬場的陽性率顯著高于規模化豬場,EMCV與豬圓環病毒2型的混合感染率高達75.14%。結論 應用原核表達的重組VP1蛋白作為包被抗原建立的間接ELISA方法可用于檢測EMCV抗體水平,臨床檢測結果填補了河南省EMCV血清流行病學監測的空白。
腦心肌炎病毒;VP1蛋白;原核表達;間接ELISA;臨床檢測
腦心肌炎(Encephalomyocarditis,EMC)是由腦心肌炎病毒(Encephalomyocarditis virus,EMCV)引起的一種以腦炎、心肌炎和繁殖障礙為主要臨診特征的人畜共患傳染病[1]。EMCV為單股正鏈RNA病毒[2],全長約7.8 kb,結構蛋白VP1處于病毒粒子最表面,是最重要的中和性抗原表位所在區域,受選擇性壓力的影響,需要不斷發生變異以維持病毒存活,并與病毒粒子表面的拓撲結構、受體吸附及脫殼有關[3]。盡管當前國內并未發生嚴重疫情,但已證實多個省市豬場中存在感染,只是抗體陽性率差異較大[4-7]。隨著近年來國際交往日益頻繁,加之國內地理環境復雜,生物多樣性豐富,從而為EMCV的發生、傳播和流行提供了有利條件,受其威脅的危險性日趨嚴重。及時了解本地豬群中EMCV的感染狀況,對于有效防制該病和保障人類健康具有重大意義,而建立一種快速、準確、特異和敏感的抗體檢測方法尤為關鍵。本試驗旨在對所分離的家養野豬源EMCV JZ1202株的VP1基因進行原核表達和鑒定,并以該重組蛋白作為包被抗原,建立可用于檢測血清中EMCV抗體的間接ELISA方法,為該病的診斷、免疫檢測和流行病學調查提供技術手段,也為ELISA 抗體診斷試劑盒的研制奠定技術基礎。
1 材料與方法
1.1 病毒、感受態細胞和表達質粒 家養野豬源EMCV JZ1202株、大腸桿菌DH5α、感受態細胞BL21和原核表達載體pET-28a均由本實驗室提供。
1.2 血清 豬抗EMCV陽性血清、EMCV陰性血清以及豬其他重要病毒性疾病如豬瘟(CSF)、豬繁殖與呼吸綜合征(PRRS)、豬偽狂犬病(PR)、豬細小病毒病(PPI)和豬圓環病毒病(PCVD)的陽性血清均由本實驗室制備。1 618份待檢血清由2013年11月至2015年3月間河南省126個豬場送檢。另有未免疫PCV-2疫苗的豬場送檢的527份血清,經檢測為PCV-2抗體陽性。
1.3 主要試劑 Ni-Agarose His標簽蛋白純化試劑盒(包涵體蛋白)、Ni-Agarose His標簽蛋白純化試劑盒(可溶性蛋白)、羊抗鼠酶標二抗(HRP標記)和DAB顯色試劑盒為北京康為世紀生物科技有限公司產品;蛋白分子量標準(14.4~97.4 kDa)和PVDF膜均購自寶生物工程(大連)有限公司;其他常規試劑和分子生物學試劑均由本實驗室提供。
1.4 VP1基因的原核表達
1.4.1 pET-28a-VP1原核表達載體構建
1.4.1.1 引物設計 利用Primer Premier 5.0軟件,參考EMCV BJC3 株全基因序列(GenBank登錄號:DQ464062),設計可覆蓋完整VP1基因的一對特異性引物,并在上、下游引物分別引入BamH I和EcoR I酶切位點,預期擴增片段為831 bp,引物由上海生工生物工程股份有限公司合成:
EMCV-VP1-F:5′-GAC GGA TCC GGG GTA GAA AAC GCT GAA AG-3′
EMCV-VP1-R:5′-GCC GAA TTC CTC TAG CAT CAA GAC TCC AG-3′
1.4.1.2 目的基因擴增 取JZ1202株的細胞培養液,應用Trizol LS Reagent提取總RNA,反轉錄成相應片段的cDNA后進行RT-PCR,反應條件為:95 ℃ 5 min;95 ℃ 50 s, 57 ℃ 45 s, 72 ℃ 1 min,共 35 個循環;72 ℃ 10 min。反應結束后取10 μL PCR產物進行電泳、回收和純化。
1.4.1.3 重組表達質粒制備 將純化的VP1目的片段與原核表達載體pET-28a進行BamH I、EcoR I雙酶切、膠回收和連接。隨后轉化DH5a感受態細胞,37 ℃過夜培養,篩選陽性菌落增菌培養,提取質粒進行雙酶切鑒定和PCR鑒定。將鑒定正確的重組質粒送往北京六合華大基因科技股份有限公司測序,確定是否存在堿基的缺失、插入或突變,讀碼框是否移碼等,將鑒定正確的陽性重組質粒命名為pET-28a-VP1。
1.4.2 重組質粒誘導表達 將pET-28a-VP1轉化感受態細胞BL21,均勻涂布于LB平板(Amp+),培養12 h,挑取陽性重組菌的白色單菌落,再接種于LB液體培養基(Amp+)中,37 ℃ 200 rpm/min振蕩培養過夜,按1∶100比例接種LB液體培養基(Amp+),37 ℃振蕩培養2 h,至對數生長中期(OD600nm=0.5~1.0),加入IPTG至終濃度1 mmol/L進行誘導,分別取樣0、4、6 h時的樣品1 mL,參照《分子克隆實驗指南》第三版中SDS-PAGE試驗方法[8],稍加修改進行檢測。
1.4.3 重組蛋白的純化 將IPTG誘導6 h的菌體置于冰浴條件下超聲裂解,至菌體較清亮為止,4 ℃ 12 000 rpm/min離心25 min,取沉淀進行SDS-PAGE分析。同時將該沉淀按照Ni-Agarose His標簽蛋白純化試劑盒進行純化,并進行SDS-PAGE分析。
1.4.4 重組蛋白的Western blotting檢測 將純化蛋白作SDS-PAGE,采用濕轉法將其轉移至PVDF膜,200 mA恒流,1.5 h~2 h;用含5%脫脂奶粉的TBS封閉轉印后的PVDF膜,室溫1~2 h;倒掉封閉液,加入PBS清洗PVDF膜3~5次,每次10 min;加入1∶2 000稀釋的EMCV陽性血清(一抗)37 ℃震蕩孵育1~2 h;棄一抗,TBST沖洗PVDF膜3~5次,每次10 min;加入1∶4 000稀釋的HRP標記的羊抗鼠酶標二抗,37 ℃震蕩孵育1~2 h后,將PVDF膜取出用TBST充分清洗3~5次至潔凈;避光滴加DAB顯色液于PVDF膜,至出現清晰的特異性條帶,拍照。
1.5 間接ELISA方法最佳反應條件優化 應用矩陣法將倍比稀釋的VP1重組蛋白包被后,加入不同稀釋度的待檢血清進行ELISA,篩選P/N值最大的抗原濃度和血清稀釋度為最佳抗原包被濃度和血清最佳稀釋度;分別選擇0.1% BSA、5%脫脂乳和1%明膠進行封閉,以篩選最佳封閉液;酶標板包被抗原、封閉處理后,分別置于室溫和37 ℃下反應30 min、45 min和60 min,進行ELISA以確定待檢血清最佳作用時間;將酶標抗體分別作1∶5 000、1∶8 000和1∶10 000稀釋,進行ELISA以確定最佳工作濃度,再分別置于室溫和37 ℃下反應30 min、45 min和60 min,進行ELISA以確定最佳作用時間;酶標抗體作用完成后,加入TMB顯色液,37 ℃避光條件下分別顯色10 min、20 min和30 min,進行ELISA以確定底物最佳顯色時間;將20份經中和試驗判定為EMCV抗體陰性的血清,按上述已優化的ELISA反應條件進行檢測,計算出OD450值,經統計學分析獲得平均值(X)和標準方差(SD)。根據生物統計學原理,OD450值≥(X+3SD)時判為陽性,OD450值≤(X+2SD)判為陰性,介于兩者間判為可疑。分別取CSF、PRRS、PR、PPI和PCVD的陽性血清進行間接ELISA,觀察是否存在交叉反應,以判定其特異性,同時設立EMCV標準陰性、陽性血清對照;選取15份豬血清,分別應用中和試驗和間接ELISA進行檢測,比較二者的最高檢出稀釋度和符合率,以評估其相對敏感性;分別使用同1批次和3個不同批次表達純化的VP1重組蛋白進行包被,應用間接ELISA對4份血清樣品和1份陰性血清進行3次批內重復試驗和3次批間重復試驗,計算變異系數,以評價其穩定性和準確性。
1.6 EMC血清流行病學調查 應用所建立的EMCV抗體間接ELISA方法,分別檢測河南省126個豬場送檢的1 618份血清和527份PCV-2抗體陽性血清。
2 結 果
2.1 獲得原核表達抗原
2.1.1 VP1基因RT-PCR及構建的重組表達質粒鑒定 應用RT-PCR擴增得到長為831 bp的目的片段,與預期相一致(圖1)。對重組原核表達質粒pET-28a-VP1進行PCR鑒定時可獲得831 bp的擴增條帶(圖2)。BanH I和EcoR I雙酶切時可切出約5 900 bp和831 bp的2個基因片段(圖3),與預期結果相符。測序結果表明插入的VP1 基因片段長度和序列準確。
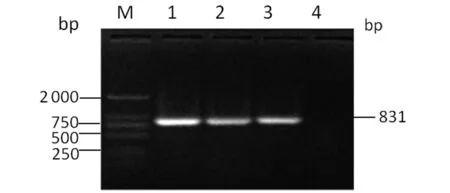
M:DL2000 DNA Marker;1:Positive control;2-3:VP1 gene;4:Negative control圖1 VP1基因的RT-PCR擴增Fig.1 RT-PCR amplication of VP1 gene
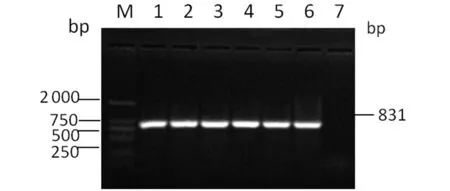
M:DL2000;1:Positive control;2-6:VP1 gene;7:Negative control圖2 重組表達質粒的PCR鑒定Fig.2 PCR identification of recombinant plasmid
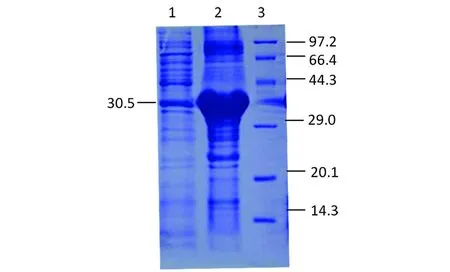
2.1.2 誘導表達和SDS-PAGE 各誘導表達產物經SDS-PAGE分析,大小與預期結果相符,表達量較大(圖4)。而且融合蛋白的表達量隨誘導時間延長而增加,于誘導后6 h達到高峰。進一步分析顯示,該重組蛋白以不溶性包涵體存在。
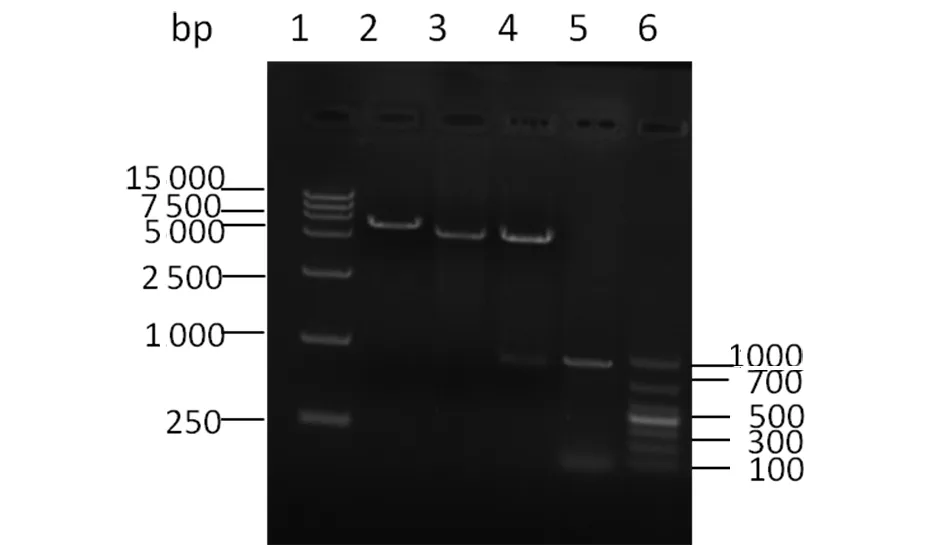
1:DL15000 DNA Marker;2:recombinant plasmid;3:Empty plasmid;4:recombinant plasmid by double restriction enzyme digestion;5:VP1 gene;6:DL1000 DNA Marker
圖3 重組表達質粒的雙酶切鑒定
Fig.3 Identification of recombinant plasmid by double restriction enzyme digestion
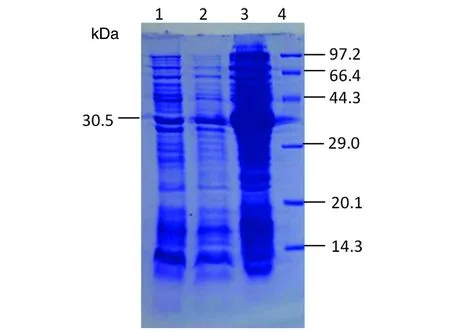
1-3: pET28a-VP1 induced with IPTG for 0, 4, 6 h;4: Protein molecular weight marker (kDa)
圖4 不同時間誘導表達VP1蛋白的SDS-PAGE鑒定
Fig.4 SDS-PAGE identification of expressed under induction with IPTG at different time
2.1.3 VP1重組蛋白得到純化 重組VPl蛋白純化后經SDS-PAGE分析,得到高純度的目的蛋白(圖5),測定濃度為5.0 mg/mL。
2.1.4 重組蛋白經Western Blotting證明為VPl抗原特異性 將純化的重組蛋白濕法轉印至PVDF膜上,在約30.5 kDa處出現一條特異性反應條帶(圖6)。表明VP1基因在大腸桿菌中被誘導表達后,獲得的重組蛋白能被EMCV陽性血清所識別,發生特異性的免疫印跡反應,說明具有良好的抗原反應原性。
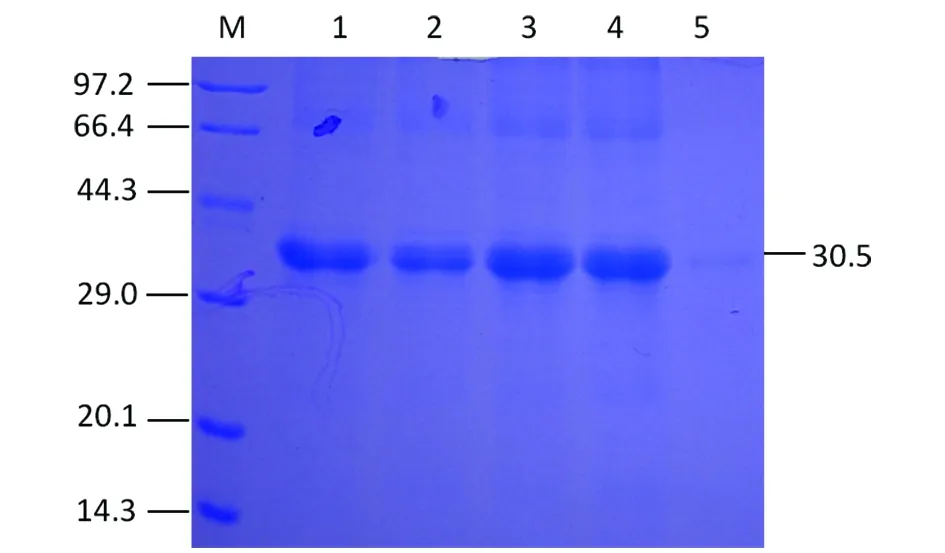
1: Unpurified soluble protein;M:Protein molecular weight Marker 2: Unpurified inclusion body protein;1-4: Collected liquid of inclusion body protein after column M: Protein molecular weight Marker;5: Elution collected liquid of inclusion body protein 圖5 重組VP1蛋白純化后的SDS-PAGE分析Fig.5 SDS-PAGE analysis of purified recombinant VP1 protein
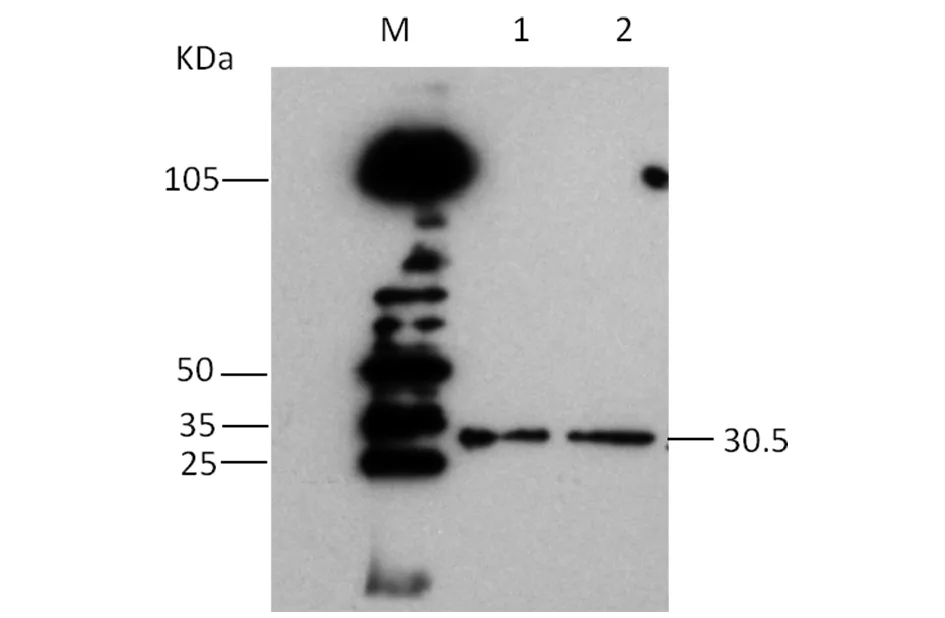
M: Protein molecular weight marker;1-2: Purified VP1 protein圖6 重組VP1蛋白Western Blotting檢測Fig.6 Identification of recomibant VP1 protein by WB
2.2 間接ELISA反應條件 當抗原濃度為1.25 ug/mL,待檢血清以1∶80倍稀釋時,P/N值最大,可確定為最佳抗原包被濃度和待檢血清最佳稀釋度;以5%脫脂乳作為封閉液時,P/N值最大,可選其作為封閉液;當待檢血清在37 ℃作用60 min時,P/N值最大,可確定為最佳作用時間;當酶標抗體稀釋度為1∶8 000,作用時間為37 ℃ 30 min時,P/N值最大,可確定為最佳工作濃度和最佳作用時間;底物顯色20 min時,P/N值最大,可確定為最佳顯色時間;20份陰性血清中,OD450值最大為0.325,最小為0.094,平均值為0.208,標準方差為0.071 2,計算臨界值為:陽性為0.208+3×0.071 2=0.42,陰性為0.208+2×0.071 2=0.35,介于兩者之間判為可疑。5種豬病毒性疾病的陽性血清反應后,OD450值均小于0.42,表明所建立的間接ELISA方法特異性良好,無交叉反應;15份豬血清經中和試驗檢測出陽性4份,經ELISA方法檢測出陽性5份,二者符合率為93%,表明所建立的間接ELISA方法敏感性較高;經計算,批內重復試驗的變異系數為7.35%,批間重復試驗的變異系數為7.18%,表明所建立的間接ELISA方法重復性良好。2.3 EMC血清流行病學 對河南省126個豬場送檢的1 618份血清進行EMCV抗體檢測(表1),其中陽性檢出場為83個(65.87%),陽性血清數為733份(45.30%)。種母豬、種公豬、后備豬和商品豬的血清總陽性率分別為38.94%、50.43%、53.57%和56.27%。規模化豬場總陽性率為41.87%,種母豬、種公豬、后備豬和商品豬的陽性率分別為35.91%、46.38%、47.13%和52.08%;中小型豬場總陽性率為50.89%,種母豬、種公豬、后備豬和商品豬的陽性率分別為43.62%、56.25%、60.49%和66.36%。調查結果顯示,河南省不同規模、不同階段豬群中均存在著嚴重的EMCV感染。527份PCV-2抗體陽性豬血清中,EMCV抗體檢測陽性率高達75.14%,提示二者混合感染極為普遍(表2)。
表1 不同規模豬群中EMCV抗體檢測
Tab.1 EMCV antibody detections in pig farms of different sizes
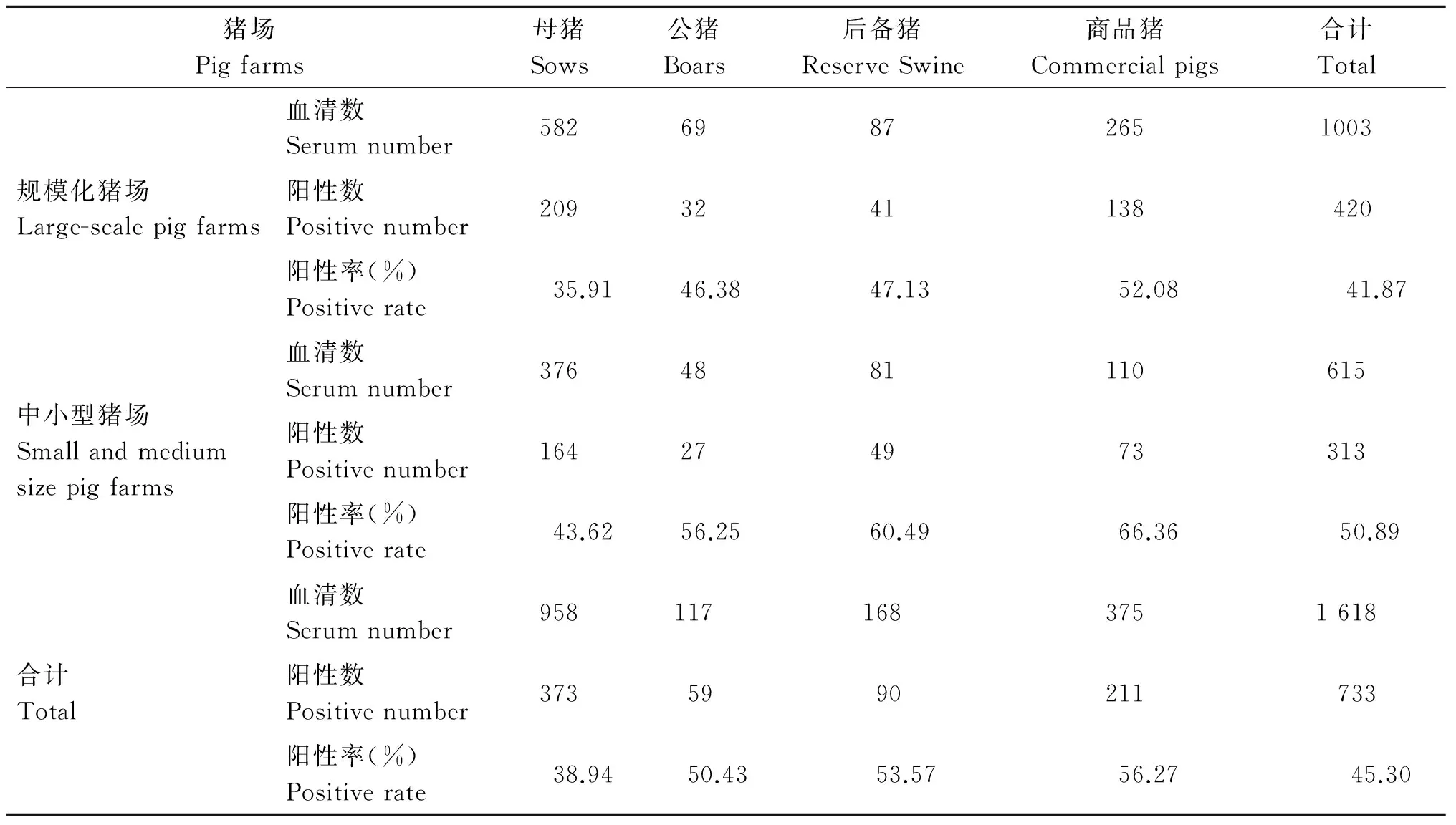
豬場Pigfarms母豬Sows公豬Boars后備豬ReserveSwine商品豬Commercialpigs合計Total規模化豬場Large-scalepigfarms血清數Serumnumber58269872651003陽性數Positivenumber2093241138420陽性率(%)Positiverate35.9146.3847.1352.0841.87中小型豬場Smallandmediumsizepigfarms血清數Serumnumber3764881110615陽性數Positivenumber164274973313陽性率(%)Positiverate43.6256.2560.4966.3650.89合計Total血清數Serumnumber9581171683751618陽性數Positivenumber3735990211733陽性率(%)Positiverate38.9450.4353.5756.2745.30
表2 PCV-2抗體陽性血清中EMCV抗體的檢測
Tab.2 EMCV antibody detection of the PCV-2 antibody positive serum

血清數Serumnumber陽性數Positivenumber陽性率(%)Positiverate(%)52739675.14
3 討 論
在EMCV結構蛋白中以VP1抗原性最強,多作為靶目標來制備診斷抗原和設計新型疫苗。大腸桿菌遺傳背景清晰,生長速度迅速,可根據試驗要求對其進行突變改造,并可穩定、高效的復制或表達轉入的外源基因,近年來已在多種動物病原研究中得到廣泛應用[9-11],但針對家養野豬源病原體的原核表達研究的報道尚不多見。本試驗首次應用原核表達載體pET-28a成功構建了家養野豬源EMCV VP1基因的重組表達質粒pET-28a-VP1,并在感受態細胞BL21中得到高效表達。經SDS-PAGE和Western Blotting鑒定,所表達的重組蛋白大小約為30.5 kDa,有良好的抗原反應原性,在IPTG 誘導6 h時,表達量最大,并主要以包涵體的形式存在,這與蓋新娜的研究相一致[7],這可能與VP1蛋白的氨基酸組成或表達速度過快,易富集于胞漿等有關。
動物感染EMCV后可產生抗體,但病毒會隨著抗體的出現而逐步減少,尤其在感染中后期或康復期,在體內幾乎檢測不到病毒,因此抗體檢測更具價值,不僅是流行病學調查的主要技術手段,也可用來輔助臨床診斷。血清中和試驗被廣泛應用于EMCV的免疫學檢測,特異性較高,但操作繁瑣。血凝抑制試驗和瓊脂擴散試驗等在EMCV早期研究中發揮了重要作用,但均不利于大批量檢測和快速診斷。ELISA方法快速、靈敏、操作相對簡單和易標準化,從而適合用于EMCV實驗室診斷和大規模普查,但目前尚無成熟的市售試劑盒。本試驗以原核表達成功的VP1重組蛋白作為包被抗原,通過優化反應條件,建立了間接ELISA標準化檢測程序,特異性強,敏感性較高,重復性良好,可用于EMCV的流行病學調查和早期診斷。
近年來,隨著對EMC公共衛生問題的日趨重視,國內多個實驗室開展了血清流行病學調查,并證實大部分省市豬群中普遍存在感染,但抗體陽性率差異較大。蓋新娜等(2005)首次證實我國13個地區規模化養豬場的平均陽性率為75.84%,隨后劉亞蘭等(2009)檢測河北省31個規模化豬場、陸文俊等(2011)檢測廣西地區豬場、樊得英等(2012)檢測甘肅省規模化豬場的抗體陽性率分別為13.48%、91.47%和62.8%。應用本試驗所建立的間接ELISA方法,對河南省126個豬場送檢的1 618份豬血清進行檢測,陽性場檢出率65.87%,血清總陽性率為45.30%,種母豬、種公豬、后備豬和商品豬的血清總陽性率分別為38.94%、50.43%、53.57%和56.27%,表明該省豬群中EMCV感染極為普遍。不同規模、不同階段豬群中均存在著嚴重的EMCV感染,中小型豬場的陽性率明顯高于規模化豬場,這應與其養殖環境惡化、鼠害泛濫、飼養者養殖理念落后以及引種混亂等有關。
[1] Shi KC, Chen HB, Qin FY, et al. Development and application of a TaqMan real-time RT-PCR assay for the detection of porcine encephalomyocarditis virus[J]. Chin Vet Sci, 2011,41(9): 928-932. (in Chinese)
施開創,陳宏備,覃芳蕓,等.豬腦心肌炎病毒TaqMan熒光定量RT-PCR檢測方法的建立及應用[J].中國獸醫科學,2011,41(9): 928-932.
[2] Chang HT, Liu HM, Chen L, et al. Isolation, identification and full length genome sequence analysis of EMCV from different animal source[J]. Chin J Vet Sci, 2014,34(9):1442-1447.(in Chinese)
常洪濤,劉慧敏,陳陸,等.不同動物源腦心肌炎病毒的分離、鑒定和全基因組序列分析[J].中國獸醫學報,2014,34(9):1442-1447.
[3] Hahn H,Palmenberg A C. Encephalomyocarditis viruses with short poly (C) tracts are more virulent than their Mengovirus counterparts[J]. J Viro L,1995, 69(4): 2697-2699.
[4] Lu WJ, Shi KC, Qu SJ, et al. Development and application of an Indirect ELISA for detection of antibody against porcine encephalomyocarditis virus [J]. Progress in Veterinary Medicine, 2011,32(12):6-10. (in Chinese)
陸文俊,施開創,屈素潔,等. 豬腦心肌炎病毒抗體間接ELISA檢測方法的建立及應用[J].動物醫學進展,2011,32(12):6-10.
[5] Fan DY, Feng RF, Li XY, et al,. Development and preliminary application of double antigen sandwich ELISA method for encephalomyocarditis virus [J].Chin J Biologicals January, 2012,25 (1): 105-107.(in Chinese)
樊得英,馮若飛,李向鶯,等.腦心肌炎病毒抗體雙抗原夾心ELISA檢測方法的建立與初步應用[J].中國生物制品學雜志,2012,25 (1):105-107.
[6] Feng RF. DS-ELISA established, serosurvey, strains isolation and RNAi for EMCV [D].Chinese Academy of Agriculture Sciences,2014. (in Chinese)
馮若飛.腦心肌炎病毒雙抗原夾心ELISA建立、血清學調查、毒株分離及RNA干擾研究[D].中國農業科學院,2014.
[7] Gai XN. Prokaryotic expression of VP1 gene of swine encephalomyocarditis virus, serological survey and identification of EMCV[D]. Chinese Agricultural University, 2005. (in Chinese)
蓋新娜.豬腦心肌炎病毒VP1基因的原核表達、血清學調查及分離毒株的鑒定[D]. 中國農業大學,2005.
[8] Sambrook J. Molecular Cloning: A Laboratory Manual Ⅲ [M]. Russell science press, 2002,1228-1232.
J.薩姆布魯克D.W.分子克隆實驗指南[M].3版,拉塞爾科學出版社,2002,1228-1232.
[9] Jiang M. Isolation of procine epidemic diarrhea virus and prokaryotic expression of M protein [D]. Sichuan Agricultural University, 2013. (in Chinese)
蔣梅.豬流行性腹瀉病毒分離鑒定及其M蛋白原核表達[D]. 四川農業大學,2013.
[10] Song N. Prokaryotic expression of VP0, VP1, VP3 protein of foot-and-mouth disease virus serotype O in swine and development of indirect ELISA [D]. Chinese Academy of Agriculture Sciences. 2013. (in Chinese)
宋妮.豬O型口蹄疫病毒VP0、VP1、VP3蛋白的原核表達及間接ELISA方法的建立[D].中國農業科學院,2013.
[11] Ren DM. The prokaryotic expression and purification of Mhp168_116、Mhp168_341、Mhp168_322 and Mhp168_549 proteins of Mycoplasma hyopneumoniae vaccine candidate antigens [D]. Southwest University. 2014. (in Chinese)
任冬梅.豬肺炎支原體168株疫苗候選抗原蛋白Mhp168_116、Mhp168_341、Mhp168_322和Mhp168_ 549的原核表達及純化[D].西南大學,2014.
s:Chang Hong-tao,Email:ndcht@163.com;Wang Chuan-qing,Email:wchuanq@163.com
Development and application of indirect ELISA for detection of antibodies against encephalomyocarditis virus based on prokaryotic expression of VP1 protein
LIU Hui-min1, CHANG Hong-tao2, HE Xiu-yuan2, CHEN Lu2, YANG Xia2,WANG Xin-wei2, LI Yong-tao2, ZHAO Jun2, WANG Chuan-qing2*
(1.CollegeofLifeScience,HenanAgricultureUniversity,Zhengzhou, 450002,China;2.CollegeofAnimalMedicineandHusbandry,HenanAgricultureUniversity,Zhengzhou450002,China)
We developed an indirect-ELISA method to detect the antibodies against encephomyocarditis virus (EMCV) using the prokaryotic expression of viral protein 1 as antigen. VP1 gene of EMCV was amplified and cloned into the prokaryotic expression vector pet-28a to obtain the recombinant expressed plasmid, and then were transformed into competent cells BL21 for expression. The recombinant protein purified was used as antigen to develop the indirect-ELISA standard detection procedure for clinical application. Results showed that the recombinant expression plasmid pet-28a-VP1 was identified by double digestion, PCR and sequence analysis. They were transformed into competent cells for expression, and VP1 protein was highly expressed by SDS-PAGE analysis. The recombinant protein was recognized specifically by positive serum of EMCV, the optimal antigen concentration was 1.25 ug/mL, the optimal reaction condition of serum samples was 60min at 37℃, the optimal dilution concentration and time of antibodies labeled with enzyme was 1∶8 000 and 30 min at 37 ℃ respectively, and the optimal color time of substrate was 20 min. The indirect-ELISA method was with high specificity and sensitivity, and good repeatability. The survey results showed that the detection rate of positive farm was 65.87% , and total serum positive rate was 45.3% in Henan Province. EMCV infection existed in different size and stages pig farms, compared with large-scale ones, small and medium-sized had higher positive rate, moreover, mixed infection rates with PCV-2 as high as 75.14%. In conclusion, the developed indirect ELISA method based on recombinant VP1 protein as coating antigen is useful for the detection of the EMCV antibody in clinical samples,which filled the surveillance gap of serum epidemiological of EMCV in Henan Province.
encephalomyocarditis virus; VP1 protein; prokaryotic expression; indirect ELISA; clinical detection
河南省高校科技創新團隊支持計劃(No.14IRTSTHN015)和國家自然科學基金委(No.31272567)資助
常洪濤,Email:ndcht@163.com
王川慶,Email:wchuanq@163.com
1.河南農業大學生命科學學院,鄭州 450002;
2.河南農業大學牧醫工程學院,鄭州 450002
10.3969/j.issn.1002-2694.2016.08.009
R373
A
1002-2694(2016)08-0728-06
2015-08-16;
2016-01-18
Henan Province University Science and Technology Innovation Team Support program (No.14IRTSTHN015) and National Natural Science Foundation of China (No.31272567)

