貴陽市結核分枝桿菌鏈霉素和乙胺丁醇耐藥相關基因突變的檢測與分析
孫 榮,歐維正,王 燕,蒙 俊,秦 萬,畢雅坤,陳崢宏
?
貴陽市結核分枝桿菌鏈霉素和乙胺丁醇耐藥相關基因突變的檢測與分析
孫 榮1,歐維正2,王 燕2,蒙 俊2,秦 萬2,畢雅坤1,陳崢宏1
目的 了解貴陽市及周邊地區結核分枝桿菌鏈霉素和乙胺丁醇耐藥相關基因rpsl、rrs和embB的突變特征。方法 對39株結核分枝桿菌臨床分離株(乙胺丁醇和鏈霉素均耐藥菌株19株,均敏感菌株20株)的rpsl、rrs和embB基因片段進行PCR擴增和測序,以H37Rv菌株序列為參考,比較耐藥菌株和敏感菌株的突變特征。結果 19株耐藥菌株中有14株檢出rpsl基因突變,突變率為73.7%(14/19),其中12株為AAG43AGG突變,1株為AAG43AAT突變,1株為AAG88AGG突變;20株敏感菌株中有1株發生rpsl基因AAG43AGG突變,突變率為5.0%;耐藥菌株和敏感菌株均未檢測出rrs基因突變。19株耐藥菌株中有16株檢出embB基因突變,突變率為84.2%(16/19),突變包括6株ATG306GTG突變,ATG306ATA、ATG306ATT和ATG306ATC突變各1株; GGC406GCC和GGC406AGC突變各3株,1株CAG497CGG突變;20株敏感菌株未檢測出突變。結論 貴陽地區結核分枝桿菌菌株鏈霉素和乙胺丁醇耐藥相關基因突變具有多樣性;優勢突變分別為rpsl43和embB306位點突變。
結核分枝桿菌;鏈霉素;乙胺丁醇;耐藥性;基因突變
結核病是由結核分枝桿菌引起的一種傳染性疾病,雖然結核病的發病率呈緩慢下降趨勢,但是近年來由于耐藥結核分枝桿菌的出現和傳播,使得結核病的疫情仍然不容樂觀。據估算,2013年耐多藥肺結核疫情最高的是印度(6.1萬),中國排在第2位(5.4萬),俄羅斯排在第3位(4.1萬)。中國新患者中耐多藥的比例為5.7%,高于全球平均水平3.5%[1]。中國是人口大國,也是結核病22個高負擔國家之一。貴陽市是貴州省的省會,位于中國西南部,屬于中國西部地區,經濟、醫療、衛生水平處于全國下游,結核病的疫情高于全國平均水平[2]。
合理選擇化療藥物、全程足量用藥是治療結核病的關鍵問題。利福平、異煙肼、鏈霉素、乙胺丁醇是治療結核病的常用一線藥物,對這些藥物耐藥的結核病也是臨床上治療的一大難題。耐藥結核病患者需要藥物敏感性試驗來優化治療方案。傳統的細菌學試驗耗時長,不利于結核病的治療,因此需要研發快速的耐藥診斷技術。 目前基因芯片法檢測利福平和異煙肼已在臨床開展應用,鏈霉素和乙胺丁醇尚無商品化的快速檢測試劑和方法。據報道[3-4],rpsl、rrs和embB基因的突變分別與鏈霉素和乙胺丁醇耐藥相關,由于結核分枝桿菌耐藥基因具有多態性,各地區的流行菌群不同,突變熱點也不一致。因此本實驗對貴陽市分離的耐藥和敏感菌株進行rpsl、rrs和embB基因突變的篩查,為評估和建立本地區結核分枝桿菌的快速診斷耐藥性的方法提供參考。
1 材料與方法
1.1 菌株 質控菌株H37Rv由中國疾病預防控制中心(CDC)傳染病所結核病研究室提供,為異煙肼、利福平、鏈霉素、乙胺丁醇敏感菌株。39株結核分枝桿菌臨床分離株均來自貴陽市肺科醫院肺結核患者的痰液標本,根據《結核病診斷細菌學檢驗規程》進行結核分枝桿菌的分離及鑒定,藥物的敏感性實驗采用比例法進行[5],包括乙胺丁醇和鏈霉素均耐藥菌株19株,均敏感株20株。
1.2 主要試劑和儀器 2×Taq PCR Master MIX和DNA Ladder Marker(上海生工生物技術有限公司);柱式分枝桿菌基因組DNA提取試劑盒(北京天恩澤生物技術有限公司);生物安全柜由貴陽市公共衛生救治中心分枝桿菌實驗室提供,PCR儀由貴州省高校病原生物學特色重點實驗室提供。
1.3 結核分枝桿菌基因組DNA的制備 挑取一定量L-J培養基斜面上生長的結核分枝桿菌,置于400 μL TE緩沖液中,混勻后80 ℃水浴滅活15 min,采用柱式分枝桿菌基因組DNA提取試劑盒進行DNA的提取,-20 ℃保存備用。
1.4 PCR擴增和測序 在GenBank中查詢標準菌株H37Rv的rpsl(Gene:888259)、rrs(2700429)和embB(886126)基因的全序列,根據文獻[6]設計引物(由上海生工生物技術有限公司合成),詳見表1。PCR產物送上海生物工程有限公司進行測序,對于發生突變的菌株均進行兩次PCR和測序,確保所得序列的正確性。
1.5 DNA序列分析 將臨床分離株測序所得序列在NCBI中進行BLAST分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),并與GenBank中結核分枝桿菌標準菌株H37Rv的rpsl、rrs和embB基因序列進行比對,尋找突變位點。
表1 目的基因,引物序列及擴增產物大小
Tab.1 Target gene, primer sequences and product sizes

PrimerSequences(5'→3')Productsize/bprpslF:GCCGAGCTCAAACAGAACGT-GAAAG486R:GTTAAGCTTCGTAGACCGGG-TCGTTGrrsF:ACGGTAGGTGGAGAAGAAG160R:CCCGCACGCTCACAGTembBF:TTAGATACTTCACCCTGACCG-ACGC847R:CAACTTACGGTGAACAGGCA-TAGCG
2 結 果
2.1 鏈霉素相關耐藥基因檢測結果 39株MTB臨床分離菌株經rpsl基因片段引物擴增后均得到長度約為486 bp的產物(見圖1)。將各臨床菌株的rpsl基因片段測序結果與GenBank中結核分枝桿菌標準菌株H37Rv的rpsl基因序列進行比對,19株耐藥菌株中有14株存在rpsl基因突變,突變率為73.7%(14/19),其中12株為AAG→AGG突變,1株為AAG43AAT突變,1株AAG88AGG密碼子突變,20株敏感菌株有1株發生rpslAAG43AGG突變,變異率為5.0%;rpsl43突變在鏈霉素耐藥菌株和敏感菌株中的分布差異具有顯著性(χ2=17.03,P<0.05)。39株MTB臨床分離菌株經rrs基因片段引物擴增后均得到長度約為160 bp的產物(見圖2),但均未檢測到rrs基因突變。

M: 100 bp DNA marker; 1: H37Rv; 3-10: Sample; 2: Negative control圖1 部分菌株rpsl基因PCR擴增產物電泳圖譜Fig.1 Electrophoresis of the amplified PCR products of rpsl
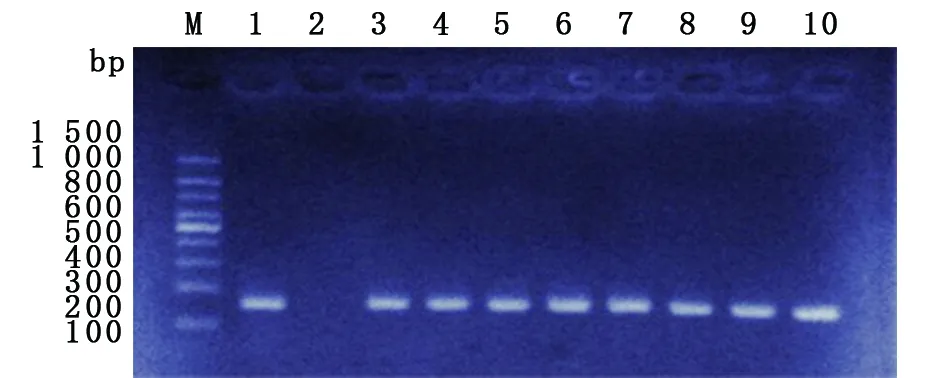
M: 100 bp DNA marker; 1: H37Rv; 3-10: Sample; 2: Negative control圖2 部分菌株rrs基因PCR擴增產物電泳圖譜Fig.2 Electrophoresis of the amplified PCR products of rrs
2.2 乙胺丁醇相關耐藥基因檢測結果 對39株
MTB臨床分離菌株的embB基因片段進行引物擴增后,均得到長度為847 bp的產物(見圖3)。將臨床分離株的embB基因擴增產物測序后與GenBank中結核分枝桿菌標準株H37Rv的embB基因進行比對,19株耐藥菌株中有9株檢出embB基因突變,47.4%(9/19)為306位密碼子突變,其中6株為ATG→GTG突變,1株為ATG→ATA突變,1株為ATG→ATT突變,1株為ATG→ATC突變。有7株發生embB基因406及497位密碼子突變,3株為406位密碼子GGC→GCC突變,3株為406位密碼子GGC→AGC突變,1株CAG→CGG(Gln→Arg)突變,embB306突變在乙胺丁醇耐藥菌株和敏感菌株中的分布差異具有統計學意義(χ2=12.32,P<0.05)。20株敏感菌株未檢測出突變。
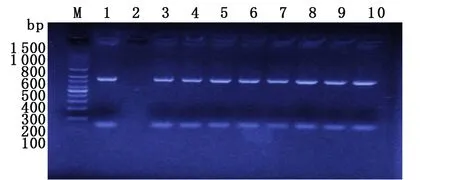
M: 100 bp DNA marker; 1: H37Rv; 3-10: Sample; 2: Negative control圖3 部分菌株embB基因PCR擴增產物電泳圖譜Fig.3 Electrophoresis of the amplified PCR products of embB
表2 結核分枝桿菌臨床分離株基因變異分布
Tab.2 Gene mutations in M. tuberculosis clinical isolates
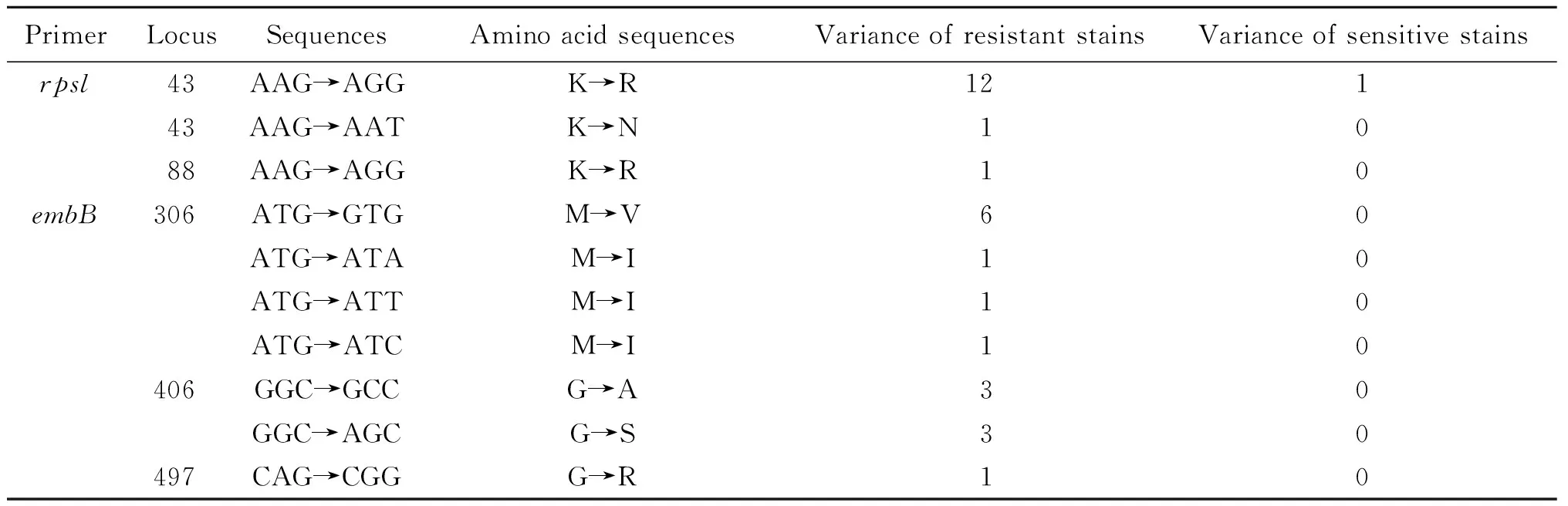
PrimerLocusSequencesAminoacidsequencesVarianceofresistantstainsVarianceofsensitivestainsrpsl43AAG→AGGK→R12143AAG→AATK→N1088AAG→AGGK→R10embB306ATG→GTGM→V60ATG→ATAM→I10ATG→ATTM→I10ATG→ATCM→I10406GGC→GCCG→A30GGC→AGCG→S30497CAG→CGGG→R10
3 討 論
作為一線抗結核藥物,異煙肼、利福平、乙胺丁醇和鏈霉素在結核病的防治、治療方面起著重要作用。隨著分子生物的不斷發展,經文獻報道的,與一線藥物耐藥相關的耐藥基因有十多種。其中與異煙肼耐藥相關的katG[7]、inhA[8]及oxyR-aphC[9]基因,與利福平耐藥相關的rpoB[10]基因,與鏈霉素耐藥相關的rpsl、rrs基因及與乙胺丁醇耐藥相關的embB基因一直是學者們研究較多的內容,目前關于貴州省結核分枝桿菌耐藥基因多態性方面的研究較少。本課題組曾對貴陽及周邊地區結核分枝桿菌的異煙肼和利福平耐藥的特征進行了研究[11-13],為基因芯片技術快速診斷利福平和異煙肼耐藥的推廣提供了實驗依據。本文對結核分枝桿菌臨床菌株進行了鏈霉素和乙胺丁醇主要耐藥相關基因序列的檢測和分析,可為研發和推廣應用分子生物學技術快速診斷耐藥結核提供實驗依據。
結核分枝桿菌鏈霉素耐藥是由于編碼核糖體S12蛋白的rpsl基因和編碼16S rRNA的rrs基因發生突變所致。rpsl基因最常見K43R位突變,少數見K43N位突變[14]。在本次研究的19株鏈霉素耐藥菌株中有14株檢測出rpsl43基因突變,其中13株為K43R,1株為K43N突變,也與之前的研究結果一致。在新加坡、東印度[15-16]等地區rpsl43位也是鏈霉素耐藥基因突變的主要變異類型。本次實驗中1株鏈霉素敏感株檢出了rpsl43位突變,雖然rpsl43位突變與鏈霉素耐藥性具有統計學意義,但是敏感株發生的突變,降低了rpsl43用于檢測鏈霉素耐藥性的特異度。rrs基因的突變主要集中在491位C→T,512位C→T,516位C→T,在530高度保守的環區還可發生513位A-C/T的顛換[17],但本實驗鏈霉素敏感和耐藥株均未檢出rrs基因變異,可能是該基因本身突變率較低或者該突變株非本地流行菌群。
乙胺丁醇主要作用于阿拉伯糖基轉移酶,抑制阿拉伯糖基聚合入阿拉伯半乳聚糖,影響細胞壁分枝菌酸-阿拉伯半乳聚糖-肽聚糖復合物的形成,使藥物與酶的相互作用發生改變,導致耐藥。embB基因(特別第306位密碼子)的錯義突變最常見[18],embB基因突變使糖基轉移酶結構發生改變,影響了乙胺丁醇與其相互作用,從而導致結核分枝桿菌對乙胺丁醇耐藥性的產生。結核分枝桿菌耐乙胺丁醇分離株embB基因突變主要發生在306位密碼子,變異類型多為M306V, M306I, M306L[19],這與本次實驗結果一致。本實驗的19株乙胺丁醇耐藥菌株embB基因突變率為84.2%,9株為306位密碼子突變,尚存在G406A,G406S和G497R突變,未發現其他地區菌株存在的embB基因285、330和630位點突變[20],并且有3株乙胺丁醇耐藥株未檢出embB基因變異。結果表明結核分枝桿菌embB基因突變特征存在地區差異,并且除embB基因突變外,本地結核分枝桿菌對乙胺丁醇可能有其他耐藥機制。
本研究通過對結核分枝桿菌臨床分離株的基因測序分析發現,各耐藥基因突變位點與國內外的研究基本一致,但各位點突變形式和比例又有自身特點。鑒于MTB基因具有豐富的地域多態性,為最大限度地避免假陰性結果,以基因芯片法檢測耐藥突變和在某地區的廣泛應用還需要以大量的臨床菌株進行驗證。
[1] World Health Organization(WHO): Global Tuberculosis Report[R], Geneva:WHO press.2014.
[2] Wang LX, Cheng SM, Chen MT, et al. The fifth national tuberculosis epidemiological survey in 2010[J]. Chin J Antitube rculosis, 2012, 34(8): 485-508. (in Chinese)
王黎霞, 成詩明, 陳明亭, 等. 2010年全國第五次結核病流行病學抽樣調查報告[J]. 中國防癆雜志, 2012, 34(8):485-508.
[3] Cuevas-Córdoba B, Cuellar-Sánchez A, Pasissi-Crivelli A, et al.rrsandrpslmutations in streptomycin-resistant isolates ofMycobacteriumtuberculosisfrom Mexico[J]. J Microbiol Immunol Infect. 2013, 46(1): 30-34. DOI: 10.1016/j.jmii.2012.08.020
[4] Sirgel FA, Warren RM, Streicher EM, et al.EmbB306 mutations as molecular indicators to predict ethambutol susceptibilit y inMycobacteriumtuberculosis[J]. Chemotherapy, 2012, 58(5): 358-363.DOI:10.1159/000343474
[5] Canetti G, Fox W, Khomenko A, et al. Advances in techniques of testing mycobacterial drug sensitivity, and the use of se nsitivity tests in tuberculosis control programmes[J]. Bull World Health Organ, 1969, 41(1): 21-43.
[6] Wang Y, Xie JP, Hu CH,et al. Molecular epidemiological research and rapid detection of streptomycin-resistant gene in drug-resist antMycobacteriumtuberculosis[J]. Chin J Infect, 2006, 6(5): 313-316. (in Chinese)
王瑩, 謝建平, 胡昌華等. 耐藥結核分枝桿菌鏈霉素耐藥基因的分子流行病學研究及其快速檢測 [J]. 中國感染與化療雜志, 2006, 6 (5): 313-316.
[7] Loots du T. An alteredMycobacteriumtuberculosismetabolome induced bykatGmutations resulting in isoniazid resistan ce[J]. Antimicrob Agents Chemother, 2014, 58(4): 2144-2149. DOI:10.1128/AAC.02344-13
[8] Tseng ST, Tai CH, Li CR, et al. The mutations ofkatGandinhAgenes of isoniazid-resistantMycobacteriumtuberculosisis olates in Taiwan[J]. J Microbiol Immunol Infect, 2015, 48(3): 249-255. DOI: 10.1016/j.jmii.2013.08.018
[9] Dalla Costa ER, Ribeiro MO, Silva MS, et al. Correlations of mutations inkatG,oxyR-ahpCandinhAgenes andinvitrosusceptibility inMycobacteriumtuberculosisclinical strains segregated by spoligotype families from tuberculosis prevalent cou ntries in South America[J]. BMC Microbiol, 2009, 9: 39. DOI: 10.1186/1471-2180-9-39
[10] Xu G, Wang J, Guo Y, et al. Analysis of the molecular evolution of theMycobacteriumtuberculosisdrug-resistant gene rpoB in Asia using a Bayesian evolutionary method[J]. Clin Lab, 2015, 61(8): 1017-1025.
[11] Bi YK, Ou WZ, Luo KW, et al. Isoniazid resistance and related gene mutation of 31Mycobacteriumtuberculosisclinical isolates in Guiyang area[J]. Chin J Pathogen, 2014, 9(10): 885-887.DOI: (in Chinese)
畢雅坤, 歐維正, 駱科文,等. 31株結核分枝桿菌異煙肼耐藥相關基因檢測及序列分析[J]. 中國病原生物學雜志, 2014, 9(10): 885-887.
[12] Ou WZ, Chen ZH, Chen J, et al. Determination of resistance geneskatGandinhAinMycobacteriumtuberculosisisola tes from Guizhou Province by gene chip[J]. Chin J Zoonoses, 2014, 9(10): 885-887. DOI:(in Chinese)
歐維正, 陳崢宏, 陳靜, 等. 基因芯片技術檢測貴州省結核分枝桿菌耐藥基因katG和inhA[J]. 中國人獸共患病學報, 2015, 31 (7): 655-658.
[13] Ou WZ, Luo KW, Chen ZH, et al. Analysis of characteristic ofropBgene mutations associated withMycobacteriumtuberculosisresistance to rifampicin in Guizhou of China[J]. Chin J Clin Pharmacol, 2015, 31(10): 833-835.DOI: (in Chinese)
歐維正, 駱科文, 陳崢宏, 等. 貴州地區結核分枝桿菌利福平耐藥相關基因ropB突變特征分析[J]. 中國臨床藥理學雜志, 2015, 31(10): 833-835.
[14] Shi R, Zhang J, Li C, et al. Detection of streptomycin resistance inMycobacteriumtuberculosisclinical isolates from C hina as determined by denaturing HPLC analysis and DNA sequencing[J]. Mic Infect, 2007, 9(14/15): 153 8-1544.
[15] Sun YJ, Luo JT, Wong SY, et al. Analysis ofrpslandrrsmutations in Beijing and non-Beijing streptomycin-resistantMycobacteriumtuberculosisisolates from Singapore[J]. Clin Mic Infect, 2010, 16(3): 287-289.DOI: 10.1111/j.1469-0691
[16] Potdar P, Thakur P. Development of sequence based molecular diagnostic test to evaluate MDR and XDR inM.tuberculosispatients from Western India[J]. Am J Infect Dis Microbiol, 2013, 1(3): 50-58.
[17] Meier A, Sander P, Schaper KJ, et al. Correlation of molecular resistance mechanisms and phenotypic resistance levels in streptomycin-resistantMycobacteriumtuberculosis[J]. Antimicrob Agents Chemother, 1996, 40(11): 2452-2454.
[18] Ramaswamy S, Amin AG, Goksel S, et al. Molecular genetic analysis of nucleotide polymorphisms associated with etha mbutol resistance in human isolates ofMycobacteriumtuberculosis[J]. Antimicrob Anents Chemother, 2000, 44(2): 321.
[19] Zhang H, Chen X, Wang Z, et al. Pyrosequencing analysis for mutations in embB codon306 among clinicalMycobacteriumtuberculosisisolates from Qingdao, China[J]. Int J Clin Exp Med, 2015, 8(7): 11276-11282
[20] Zhao LL, Sun Q, Liu HC, et al. Analysis ofembCABmutations associated with ethambutol resistance in multidrug-resist antMycobacteriumtuberculosisisolates from China[J]. Antimicrob Agents Chemother, 2015, 59(4): 2045-2050.DOI: 10.1128/ AAC.04933-14
Chen Zheng-hong, Email: chenzhenghong@gmc.edu.cn
Detection of mutations associated with streptomycin and ethambutol resistance inMycobacteriumtuberculosisclinical isolates
SUN Rong1, OU Wei-zheng2, WANG Yan2, MENG Jun2,QING Wan2,BI Ya-kun1, CHEN Zheng-hong1
(1.DepartmentofMicrobiology,GuizhouMedicalUniversity,Guiyang550025,China;2.GuiyangPublicHealthCenter,Guiyang550003,China)
Therpsl,rrsandembBgene fragments ofM.tuberculosisisolates collected throughout Guiyang were PCR-amplified and screened for mutations by direct sequencing methodology. These strains included 19 resistant strains resistant to both streptomycin and ethambutol, and 20 strains susceptible to both streptomycin and ethambutol. Results showed that 73.7% (14/19) resistantM.tuberculosisisolates had mutations in therpslgene, and therpslAAG43AGG substitution predominated (85.7%). One isolate had mutations in therpslAAG43AAT, one in therpslAAG88AGG. TherpslAAG43AGG substitution was also found in one susceptible strain, and mutation rate was 5.0% in 20 susceptible strains. No mutations in therrsgene were found in both resistant and susceptible strains. Of 84.2%(16/19) resistant isolates had mutations in theembBgene, includingembBATG306GTG substitution in 6 strains, ATG306ATT, ATG306ATC and CAG497CGG in 3 strains respectively. Three strains harboured theembBGGC406GCC substitution and 3 had GGC406AGC mutation. No mutation ofembBfragment was determined in all the 20 susceptible strains. The results showed diversity in therpslandembBmutations related with streptomycin or ethambutol inM.tuberculosisin Guiyang. Therpsl43 andembB306 are the predominant mutation loci.
Mycobacteriumtuberculosis; streptomycin; ethambutol; antibiotic resistance; gene mutation
陳崢宏,Email: chenzhenghong@gmc.edu.cn
1.貴州醫科大學微生物學教研室,貴陽 550025;
2.貴陽市公共衛生救治中心,貴陽 550003
10.3969/j.issn.1002-2694.2016.08.015
R378
A
1002-2694(2016)08-0760-05
2016-01-22;
2016-03-18
貴州省社會發展攻關項目(黔科合SY[2013]3060號);貴陽市科技計劃項目(筑科合同[20141001]33號)聯合資助
Supported by the Brainstorm Project on Social Development in Guizhou Province (Guizhou Science Contract No.[2013]3060) and the Science and Technology Project in Guiyang City (Guiyang Science Contract No.[20141001]33)

