犬惡絲蟲天冬氨酸轉氨酶基因的原核表達及分析
劉 梅,蘭景超,王 宇,林 海,張志和,王成東,羅 娌,劉 理,古小彬,汪 濤,楊光友
?
犬惡絲蟲天冬氨酸轉氨酶基因的原核表達及分析
劉 梅1,蘭景超2,王 宇1,林 海1,張志和2,王成東2,羅 娌2,劉 理2,古小彬1,汪 濤1,楊光友1
目的 了解犬惡絲蟲天冬氨酸轉氨酶(AspAT)基因特征及其在蟲體的定位,對犬惡絲蟲AspAT(DiAspAT)基因進行了原核表達和免疫熒光定位分析。方法 從犬惡絲蟲成蟲轉錄組數據庫中篩選到DiAspAT基因序列,通過RT-PCR方法克隆DiAspAT基因,利用相關軟件進行生物信息學分析;構建原核表達載體pET32a(+)-AspAT并進行誘導表達;表達產物經Ni-NTA層析柱純化后進行Western blotting分析;通過免疫組化技術觀察DiAspAT蛋白在犬惡絲蟲蟲體內的定位分布。結果DiAspAT基因的ORF框長度為1 221 bp,編碼406個氨基酸,理論相對分子量45.731 8 kDa,等電點為8.05,表達的重組蛋白約為64 kDa;Western blotting顯示AspAT重組蛋白能被犬惡絲蟲陽性血清識別;間接免疫熒光染色結果顯示,DiAspAT在犬惡絲蟲的側索、皮下組織、肌細胞、假體腔壁、子宮及腸上皮、發育的胚胎中分布。結論 成功克隆和表達了DiAspAT基因,并完成DiAspAT在雌性犬惡絲蟲成蟲上的定位,為進一步了解犬惡絲蟲的生理代謝及犬惡絲蟲病的診斷和防控奠定基礎。
犬惡絲蟲;AspAT基因;克隆;原核表達;免疫熒光定位
犬惡絲蟲(Dirofilariaimmitis)成蟲主要寄生于犬科和貓科動物的右心室及肺動脈內,引起以循環障礙、呼吸困難、貧血和猝死等為特征的犬惡絲蟲病,該病呈全球性分布,在熱帶和亞熱帶地區廣泛流行[1],在我國北京、上海、廣東、四川等27個省和直轄市均有動物感染犬惡絲蟲的報道[2]。犬惡絲蟲也是一種蚊媒傳播的人獸共患寄生蟲,人通過叮咬可被感染,蟲體主要侵害肺部,引起以咳嗽、胸悶和胸疼為特征的臨床癥狀,蟲體還可在皮下、眼部、陰囊等處發現[3-6]。
天冬氨酸轉氨酶(AspAT,E.C.2.6.1.1)又稱谷草轉氨酶(GOT),參與氨基酸合成和降解,以不同方式參與氮代謝以及碳的利用率,并作為三羧酸循環多種代謝途徑中的一個重要酶。在瘧疾、艾美耳球蟲等研究中有過較多嘗試[7-15]。
為探討AspAT在犬惡絲蟲免疫學診斷、疫苗及藥物開發中的作用,本研究從犬惡絲蟲成蟲轉錄組數據庫中篩選DiAspAT基因[16],通過對該基因的克隆和原核表達,使用AspAT重組蛋白(rAspAT)制備多克隆抗體,應用間接免疫熒光染色法確定AspAT在雌性犬惡絲蟲成蟲的分布部位,為進一步開展犬惡絲蟲病的免疫診斷、疫苗和藥物的研發奠定基礎。
1 材料與方法
1.1 蟲株、菌株、載體及實驗動物 犬惡絲蟲陽性血清及活蟲體采自四川自然感染犬惡絲蟲的陽性犬,采集的活蟲用PBS清洗并經形態學鑒定后,凍于液氮中備用。雌性犬惡絲蟲成蟲的石蠟切片,由四川農業大學動物寄生蟲病實驗室提供。宿主菌大腸桿菌DH5α、大腸桿菌BL21(DE3)、pMD19-T Vector,購于寶生物工程(大連)公司;pET32a(+)載體由四川農業大學動物寄生蟲病實驗室提供。2只健康新西蘭大白兔,雌性,1.5~2.0 kg,購于四川農業大學養兔場。
1.2 主要試劑 總RNA抽提試劑盒,購于華舜生物工程(上海)有限公司,逆轉錄試劑盒,購于Thermo公司;DNA Marker、Protein Marker、限制性內切酶(EcoRI、HindIII)、T4 DNA連接酶,購于寶生物工程(大連)公司;瓊脂糖凝膠回收試劑盒、Ni-NTA Agarose,購于Qiagen公司;TaqPCR MasterMix、質粒小量抽提試劑盒、HRP-DAB底物顯色試劑盒,購于天根生化科技(北京)有限公司;HRP-標記羊抗兔IgG、HRP-標記羊抗狗IgG,購于博士德生物工程(武漢)有限公司;弗氏完全佐劑和不完全佐劑,購于Sigma公司;FITC-標記羊抗兔IgG,購于EarthOx公司;HiTrap Protein A HP,購于Bio-Rad公司;PCR引物合成和測序由上海英俊生物工程有限公司完成;其它試劑均為國產分析純。
1.3 DiAspAT基因的RT-PCR擴增 從液氮中取出犬惡絲蟲成蟲,根據總RNA抽提試劑盒提取犬惡絲蟲的總RNA,按照反轉錄試劑盒反轉錄合成cDNA。從犬惡絲蟲成蟲轉錄組數據庫中篩選得到的DiAspAT unigene11646(GenBank Accession No.: JR907574)序列,使用Primer premiere 5.0軟件設計上、下游引物,序列如下:P1 5′-CCGGAATTCATGGCATCATTTTTCAAGAACA -3′;P2 5′- CCCAAGCTT CTATTTTAAATAGTTAATTGTTTCA -3′( 下劃線序列分別含EcoR I和Hind III酶切位點),然后以cDNA為模板進行PCR擴增。擴增體系(25 μL):cDNA模板1 μL,上、下游引物各1 μL,PCR Mixture 12.5 μL,滅菌雙蒸水9.5 μL。反應條件:94 ℃,5 min; 94 ℃ 60 s,54 ℃ 60 s,72 ℃ 60 s;35個循環,72 ℃延伸10 min。擴增產物經1%瓊脂糖凝膠電泳檢測。
1.4 DiAspAT基因的克隆及生物信息學分析 用瓊脂糖凝膠回收試劑盒回收目的產物后克隆于pMD19-T載體,構建重組質粒pMD19-T-AspAT,將菌液PCR和EcoR I和Hind III雙酶切鑒定為陽性的重組質粒送往英駿生物技術(上海)測序。
使用ORF Finder工具分析DiAspAT基因的ORF框(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)。通過在線軟件ProtParam(http://web.expasy.org/protparam/)、SignalP(http://www.cbs.dtu.dk/services/SignalP/)、TMHMM2.0(http://www.cbs.dtu.dk/services/ TMHMM/)和BepiPred 1.0b Server(http://www.cbs.dtu.dk/services/BepiPred/)對DiAspAT基因編碼的蛋白序列的基本理化性質、信號肽切割位點、跨膜區、B抗原表位進行預測分析。利用在線分析工具(http://www.predictprotein.org/)預測DiAspAT蛋白的二級結構。在NCBI中通過BlastP搜索與DiAspAT蛋白同源的其他寄生蟲物種序列,運用DNAMAN軟件進行序列相似性分析和MEGA5.0軟件構建系統進化樹(Neighbor-joining方法)。
1.5 重組表達載體的構建 對測序正確的pMD19-T-AspAT重組質粒和pET32a(+)質粒用EcoR I和Hind III雙酶切后回收目的片段,用T4 DNA連接酶進行連接后轉化到DH5α菌中構建pET32a(+)-AspAT重組菌,將菌液PCR和酶切鑒定正確的pET32a(+)-AspAT重組質粒和空載體pET32a(+)質粒轉化到大腸桿菌BL21(DE3)中,用含0.1 mg/mL氨芐青霉素(AMP)篩選陽性單克隆,且菌液PCR鑒定為陽性的菌液送往測序。
1.6 pET32a(+)-AspAT重組蛋白的表達及純化
將測序正確的含pET32a(+)-AspAT的重組菌和空載體pET32a(+)菌接種于用含氨芐西林的LB液體培養基,于37 ℃搖床培養6 h,從中吸取菌液加入到LB液態培養基(含AMP)中,于37 ℃搖床培養4 h,直至菌液OD值達到0.6,加入IPTG至終濃度達1 mmol/L(同時選取不加IPTG的作為對照),在37 ℃培養5 h。12 000 r/min離心10 min收集菌體,超聲波裂解后,對表達菌體的上清和沉淀用12%SDS-PAGE電泳分析,確定重組蛋白的表達情況和存在形式。并優化原核表達的IPTG的誘導濃度、誘導時間和最適溫度。
在最佳表達條件下大量誘導表達,rAspAT用Ni-NTA層析柱親和純化,其操作按照說明書進行,用核酸蛋白儀測定純化后回收蛋白濃度。
1.7 免疫印跡(Western blotting)分析 重組蛋白經SDS-PAGE分離后的凝膠半干轉移到PDVF膜上,5%脫脂奶粉室溫封閉2h,血清(1∶200稀釋)作為一抗4 ℃孵育過夜,TBST洗滌,HRP-標記羊抗狗IgG(1∶3 000稀釋)作為二抗進行室溫孵育2 h,TBST洗滌,二氨基聯苯胺(DBA)顯色,加純水終止反應。
1.8 兔抗rAspAT-IgG血清的制備和純化 參照Hu等[17]的免疫方法制備兔抗rAspAT-IgG血清。免疫程序結束后經心臟采血并分離血清。獲得的血清根據HiTrap Protein A HP的使用說明純化兔抗rAspAT-IgG,純化后的抗體分別用SDS-PAGE和Western blotting檢測其純度和特異性。
1.9 間接免疫熒光染色 雌性犬惡絲蟲成蟲石蠟切片經二甲苯脫蠟,梯度酒精復水,用檸檬酸緩沖液進行抗原熱修復,PBS(pH7.4)洗滌,滴加3%H2O2,室溫孵育20 min,PBS洗滌,滴加5%BSA(牛白蛋白溶液)室溫封閉30 min,PBS洗滌。滴加1.2.5制備的一抗,同時以免疫AspAT蛋白前的兔血清作為陰性對照(1∶100稀釋),于濕盒中4 ℃孵育過夜,PBS洗滌后,滴加二抗(FITC-標記的羊抗兔IgG,用0.1%伊文氏藍1∶100稀釋),濕盒中37 ℃孵育1 h,PBS洗滌。樹脂膠封片后,在熒光顯微鏡下觀察與照像。
2 結 果
2.1 DiAspAT基因的RT-PCR擴增及克隆 DiAspAT基因的RT-PCR產物通過1%瓊脂糖凝膠電泳,得到與預期結果一致的特異性條帶,如圖1A。重組質粒pMD19-T-AspAT經PCR鑒定為陽性的,其質粒經雙酶切鑒定顯示,插入片段的大小與預期結果一致(圖1B),測序顯示其序列與轉錄組數據中篩選的序列一致。

M1、M2:DNA分子質量標準;(A)DiAspAT基因的RT-PCR產物,1:PCR產物;(B)重組質粒pMD19-T-AspAT的酶切鑒定,1:雙酶切產物,(C)重組質粒pET32a(+)-AspAT的酶切鑒定,1:雙酶切產物M1: DL2000 DNA marker; M2 DL7000 DNA marker; (A) Products of DiAspAT gene by RT-PCR, 1: PCR products; (B) Identification of recombinant plasmid pMD19-T-AspAT by restriction endonucleases digestion, 1: products of double-enzyme digestion; (C) Identification of recombinant plasmid pET32a(+)-AspAT by restriction endonucleases digestion, 1: products of double-enzyme digestion圖1 DiAspAT基因的RT-PCR產物及重組質粒的酶切鑒定Fig.1 Products of DiAspAT gene by RT-PCR and identification of recombinant plasmid by restriction endonucleases digestion
2.2 DiAspAT基因的生物信息學分析
2.2.1 DiAspAT蛋白的理化性質預測 DiAspAT的ORF框長為1 221 bp,其中A、T、C、G含量分別為31.70%、29.81%、17.04%、21.46%,G+C含量為38.49%,A+T含量為61.51%。Protparam分析結果顯示,DiAspAT基因序列編碼406個氨基酸,蛋白質的分子式C2067H3205N549 O580S22,原子總數為4 623,相對分子量45.731 8 kDa,等電點為8.05。帶負電荷氨基酸殘基總數為43,帶正電荷氨基酸殘基總數為45。含量最多的氨基酸分別是Ala(37/406,9.1%)和Leu(36/406,8.9%),Cys和Trp含量最少,無Pyl和Sec兩種氨基酸。蛋白在280 nm的消光系數為58245 M·cm,估算半衰期大于10 h。蛋白質不穩定系數為32.26,親水性平均數為-0.159,因此,預測DiAspAT是穩定的可溶性蛋白。
該蛋白無信號肽,整個蛋白都在膜外,蛋白抗原表位有14個,主要集中在23-30、39-46、57-60、92-100、109-113、132-135、154-157、172-176、187-200、222-230、272-275、288-296、338-346、388-392位氨基酸。DiAspAT蛋白的二級結構顯示,該蛋白中α-螺旋占48.77%,β-折疊占10.84%,環狀結構占40.39%。其次,預測該蛋白有4個N-糖基化位點,4個蛋白激酶C磷酸化位點,2個酪蛋白激酶Ⅱ磷酸化位點,1個酪氨酸激酶磷酸化位點,3個N-豆蔻酰化位點,1個Class I轉氨酶磷酸吡哆醛PLP附著位點(aa249-262)。
2.2.2 DiAspAT蛋白的氨基酸序列同源性分析及分子進化樹構建 犬惡絲蟲的AspAT氨基酸序列與盤尾絲蟲AspAT(Accession No.:AAY89413)、班氏絲蟲(Accession No.:EJW87036)、馬來絲蟲(Accession No.:XP_001897604)、羅阿絲蟲(Accession No.:XP_003146526)、鼠類圓線蟲(Accession No.:CEF69308)的AspAT序列相似性分別為89%、86%、85%、84%和67%。從系統發育樹中可以看出犬惡絲蟲AspAT與盤尾絲蟲的親緣關系較近,聚為一個分支(圖2)。
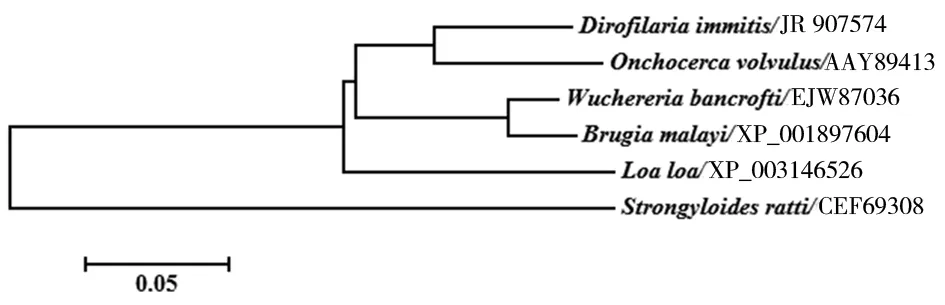
圖2 DiAspAT蛋白的系統發育樹(NJ樹)Fig.2 Phylogenetic analysis of DiAspAT proteins (NJ tree)
2.3 重組表達載體的構建 pET32a(+)-AspAT重組質粒經PCR鑒定為陽性的,其質粒經雙酶切鑒定顯示,插入片段的大小與預期結果一致(圖1C)。酶切鑒定正確的質粒pET32a(+)-AspAT轉化到表達菌BL21中,經PCR鑒定為陽性的質粒其測序結果顯示成功構建表達載體。
2.4 重組蛋白的表達、純化及免疫印跡分析 經優化,確定原核表達最佳條件為:IPTG濃度為1.0 mmol/L,37 ℃誘導6 h。誘導表達后的pET32a(+)-AspAT重組菌,經12%SDS-PAGE電泳顯示,得到約64 kDa左右的蛋白,與預期結果大小一致(圖3A)。通過可溶性分析,pET32a(+)-AspAT表達的蛋白主要以上清的形式存在。pET32a(+)-AspAT表達的蛋白,經Ni-NTA親和層析柱純化后的蛋白經SDS-PAGE電泳顯示,AspAT蛋白條帶較單一,純度較好(圖3A)。免疫印跡分析,顯示該重組蛋白能與感染了犬惡絲蟲的犬陽性血清特異性結合,目的條帶與預期結果一致(圖3B)。

M:蛋白質分子質量標準;(A)rAspAT的表達,1:IPTG誘導的含pET32a(+)-AspAT的細菌;2:IPTG未誘導的含pET32a(+)-AspAT的細菌;3:IPTG未誘導的含pET32a(+)的細菌;4:IPTG誘導的含pET32a(+)細菌。(B)rAspAT的純化和免疫印跡分析,1:純化的重組蛋白;2:rAspAT的免疫印跡結果M: Protein marker; (A) The expression of recombinant protein AspAT, 1: pET32a(+)-AspAT induced by IPTG; 2: pET32a(+)-AspAT without IPTG induction; 3: pET32a(+) without IPTG induction; 4: pET32a(+) induced by IPTG; (B) Purification of recombinant protein AspAT and western blot analysis, 1: Purified recombinant protein; 2: Western blotting result of rAspAT圖3 rAspAT的表達、純化及免疫印跡分析Fig.3 Expression, purification and western blotting analysis of recombinant protein AspAT
2.5 DiAspAT的免疫熒光定位
間接免疫熒光染色結果顯示,DiAspAT在雌性犬惡絲蟲成蟲的側索、皮下組織、肌細胞、子宮及腸上皮、假體腔壁、發育中的胚胎都有表達,其中在側索、假體腔壁、子宮及腸上皮、發育的胚胎表達水平較高,在皮下組織、肌細胞表達水平較低(圖4A)。
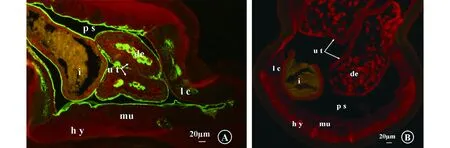
(A)純化的兔抗重組AspAT蛋白抗體作為一抗;(B)免疫前的血清作為一抗。i:腸;ut:子宮;de:發育的胚胎;hy:皮下組織;mu:肌肉;lc:側索;ps:假體腔;比例尺:20 μm(A) purified rabbit anti-rDiAspAT-Ig as primary antibodies; (B) pre-immune sera as primary antibodies. i: intestine; ut: uterus; de: developing embryos; hy: hypodermis; mu: muscle; chord; lc: lateral chord;ps: pseudocoelom; scale bar, 20 μm圖4 雌性犬惡絲蟲成蟲橫切面AspAT蛋白的間接免疫熒光定位Fig.4 Tissue localization of the transverse sections of adult female Dirofilaria immitis AspAT protein detected by indirect immunofluorescence
3 討 論
3.1 天冬氨酸轉氨酶(AspAT)在寄生蟲氨基酸合成與代謝中發揮重要作用,已有研究發現絲蟲體內的內共生菌——沃爾巴克氏體(Wolbachia)需要的氨基酸除它自己能合成的唯一氨基酸——內消旋二氨基庚二酸外,其生長所需的其它氨基酸均由絲蟲提供[18]。沃爾巴克氏體是絲蟲對宿主致病的原因,且可能是絲蟲從胚胎形成及幼蟲發育到成蟲所必需的,有助于絲蟲的胚胎形成、生長發育和生殖,清除沃爾巴克氏體對絲蟲的發育有抑制作用,甚至使絲蟲死亡,而研究發現大多數引起人類和動物疾病的絲蟲(包括馬來絲蟲、班氏絲蟲、盤尾絲蟲和犬惡絲蟲等)均含有沃爾巴克氏體共生菌,且沃爾巴克氏體對于研究人類和動物絲蟲的致病性和絲蟲病的防治均具有重要意義,針對絲蟲沃爾巴克氏體為靶點的藥物治療,為人和動物絲蟲病的治療帶來了新的思路[19-22]。
雖然有研究報道在盤尾絲蟲中有一個編碼沃爾巴克氏體AspAT的基因,但是由于沃爾巴克氏體在分類學上,屬于立克次體目、立克次體科,沃爾巴克體屬,且研究發現立克次氏體在細胞內的生活方式演變過程中許多基因已經丟失,只剩下6個基因參與氨基酸代謝,而獨立生存的細菌比之多5倍,沃爾巴克氏體的AspAT在細胞內的生活方式演變過程中其在代謝中的功能是否仍然保留還不清楚[7,23]。本次研究發現,在側索、皮下組織、子宮上皮以及發育的胚胎均有DiAspAT的表達,與文獻中沃爾巴克氏體分布的位置一致[18, 21, 24-25]。這表明,絲蟲的AspAT可能不僅對絲蟲的代謝起重要作用,也可能對沃爾巴克氏體的氨基酸代謝有一定的作用,抑制絲蟲AspAT酶活性可能同時抑制絲蟲及其體內的沃爾巴克氏體的生長,推測DiAspAT可以作為抗犬惡絲蟲的藥物靶點,研發同時抑制犬惡絲蟲和沃爾巴克氏的AspAT活性的藥物,可起到雙重殺滅作用,這樣或許還可以克服藥物只針對犬惡絲蟲或沃爾巴克氏達不到理想的治療效果所帶來的缺點,從而為有效的治療犬惡絲蟲病及人類絲蟲病提供參考。
3.2 DiAspAT在腸上皮細胞有表達,而有研究發現,嗜血性寄生蟲(如犬惡絲蟲)腸上皮細胞的“隱藏抗原”能被宿主的免疫應答機制識別,但是它們通常不會暴露在宿主的免疫系統下,且與分泌排泄的抗原或傳統的暴露在蟲體表面的抗原相比,腸上皮細胞的“隱藏抗原”更適合做寄生蟲的蛋白疫苗[26],因此,DiAspAT可能是犬惡絲蟲的腸上皮細胞的“隱藏抗原”,可作為一個候選疫苗抗原。同時,在免疫印跡分析中,rAspAT能被犬惡絲蟲陽性血清識別,說明該血清中存在有針對rAspAT的特異性抗體,且rAspAT具有反應原性,因此,DiAspAT還可作為犬惡絲蟲病免疫學診斷的候選抗原。
[1] Sassi A, Geary J, Leroux LP, et al. Identification ofDirofilariaimmitisproteins recognized by antibodies from infected dogs[J]. J Parasitol, 2014, 100(3): 364-367.DOI: 10.1645/13-437.1
[2] Huang HS, Yang GY, Wang CD, et al. Advances in pathogen biology of Heartworm disease[J]. Sichuan J Zool, 2008, 27(2): 316-319. (in Chinese)
黃紅松, 楊光友, 王成東,等. 犬惡絲蟲病病原生物學研究進展[J]. 四川動物, 2008, 27(2): 316-319.
[3]Foissac M, Million M, Mary C, et al. Subcutaneous infection withDirofilariaimmitisnematode in human, France[J]. Emerg Infect Dis, 2013, 19(1): 171-172.DOI: 10.3201/eid1901.120281
[4]Martínez-De La Puente J, Moreno-Indias I, Hernández-Castellano LE, et al. Host-feeding pattern ofCulextheileri(Diptera: Culicidae), potential vector ofDirofilariaimmitisin the Canary Islands, Spain[J]. J Med Entomol, 2012, 49(6): 1419-1423.DOI: 10.1603/ME12081
[5]Godel C, Kumar S, Koutsovoulos G, et al. The genome of the heartworm,Dirofilariaimmitis, reveals drug and vaccine targets[J]. FASEB J, 2012, 26(11): 4650-4661.DOI: 10.1096/fj.12-205096
[6]Bowman D, Little SE, Lorentzen L, et al. Prevalence and geographic distribution ofDirofilariaimmitis,Borreliaburgdorferi,Ehrlichiacanis, andAnaplasmaphagocytophilumin dogs in the United States: results of a national clinic-based serologic survey[J]. Vet Parasitol, 2009, 160(1/2): 138-148.DOI: 10.1016/j.vetpar.2008.10.093
[7]Fischer P, Bonow I, Büttner DW, et al. An aspartate aminotransferase ofWolbachiaendobacteria fromOnchocercavolvulusis recognized by IgG1antibodies from residents of endemic areas[J]. Parasitol Res, 2003, 90(1): 38-47.DOI: 10.1007/s00436-002-0813-2
[8]Wrenger C, Müller IB, Silber AM, et al. Aspartate aminotransferase-bridging carbohydrate and energy metabolism inPlasmodiumfalciparum[J]. Curr Drug Metab, 2012, 13(3): 332-336.DOI: 10.2174/138920012799320400
[9]Ting LM, Shi WX, Lewandowicz A, et al. Targeting a novelPlasmodiumfalciparumpurine recycling pathway with specific immucillins[J]. J Biol Chem, 2005, 280(10): 9547-9554.DOI: 10.1074/jbc.M412693200
[10] Kronenberger T, Lindner J, Meissner KA, et al. Vitamin B6-dependent enzymes in the human malaria parasitePlasmodiumfalciparum: a druggable target?[J]. Biomed Res Int, 2014, 2014: 1-11.DOI: 10.1155/2014/108516.
[11]Marciano D, Llorente C, Maugeri DA, et al. Biochemical characterization of stage-specific isoforms of aspartate aminotransferases fromTrypanosomacruziandTrypanosomabrucei[J]. Mol Biochem Parasitol, 2008, 161(1): 12-20.DOI: 10.1016/j.molbiopara.2008.05.005
[12]Thornburg JM, Nelson KK, Clem BF, et al. Targeting aspartate aminotransferase in breast cancer[J]. Breast Cancer Res Treat, 2008, 10(5): R84.DOI: 10.1186/bcr2154
[13]Wrenger C, Müller IB, Schifferdecker AJ, et al. Specific inhibition of the aspartate aminotransferase ofPlasmodiumfalciparum[J]. J Mol Biol, 2011, 405 (4): 956-71. DOI: 10.1016/j.jmb.2010.11.018
[14]Jain R, Jordanova R, Müller IB, et al. Purification, crystallization and preliminary X-ray analysis of the aspartate aminotransferase ofPlasmodiumfalciparum[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2010, 66(4): 409-412.DOI: 10.1107/S1744309110003933
[15]Yolchiyev YYO, Mamedova FZG. Glutamate dehydrogenase, alanine- and aspartate aminotransferase of E.Tenella(Apicomplexa, Coccidia) oocysts and effect of amino acids' alkyl derivatives on their activities[J]. IJNES, 2007, 1(2): 23-27.
[16]Fu Y, Lan J, Zhang Z, et al. Novel insights into the transcriptome ofDirofilariaimmitis[J]. PLoS One, 2012, 7(7): e41639.DOI: 10.1371/journal.pone.0041639
[17]Hu YX, Guo JY, Shen L, et al. Get effective polyclonal antisera in one month[J]. Cell Res, 2002, 12(2): 157-160.DOI: 10.1038/sj.cr.7290122
[18]Taylor MJ, Bandi C, Hoerauf A.Wolbachiabacterial endosymbionts of filarial nematodes[J]. Adv Parasitol, 2005, 60: 245-284.DOI: 10.1016/S0065-308X(05)60004-8
[19]Bouchery T, Lefoulon E, Karadjian G, et al. The symbiotic role ofWolbachiain Onchocercidae and its impact on filariasis[J]. Clin Microbiol Infect, 2013, 19(2): 131-140.DOI: 10.1111/1469-0691.12069
[20]Slatko BE, Taylor MJ, Foster JM. TheWolbachiaendosymbiont as an anti-filarial nematode target[J]. Symbiosis, 2010, 51(1): 55-65.DOI: 10.1007/s13199-010-0067-1
[21]Taylor MJ, Voronin D, Johnston KL, et al.Wolbachiafilarial interactions[J]. Cell Microbiol, 2013, 15(4): 520-526.DOI: 10.1111/cmi.12084
[22] Liu M, Yang GY. Progress onWolbachia——symbiotic bacteria in human and animal filariae[J]. Progr Vet Med, 2015, 36(4): 87-91.(in Chinese)
劉梅, 楊光友. 人和動物絲蟲共生菌——沃爾巴克氏體研究進展[J]. 動物醫學進展, 2015, 36(4): 87-91.
[23]Andersson SGE, Zomorodipour A, Andersson JO, et al. The genome sequence ofRickettsiaprowazekiiand the origin of mitochondria[J]. Nature, 1998, 396(6707): 133-140.DOI: 10.1038/24094
[24]Fischer K, Beatty WL, Weil GJ, et al. High pressure freezing/freeze substitution fixation improves the ultrastructural assessment ofWolbachiaendosymbiont - filarial nematode host interaction[J]. PLoS One, 2014, 9(1): e86383.DOI: 10.1371/journal.pone.0086383
[25]Ferri E, Bain O, Barbuto M, et al. New insights into the evolution ofWolbachiainfections in filarial nematodes inferred from a large range of screened species[J]. PLoS One, 2011, 6(6): e20843.DOI: 10.1371/journal.pone.0020843
[26]Mcgonigle S, Yoho ER, James ER. Immunisation of mice with fractions derived from the intestines ofDirofilariaimmitis[J]. Int J Parasitol, 2001, 31(13): 1459-1466. DOI: 10.1016/S0020-7519(01)00272-7
Yang Guang-you,Email:guangyou1963@aliyun.com
Prokaryotic expression and analysis of aspartate aminotransferase gene fromDirofilariaimmitis
LIU Mei1, LAN Jing-chao2, WANG Yu1, LIN Hai1, ZHANG Zhi-he2,WANG Cheng-dong2,LUO Li2, LIU Li2, GU Xiao-bin1, WANG Tao1, YANG Guang-you1
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;2.ChengduResearchBaseofGiantPandaBreeding,Chengdu610081,China)
To understand the characteristic of aspartate aminotransferase (AspAT) gene fromDirofilariaimmitis(DiAspAT) and location in the worm, the gene of DiAspAT was cloned and expressed in prokaryocyte and analysed by immunofluorescence localization. DiAspAT gene sequence was selected from transcriptome of adultD.immitisand was cloned by RT-PCR method and analysed by bioinformatic approaches. A prokaryotic expression vetor of pET32a(+)-AspAT was reconstructed and then was induced expression. The expression product was purified by Ni-NTA affinity chromatography and analysed by Western blotting. Indirect immunofluorescence assay was performed to survey the distribution of DiAspAT protein in adult femaleD.immitis. The open reading frame of DiAspAT gene was 1 221 bp and encodes 406 amino acids, and the molecular weight of DiAspAT was 45.731 8 kDa and pI=8.05.The recombinant protein was about 64 kDa. Western blotting demonstrated that the AspAT recombinant protein (rAspAT) could be recognized by dog ofDiAspATdirofilariasis positive serum. Indirect immunofluorescence localization studies illustrated the DiAspAT protein localized in the lateral chord, hypodermis, muscle, pseudocoelom wall, epithelia of uterus and intestine, developing embryos. This study first successfuly clonied and expressied the DiAspAT gene, and completed locating of DiAspAT protein in adult femaleD.immitis. The results lay the foundation for further understanding of metabolism ofD.immitisand study the diagnosis and prevention and control of dirofilariasis.
Dirofilariaimmitis; AspAT gene; clone; prokaryotic expression; immunofluorescence localization
成都大熊貓繁育研究基金項目(No.CPF2014-09)資助
楊光友,Email:guangyou1963@aliyun.com
1.四川農業大學動物醫學院,成都 611130;
2.成都大熊貓繁育研究基地,成都 610081
10.3969/j.issn.1002-2694.2016.08.004
R383
A
1002-2694(2016)08-0700-06
2015-12-01;
2016-03-16
Supported by the Research Foundation of Chengdu Giant Panda Breeding (CPF-2014-09)

