藥用真菌桑黃原生質體的制備和誘變*
許謙
(菏澤學院生命科學系,山東菏澤274015)
藥用真菌桑黃原生質體的制備和誘變*
許謙
(菏澤學院生命科學系,山東菏澤274015)
利用酶處理桑黃(Phellinus igniarius)菌絲體,分離到原生質體并對其進行紫外線誘變,確定誘變后的致死率,以利于桑黃原生質體誘變及融合的合理實施。菌齡為10 d的桑黃菌絲體在1.5%溶壁酶、100 r·min-1、30℃條件下酶解3 h,獲得原生質體;再分別經紫外線照射10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s、90 s后;利用血球計數板對美蘭染色后的活性原生質體計數,計算桑黃原生質體紫外誘變后的致死率。結果顯示,原生質體致死率隨著照射時間的延長而增大,在40 s~50 s誘變時間內,曲線的變化最為劇烈;誘變時間為45 s時,致死率達到73%;誘變時間達到90 s時,致死率為100%。該結果能夠為桑黃原生質體誘變育種及融合育種的實施提供切實的理論依據。
桑黃;原生質體;制備;誘變
桑黃(Phellinus igniarius)屬于擔子菌亞門(Basidiomycotina)層菌綱(Hymenomycetes)[1],是目前國際公認的抗癌效果最好的藥用真菌之一[2-3],具有抗氧化、抗炎、降血脂、抗胃潰瘍、抗菌、抗病毒等多種藥理活性[4-5]。主要分布在中國、韓國、日本、朝鮮、俄羅斯遠東地區、菲律賓、澳大利亞、北美、中南美等地,被現代人稱為“森林黃金”[6]。
桑黃子實體自然形成周期長,其產品難以滿足市場需求。為高效生產其產品,一方面依靠液體培養,縮短桑黃產品的生產時間[7];另一方面則進行桑黃高產菌株的育種研究[8-10]。原生質體誘變是一種行之有效的育種方法[11-13]。微生物原生質體因細胞壁缺失而對外界刺激敏感度提高,使誘變的生物學效率更加明顯,有利于變異菌株的篩選和誘變機理探討[1 4-1 5]。誘變劑有物理誘變劑和化學誘變劑,兩者可單獨使用也可復合使用。常用的物理誘變劑有紫外線、γ射線、激光、離子注入等,而化學誘變劑有烷化劑(NTG等)、堿基類似物(5-BU等)、脫氨基(亞硝酸)、移碼誘變劑(吖啶類染料等)等[16]。紫外線作為物理誘變劑,因設備簡單,成本低,誘變效果好,被廣泛應用于誘變育種[17-24]。
誘變育種有2個重要的環節,即誘變和篩選,篩選重于誘變。篩選需要經驗積累基礎上的合理判斷。有研究認為,原生質體誘變后,其致死率在70%~80%,獲得的正突變菌株比率較高[25-26]。原生質體誘變的另一個作用是原生質體致死。原生質體致死是進行原生質體融合的一個有效方案。雙親原生質體致死后進行融合,便于融合子的順利檢出。但原生質體最好是在剛剛致死的狀態下才有利于融合的成功實現[27]。所以100%致死率的精確判斷會為原生質體的高效融合奠定堅實的基礎。
本試驗是為有效地進行桑黃原生質體誘變育種和原生質體融合育種而進行的前期工作,擬探索桑黃原生質體的制備及紫外線誘變技術,總結桑黃原生質體誘變后的致死率規律,為桑黃原生質體誘變育種及融合育種的實施提供切實的理論依據。
1 材料與方法
1.1材料與試劑
桑黃菌由菏澤學院生命科學系微生物實驗室保藏;馬鈴薯、玉米粉、麩皮均為山東菏澤牡丹區生產;溶壁酶>2 000 μ·mg-1,上海藍季科技發展有限公司;葡萄糖為AR,汕頭市西隴化工廠有限公司;硫酸鎂為AR,天津市河東區紅巖試劑廠;磷酸二氫鉀為AR,天津市科密歐化學試劑有限公司;乙醇95%,安徽安特生物有限公司;甘露醇均為AR,天津市科密歐化學試劑有限公司;瓊脂粉為BR,天津市科密歐化學試劑有限公司。
1.2儀器與設備
高壓蒸汽滅菌器MLS-3780,日本三洋電器株式會社;標準型雙人凈化工作臺SW-CJ-1C,蘇凈集團蘇州安泰空氣技術有限公司;單人單面紫外誘變臺(垂直)ZYT-DDC,濟南杰康凈化設備廠;恒溫培養箱PYX-250B-Z,上海博訊實業有限公司;全溫振蕩器HZQ-Y,哈爾濱市東聯電子技術開發有限公司;電冰箱BCD-282VBP,海信(北京)電器有限公司;藥品保存箱HYC-360,上海肯強儀器有限公司;電子天平FA1004,梅特勒-托利儀器有限公司;移液槍brand,上海恒奇儀器儀表有限公司;臺式高速冷凍離心機HR/T20M,湖南赫西儀器裝備有限公司;血球計數板1103,姜堰市慧成玻璃制品廠;電熱鼓風干燥箱01932,北京市永光明醫療儀器廠。
1.3方法
1.3.1培養基配制
PDA培養基:馬鈴薯200 g,去芽去皮切成小塊,沸水中煮20 min,4層紗布過濾,取濾液,加入葡萄糖20 g、瓊脂18 g,加水定容至1 000 mL,pH值為6,121℃蒸汽滅菌20 min。
液體培養基:玉米粉25 g、麩皮35 g,沸水中煮30 min,4層紗布過濾,取濾液加入硫酸鎂1.5 g、磷酸二氫鉀1 g,加水定容至1 000 mL,pH值為6,121℃蒸汽滅菌20 min。
1.3.2菌種活化
在無菌的條件下,將原種接種到PDA培養基平板上進行活化培養18 d。
1.3.3液體培養
菌種平板活化培養18 d后,在無菌條件下,用滅菌打孔器在活化平板外圈打取菌餅(直徑1 cm),向裝有50 mL液體培養基的250 mL錐形瓶中接入2個菌餅,29℃、160 r·min-1條件下液體培養10 d。
1.3.4桑黃原生質體制備的前期工作
(1)酶解液的制備(配制1.5%溶壁酶)
稱量固體粉末狀的溶壁酶0.12 g,放入15 mL滅菌離心管內,用滅菌的5 000 μL槍頭取8 mL、0.6 mol·L-1滲透壓穩定劑于上述15 mL離心管內溶解酶液。溶解起始時,由于酶制劑在冰箱內保存,易結成小塊狀固體,可上下顛倒離心管數次,使其完全溶解混勻。用無菌針管吸取15 mL離心管內的8 mL酶液,將針頭拔掉,向上推出管內多余空氣,再將0.22 μm滅菌微孔濾膜的兩頭,分別與針管和無菌針頭安裝,取另一支15 mL滅菌離心管,將酶液緩慢推入其中,過濾除菌后,上下顛倒離心管數次,使其混勻,置于離心管架待用。
(2)稱量桑黃菌絲體
超凈工作臺滅菌30 min,無菌操作取29℃、160 r·min-1條件下搖床培養10 d的菌絲體,8層滅菌紗布過濾,無菌水洗滌2次,用牙簽鈍頭攪拌,洗滌干凈后用滅菌濾紙吸去表面水分,并用滅菌鑷子挑取個體較小的菌絲體于放有稱量紙的滅菌培養皿的天平上稱量,稱取5份150 mg菌絲體,分別放入5個2 mL滅菌EP管內待用。
1.3.5桑黃原生質體的制備
在無菌條件下,按150 mg濕菌絲加0.5 mL酶液,用1 000 μL移液槍取無菌酶液(5份)0.5 mL分別加入到上述待用的5個2 mL的EP管中,用牙簽鈍頭攪拌,使EP管中的菌絲體與酶液混勻,在30℃下以100 r·min-1轉速搖床振蕩3 h[1]。
1.3.6桑黃原生質體的精制
將5個EP管的酶解液分別倒入滅菌漏斗中過濾,并用滅菌滲透壓穩定劑洗滌2 mLEP管,每個EP管用1 000 μL移液槍量取0.5 mL的0.6 mol·L-1滅菌滲透壓穩定劑沖洗,重復2次,合并沖洗液倒入滅菌漏斗中過濾,并用牙簽鈍頭緩慢攪拌,過濾除去菌絲碎片,用1 000 μL移液槍吸取濾液置于50 mL滅菌離心管中,用0.6 mol·L-1滅菌滲透壓穩定劑沖洗過濾使用的錐形瓶,將沖洗液倒入上述50 mL離心管中,稀釋到15 mL,3 800 r·min-1離心10 min去上清液,用0.6 mol·L-1滅菌滲透壓穩定劑洗滌2次,得到純化后白色的桑黃原生質體沉淀。稀釋后,通過血球計數板計數求得桑黃原生質體的平均產量。
1.3.7桑黃原生質體的紫外誘變
將原生質體用0.6 mol·L-1滲透壓穩定劑稀釋成原生質體懸液,用潔凈的血球計數板計數,稀釋到濃度1.58×106個·mL-1待用[17]。無菌操作下用1 000 μL移液槍各取1 mL稀釋原生質體懸液于27個直徑6 cm的培養皿中,輕微晃動,使菌液均勻分布在培養皿中,將培養皿放入距15 W的紫外燈管30 cm處(已預熱30 min),打開皿蓋進行紫外誘變,1組10 s,2組20 s,3組30 s,4組40 s,5組50 s,6組60 s,7組70 s,8組80 s,9組90 s,每組3個重復。誘變結束后,用移液槍吸取適量于血球計數板上,0.01%美蘭染色后,計算誘變后桑黃原生質體的致死率,求3個重復的平均值。
(3)對供電可靠性要求較高的小區內,需要在環網柜進線側加裝電流互感器,選擇型號為LZZB610 0.5/10P,額定電壓10 kV,用作電氣測量和電力保護。
1.3.8桑黃誘變原生質體致死率計算
誘變致死率(P)計算公式為:
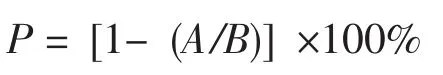
式中:A為誘變后存活的原生質體數,即經酶處理后的混合液用高滲溶液稀釋,經紫外線誘變后,在顯微鏡下,血球計數板上存活的原生質體數(無色或淡藍色原生質體,個/中格);B為未經誘變存活的原生質體數,即經酶處理后的混合液,用高滲溶液稀釋,在顯微鏡下,血球計數板上存活的原生質體數(無色或淡藍色原生質體,個/中格)。
2 結果與分析
2.1桑黃原生質體在顯微鏡下的形態
將純化的白色原生質體沉淀,用0.6 mol·L-1滅菌滲透壓穩定劑適當稀釋后,得到原生質體懸液,用血球計數板觀察桑黃原生質體的顯微形態(圖1)。
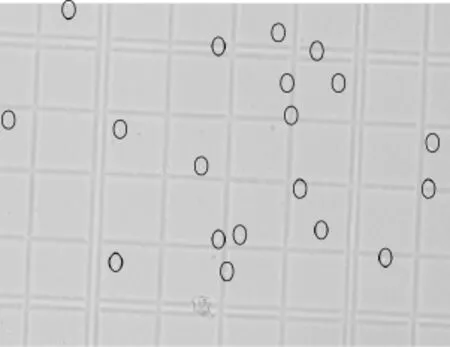
圖1 桑黃原生質體的顯微形態(×40)Fig.1 Microscopic morphology of Phellinus igniarius protoplast(×40)
圖1顯示,去壁后所得到的桑黃原生質體,個體較大,形態圓潤,折光性較低。可能是由于經溶壁酶處理后,細胞外層僅有一層細胞膜,細胞膜外層不再有細胞壁的存在,使細胞的形態不再受細胞壁的限制,因此細胞形態在適當范圍內變大,呈圓球狀。由于細胞失去細胞壁,這就意味著細胞同時也失去了細胞壁中折光性較強的成分,使之在顯微鏡下表現為細胞折光性降低。
2.2桑黃原生質體的產量
桑黃原生質體的產量為5個重復所獲原生質體產量的平均值,即4 576萬個·mL-1,見表1。
由表1可以看出,標準差(SD)為47.79,數值較小,說明5個重復桑黃原生質體的產量比較穩定,相對標準差(RSD)為1.04%,表示5個重復桑黃原生質體產量精密度較高。
2.3桑黃原生質體紫外線誘變后的致死率
誘變結束后,用移液槍吸取少量誘變后菌液于血球計數板上,計數中方格平均活性原生質體數(0.01%美蘭∶原生質體懸液=9∶1,染色5 min,對無色或淡藍色的活性原生質體進行計數),其結果見表2、圖2。
由圖2可以看出,桑黃原生質體經紫外線誘變10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s、90 s后,致死率隨著時間的延長而增大,在40 s~50 s誘變時間內,曲線的變化最為劇烈,當誘變時間達到50 s以后,曲線變化趨于平穩,并于90 s達到100%。
根據試驗結果,40 s~50 s誘變時間內,致死率由54%增加到87.3%,跨過了誘變育種的最佳致死率70%~75%的范疇;誘變90 s時,致死率達到100%。由于不能確認是否恰好達到100%,又設計了45 s和85 s兩個誘變時間進行誘變。誘變結果是45 s時,致死率達到73%;85 s時,致死率為98.4%。所以可以確定用于誘變育種的最佳誘變時間為45 s[25-26],用于原生質體致死處理后進行融合育種的誘變時間以90 s為宜[27]。

表1 桑黃原生質體產量Tab.1Yield of Phellinus igniarius protoplast
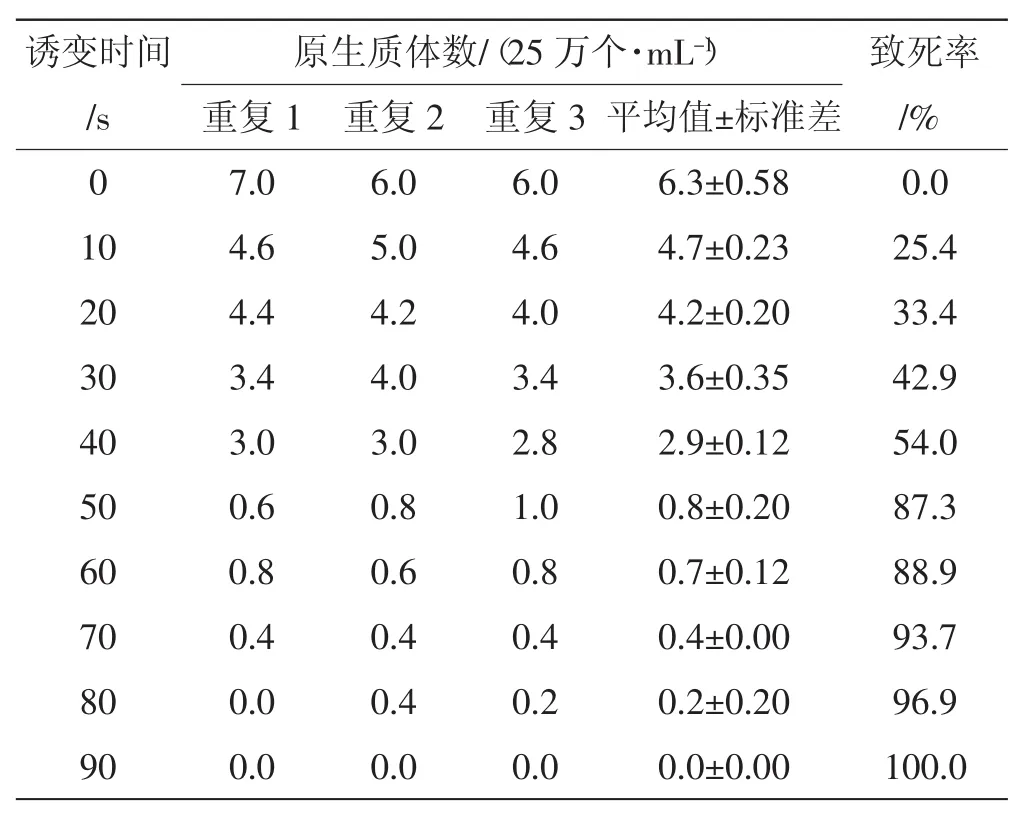
表2 桑黃原生質體紫外線誘變后的致死率Tab.2Fatality rate of Phellinus igniarius protoplast after being mutagenized by UV

圖2 桑黃原生質體致死率變化曲線Fig.2Phellinus igniarius protoplast fatality rate curve
3 討論
原生質體誘變是一種有效的育種方式。丁興紅等[13]利用離子注入對桑黃原生質體進行誘變,獲得了高產黃酮、多糖的菌株。El-Bondkly AM[17]曾用紫外線和NTG對木聚糖酶產生菌曲霉菌sp.NRCF5進行復合誘變,然后用于原生質體融合。Wang M[18]曾用紫外線和NTG對紅豆杉內生菌Tubercularia sp.TF5的原生質體進行誘變,產生了新的代謝產物。祝子坪[8]利用紫外線與He-Ne激光對桑黃原生質體進行誘變,獲得了新性狀菌株。陳敏等[19]利用紫外線和γ射線對刺芹側耳(Pleurotus eryngii GIM 5.280)原生質體進行復合誘變獲得了木質素酶高產菌株,酶產量可達110 U·mL-1。李恒等[20]對亞麻刺盤孢ST的原生質體進行誘變,獲得高產7α,15α-diOH-DHEA菌株,摩爾得率可達36.9%,比出發菌株提高了50%。梅凡等[21]對漆酶產生菌原生質體進行紫外誘變,獲得誘變菌株UV-56,漆酶酶活比出發菌株提高56%。宋細忠等[22]采用紫外誘變方法對蝙蝠蛾擬青霉原生質體進行選育,選出l株菌絲體得率和腺苷含量明顯高于原始菌株的誘變株,經過10代繼代培養、搖瓶試驗,結果表明該誘變株發酵性狀穩定。Hou X[23]通過誘變和原生質體融合對木糖發酵酵母菌抑制劑耐受性能進行了改善。劉新星等[24]采用原生質體紫外誘變、DES(硫酸二乙酯)誘變、紫外等常規誘變技術結合高通量篩選的方法,篩選出可利霉素高產菌株。El-Bondkly AM[17]利用紫外線照射和NTG結合誘變的方法,對木聚糖酶產生菌曲霉菌sp.NRCF5進行復合誘變,獲得高木聚糖酶產生菌。
本試驗是在前期工作的基礎上[1],對桑黃原生質體的制備及誘變進行了研究。研究發現,利用優化的原生質體制備方法可以獲得高質量桑黃原生質體,取1 mL濃度為1.58×106個·mL-1的原生質體懸液于直徑6 cm的培養皿里,在15 W紫外光燈(預熱30 min)下30 cm處進行紫外誘變,誘變致死率隨著時間的延長而增大,在40 s~50 s誘變時間內,曲線的變化最為劇烈,在45 s時達到73%,當誘變時間達到50 s以后,曲線變化趨于平穩,并在90 s時達到100%。
以上結果與祝子坪等[8]把桑黃原生質體(1 mL于直徑6 cm的培養皿中)于15 W紫外燈(預熱20 min)、燈距30 cm處誘變,0~20 s照射時間內,曲線變化劇烈,20 s后趨于平穩的結果不同。原因可能與誘變時原生質體懸液濃度不同有關。
另外,對于原生質體紫外致死的記載,有郭成金等[27]對蛹蟲草原生質體致死的記載,認為距離30 W紫外光燈10 cm處,垂直照射13 min,能使原生質體致死率達到100%;有朱蘊蘭等[28]對冬蟲夏草原生質體誘變致死的記載,認為取3 mL濃度為105個·mL-1的原生質體懸液于直徑9 cm的培養皿里,15 W紫外燈、燈距30 cm,誘變30 s,致死率達到80%,誘變40 s后,致死率達到90%;有吳強等[29]對蓮花菌原生質體誘變致死的記載,認為取5 mL濃度為108個·mL-1的原生質體懸液于直徑9 cm的培養皿里,15 W紫外燈、燈距30 cm,紫外誘變120 s時,原生質體的致死率為87.3%,300 s時,接近100%;有陳建中[30]對草菇原生質體誘變致死的記載,認為取0.1 mL濃度為105/mL的原生質體懸液涂布在培養基上,15 W紫外燈,燈距30 cm,原生質體致死時間為110 s;有劉海英[31]對杏鮑菇原生質體誘變致死的記載,認為取0.1 mL濃度為105/mL的原生質體懸液涂布在半固體培養基上,20 W紫外燈(245 nm,預熱20 min),燈距30 cm,原生質體致死時間為120 s以上。造成紫外致死時間不同的原因可能與菌種不同、起始原生質體濃度不同、誘變的原生質體懸液量不同有關。
原生質體致死是原生質體融合有效實施的準備條件之一。紫外致死與熱致死、離子注入致死相比,紫外致死用時較短,一般為1 min左右即完成滅活,處理迅速。熱致死則需要較多時間,陳建忠[30]報道的草菇熱致死條件為50℃,3 min,耗時較長;丁興紅[13]報道的離子注入的致死方式,對設施要求較高,準備工作較繁瑣。所以,原生質體紫外致死具有省時、操作簡單方便的優勢。
4 結論
利用溶壁酶高效制備的桑黃原生質體在15 W紫外燈下30 cm處進行紫外誘變,誘變時間為45 s時,誘變致死率為73%,誘變時間為90 s時,誘變致死率為100%。
原生質體誘變后,其致死率達到70%~75%的誘變效果最好[25-26];致死率剛剛達到100%時利于進行致死后原生質體間的融合育種[27]。所以本試驗結果對于進行桑黃原生質體的誘變育種及桑黃種間、桑黃與其他種間的原生質體融合的實施提供了理想的實驗基礎。
[1]許謙.桑黃菌原生質體的高效分離探究[J].核農學報,2014,28(11):1993-2000.
[2]胡啟明.桑黃菌絲體多糖的分離純化、結構鑒定及生物活性研究[D].武漢:華中農業大學,2013:51-52.
[3]Kim GY,Park SK,Lee MK,et al.Proteoglycan isolated from Phellinus linteus activates murine B lymphocytes via protein kinase C and protein tyrosin kinase[J].International immunopharmacology,2003,3(9):1281-1292
[4]王欽博.桑黃抗氧化活性成分的篩選及其分離純化[D].上海:上海師范大學,2011:80-84
[5]Sangmoo Lee,Jin Il Kim,Jun Heo,et al.The Anti-influenza virus effect of Phellinus igniarius extract[J].Journal of Microbiology,2013,51(5):676-681
[6]曾念開.“桑黃”的鑒定、人工培養及優良菌株的選育[D].北京:中國協和醫科大學,2007:3.
[7]許謙.桑黃菌絲體黃酮液體發酵培養基的優化[J].食品與機械,2015,31(1):190-193
[8]祝子坪,李娜,曲文娟,等.桑黃菌原生質體誘變及發酵菌株選育[J].食品科學,2008,29(11):473-476
[9]王宏媛.桑黃菌原生質體誘變育種及發酵工藝條件的研究[D].南京:江蘇大學,2013:24-26.
[10]邱文娜,王秋穎,曾念開,等.桑黃原生質體融合菌株及其親本生物學特性的比較研究[J].中國農學通報,2010,26(15):58-61.
[11]JunWei C.Ultraviolet mutagensis of the cellulose producer Aspergillus niger using industrial strain improvement[J]. FEMS Microbiol Letters,1988,50(1):1-4.
[12]祝子坪,馬海樂,曲文娟.He-Ne激光與紫外線復合誘變桑黃菌原生質體的研究[J].應用激光,2007,27(3):220-223
[13]丁興紅,溫成平,丁志山,等.低能離子射線誘變桑黃菌株SH009的初步研究[J].食用菌學報,2010,17(2):15-18
[14]祝子坪,馬海樂.桑黃菌原生質體紫外線誘變及高產菌株選育[J].食用菌,2007(5):13-15
[15]張銀萍,張舒,汪洋,等.靈芝原生質體的高效制備及誘變[J].安徽農業科學,2012,40(25):12379-12381.
[16]金志華,林建平,梅樂和.工業微生物遺傳育種學原理與應用[M].北京:化學工業出版社,2007:52-58.
[17]El-Bondkly AM.Molecular identification using ITS sequences and genome shuffling to improve 2-deoxyglucose tolerance and xylanase activity of marine-derived fungus, Aspergillus sp.NRCF5[J].Applied Biochemistry Biotechnology,2012,167(8):2160-2173.
[18]Wang M,Liu S,Li Y,et al.Protoplast mutation and genome shuffling induce the endophytic fungus Tubercularia sp.TF5 to produce new compounds[J].Current Microbiology,2010, 61(4):254-60.
[19]陳敏,姚善涇.原生質體復合誘變選育剌芹側耳木質素降解酶高產菌株[J].高校化學工程學報,2010,24(3):462-467.
[20]李恒,吳燕,魏利莎,等.原生質體誘變提高亞麻刺盤孢ST對底物DHEA的耐受性和轉化率[J].化工進展,2014,33(9):2415-2420.
[21]梅凡,江義,趙超,等.漆酶高產菌株的篩選及誘變育種[J].貴州農業科學,2014,42(2):128-131.
[22]宋細忠,龔伯梁,徐長豪,等.蝙蝠蛾擬青霉原生質體紫外誘變育種[J].食用菌學報,2010,17(4):15-17.
[23]Hou X,Yao S.Improved inhibitor tolerance in xylose-fer- 2005(6):654-658.
[5]暴增海,馬桂珍,吳智艷.雞腿蘑對基質的降解及有關酶活性變化特點研究[J].北方園藝,2002(3):54-55.
[6]宋安東,周利霞,胡渝,等.產木質素降解酶類香菇菌株的篩選[J].河南農業大學學報,2006(3):307-310.
[7]李紅,肖千明,劉娜,等.食用菌菌種退化原因分析及復壯方法的探討[J].遼寧農業科學,2010(5):53-55.
[8]姚自奇,蘭進.杏鮑菇研究進展[J].食用菌學報,2004(1):52-58.
[9]張志鴻.杏鮑菇工廠化高效栽培關鍵技術研究[D].福州:福建農林大學,2013.
[10]鄭雪平,冀宏,尹永剛,等.中國杏鮑菇工廠化生產實踐及問題分析與展望[J].食用菌,2014(1):7-11.
[11]謝玉榮,何橋蘭.蘇北杏7菇工廠化栽培技術研究[J].農業科技通訊,2015(12):161-162.
[12]郭艷艷,阮玲云,馮宏昌,等.不同營養條件下斑玉蕈菌絲生長及產酶特性[J].菌物學報,2014(3):697-705.
[13]劉紅,黃建軍,許麗娟等.談食用菌菌種的保藏[J].現代農業科技,2008,(18):122-123.
[14]孔維麗,袁瑞奇,孔維威等.食用菌菌種保藏歷史、現狀及研究進展概述[J].中國食用菌,2015(5):1-5. menting yeast Spathaspora passalidarum by mutagenesis and protoplast fusion[J].Appllied Microbiology Biotechnology, 2012,93(6):2591-2601.
[24]劉新星,李萍,趙小峰,等.常規誘變結合高通量篩選選育可利霉素高產菌株[J].微生物學報,2013,53(7):758-765.
[25]諸葛健.工業微生物育種[M].北京:化學工業出版社,2006:87-88.
[26]田泱源,李瑞芳.響應面法在生物過程優化中的應用[J].食品工程,2010(2):8-11.
[27]郭成金,趙潤,朱文碧.冬蟲夏草與蛹蟲草原生質體融合初探[J].食品科學,2010,31(1):165-171.
[28]朱蘊蘭,陳安徽,王陶,等.冬蟲夏草原生質體誘變育種研究[J].食品科學,2010,3(5):256-260.
[29]吳強,胡寶坤.原生質體紫外誘變選育蓮花菌深層發酵多糖高產菌株[J].食用菌,2014(5):20-21.
[30]陳建中.基因組重排技術在草菇耐低溫菌株選育上的應用[D].上海:上海海洋大學,2013:29.
[31]劉海英,張運峰,范永山,等.紫外線對杏鮑菇原生質體的誘變作用[J].核農學報,2011,25(4):719-723.
Preparation and Mutagenesis of Protoplast from Medicinal Mushroom Phellinus igniarius
XU Qian
(Department of Life Science,Heze University,Heze 274015,China)
In order to facilitate the reasonable implementation of Phellinus igniarius protoplasts mutagenesis and fusion,protoplast of Phellinus igniarius mycelia was obtained through the method of enzymolysis and mutagenized by UN,and the fatality rate was determined after mutagenesis.Protoplast was gained under the condition of strain age 10 d,1.5%lywallzyme solution, 100 r·min-1,30℃,3 h,and mutagenized by UV for 10 s,20 s,30 s,40 s,50 s,60 s,70 s,80 s,90 s respectively,active protoplasts after meilan dyeing were counted by using blood count slabs after mutagenesis,then the fatality rate was determined.Results showed that protoplast fatality rate increased with the extension of over time,in the 40 s and 50 s mutagenesis time,the shape of the curve varied sharply.When the mutagenesis time was 45 s,the fatality rate was 73%.When mutagenesis time was 90 s,the fatality rate reached 100%.The results will provide practical theory basis for the implementation of protoplast mutation breeding and the fusion breeding.
Phellinus igniarius;protoplast;preparation;mutagenesis
〈貯運加工〉
S646.9
A
1003-8310(2016)04-0067-06
10.13629/j.cnki.53-1054.2016.04.017
菏澤市科技發展計劃項目(2012N002)。
許謙(1971-),女,碩士,副教授,主要從事食(藥)用菌開發應用、微生物遺傳育種研究。E-mail:xq710301@163.com
2016-06-02

