替加環素治療耐碳青霉烯類鮑曼不動桿菌肺炎的療效分析
孫麗娜 , 周慶濤, 沈 寧, 賀 蓓
·論著·
替加環素治療耐碳青霉烯類鮑曼不動桿菌肺炎的療效分析
孫麗娜 , 周慶濤, 沈 寧, 賀 蓓
目的 研究替加環素治療耐碳青霉烯類鮑曼不動桿菌肺炎的療效及影響因素。方法 回顧性收集2012年8月-2014年9月于北京大學第三醫院住院并接受替加環素治療的耐碳青霉烯類鮑曼不動桿菌肺炎患者臨床資料,分析治療效果及影響因素。結果 研究共納入26例患者,臨床治愈13例,無效13例。治愈患者92.3 %(12/13)為聯合治療,包括舒巴坦制劑、碳青霉烯類及甲氧芐啶-磺胺甲唑。應用替加環素前住院天數大于20 d的患者比例,臨床治愈組(4例,30.8 %)低于臨床無效組(10例,76.9 %),P=0.047。Logistic回歸分析表明,急性生理與慢性健康(APACHEⅡ)評分>20分、血白細胞計數>10×109/L是治療無效的獨立危險因素(OR值分別為18.014,11.392,均P<0.05)。結論 替加環素對于耐碳青霉烯類鮑曼不動桿菌肺炎具有治療價值,病情嚴重程度對其療效具有顯著影響。
替加環素; 肺炎; 鮑曼不動桿菌
耐碳青霉烯類鮑曼不動桿菌(CRAB)是醫院獲得性感染的主要病原體之一。由于耐藥率逐漸增加,CRAB肺炎治療難度日益增大,即使多藥聯合治療,效果仍有限。替加環素作為一種新型廣譜抗菌藥物,對鮑曼不動桿菌有一定的抗菌效果,但目前缺乏足夠的臨床經驗和臨床試驗結果指導用藥。本文通過調查2012年8月-2014年9月北京大學第三醫院應用替加環素治療CRAB肺炎患者,分析替加環素的療效及影響因素。
1 材料與方法
1.1一般資料
收集2012年8月-2014年9月于我院住院并接受替加環素治療的CRAB肺炎患者為研究對象,共26例。入選標準:①診斷標準依據美國ATS/ IDSA 2005年制定的成人醫院獲得性肺炎、呼吸機相關性肺炎和衛生保健相關性肺炎診療指南[1]和2012年“中國鮑曼不動桿菌感染診治與防控專家共識”[2];②肺泡灌洗液、合格痰液或氣管內抽吸物等標本連續2次及以上細菌培養結果均為鮑曼不動桿菌。收集患者年齡、性別、體質量、身高等基本信息,住院日期、出院日期、入住ICU時間等住院信息,主要疾病診斷,應用替加環素前24 h內的急性生理與慢性健康(APACHEⅡ)評分,臨床肺部感染評分(CPIS),是否應用激素及免疫抑制劑等,血常規、生化、血氣分析等檢驗結果,是否進行各種有創操作(包括氣管插管、導尿管、中心靜脈置管等)、鮑曼不動桿菌藥敏結果、抗菌藥物治療方案及臨床療效、微生物療效、住院期間預后等。
1.2藥敏試驗及細菌鑒定
采用法國生物梅里埃公司VITEK2儀器以及紙片擴散法對分離菌進行鑒定和藥敏試驗,質控菌株為大腸埃希菌ATCC 25922,結果判定參照2012年美國臨床和實驗室標準化協會(CLSI)標準,其中頭孢哌酮-舒巴坦采用頭孢哌酮標準,替加環素使用美國食品藥品監督管理局(FDA)標準。
1.3替加環素用法
替加環素50 mg靜脈滴注每12小時1次,首劑加倍。聯合治療為替加環素聯合針對鮑曼不動桿菌治療的其他類抗菌藥物,不包括針對合并革蘭陽性球菌感染應用的萬古霉素、利奈唑胺和替考拉寧。
1.4臨床療效和細菌學療效評價
參照《抗菌藥物臨床試驗技術指導原則》[3]臨床療效和細菌學療效標準。臨床療效分為臨床治愈與臨床無效。細菌學療效分為清除、假定清除、未清除及假定未清除。
1.5研究方法
回顧性研究。比較臨床治愈組與無效組之間各臨床指標的差異,并進行Logistic回歸分析,統計替加環素治療CRAB的影響因素。
1.6統計方法
采用SPSS 15.0統計軟件進行分析。正態分布的計量資料,以(x±s)表示,兩兩比較采用t檢驗;非正態分布的計量資料,以M(QR)表示,兩兩比較采用Mann-Whitney非參數檢驗;率的比較采用χ2檢驗。通過Logistic回歸分析明確替加環素療效的獨立影響因素。P<0.05為差異有統計學意義。
2 結果
2.1基本臨床資料
共26例患者:男性占76.9 %(20/26);平均年齡(77.0±13.9)歲;92.3 %(24/26)為呼吸科ICU(RICU)患者;住院天數9~242 d,平均(66.3±44.5)d;APACHEⅡ評分中位數19(10)分。經替加環素治療后臨床治愈13例,無效13例。臨床無效組死亡11例(84.6 %)。
2.2鮑曼不動桿菌標本來源及藥敏結果
2.2.1標本來源 共分離鮑曼不動桿菌26株。21份(80.8 %)來源于氣管內抽吸物或肺泡灌洗液,5份(19.2 %)來源于合格痰液標本。
2.2.2鮑曼不動桿菌藥敏結果 鮑曼不動桿菌對多黏菌素B敏感率最高(92.3 %),其次為替加環素(78.9 %,共19株鮑曼不動桿菌作替加環素藥敏試驗)。對臨床常用的頭孢哌酮-舒巴坦、米諾環素的敏感率較低,均為11.5 %,但中介的比率仍相對較高,分別占42.3 %、30.8 %。對亞胺培南100 %耐藥,見表1。
2.3臨床療效的單因素分析結果
應用替加環素前住院天數大于20 d的患者,臨床治愈組(4/13,30.8 %)顯著低于臨床無效組(10/13,76.9 %),P=0.047;WBC>10×109/L的患者,臨床治愈組(4/13,30.8 %)顯著低于臨床無效組(10/13例,76.9 %),χ2=5.571,P=0.047;APACHEⅡ評分>20分的患者,臨床治愈組(2/13,15.4 %)顯著低于臨床無效組(9/13,69.2 %),χ2=7.721,P=0.015。年齡、性別、合并癥、體溫、血壓、分泌物情況、CPIS評分、血清肝酐(Cr)、白蛋白(ALB)、氧合指數、應用替加環素前應用抗菌藥物大于7 d的患者比例以及替加環素聯合用藥情況兩組差異無統計學意義,見表2。
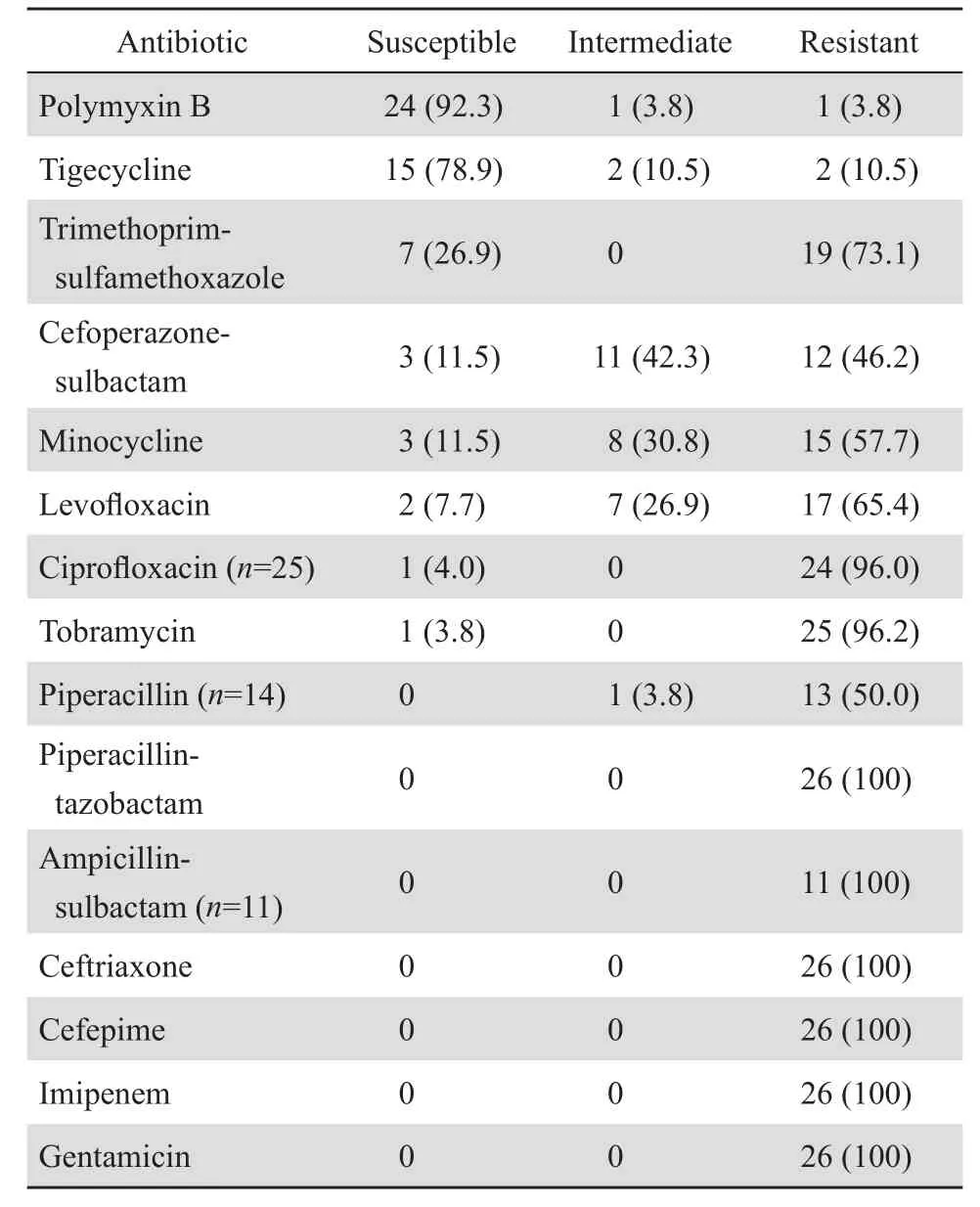
表1 26株鮑曼不動桿菌藥敏結果Table 1 Susceptibility of carbapenem-resistant Acinetobacter baumannii isolates to antimicrobial agents (n=26)[n(%)]
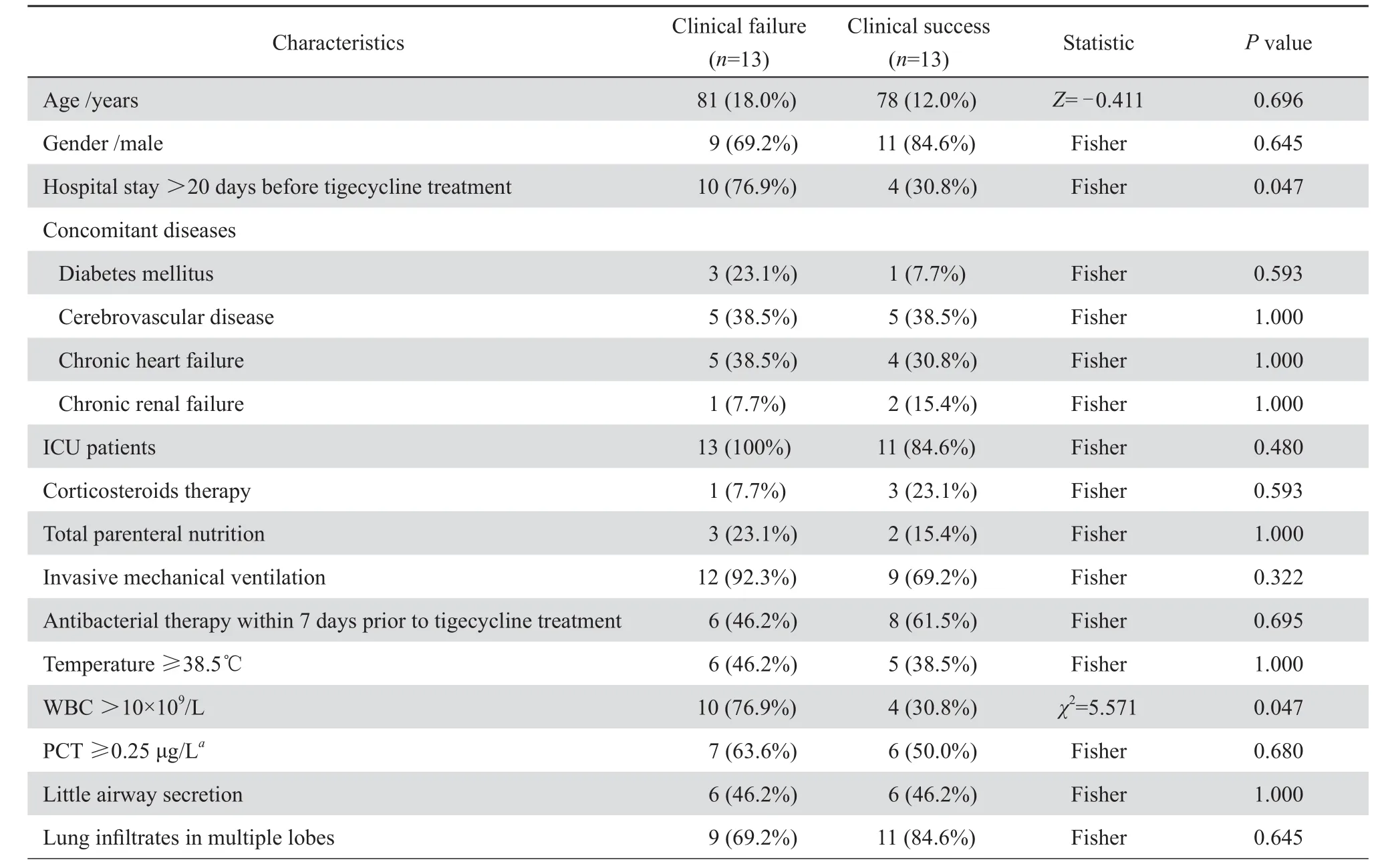
表2 臨床治愈組和無效組的基本資料Table 2 Clinical characteristics of the 26 patients in clinical success and failure groups
2.4臨床療效的多因素分析
對前述變量進行多因素Logistic回歸分析,結果表明WBC>10×109/L和APACHEⅡ評分>20分是替加環素治療失敗的獨立影響因素,見表3。
2.5治療情況分析
2.5.1治療方案 圖1顯示13例臨床治愈患者中,替加環素聯合舒巴坦制劑(頭孢哌酮-舒巴坦或哌拉西林-舒巴坦)、碳青霉烯類(亞胺培南-西司他丁或美羅培南)及甲氧芐啶-磺胺甲唑的比例。其中替加環素聯合舒巴坦制劑3例,聯合碳青霉烯類(亞胺培南-西司他丁或美羅培南)2例,聯合碳青霉烯類(亞胺培南-西司他丁或美羅培南)及含舒巴坦制劑4例,聯合舒巴坦制劑、甲氧芐啶-磺胺甲唑1例,聯合含舒巴坦制劑、碳青霉烯類(亞胺培南-西司他丁或美羅培南)、甲氧芐啶-磺胺甲唑2例。1例患者單用替加環素治療。13例臨床治療無效患者中,除替加環素外,還應用含舒巴坦制劑及碳青霉烯類(亞胺培南-西司他丁或美羅培南)。其中,10例為含舒巴坦制劑聯合替加環素,3例為碳青霉烯類藥物(亞胺培南-西司他丁或美羅培南)和含舒巴坦制劑聯合替加環素。兩組治療方案上差異無統計學意義,P=0.249。
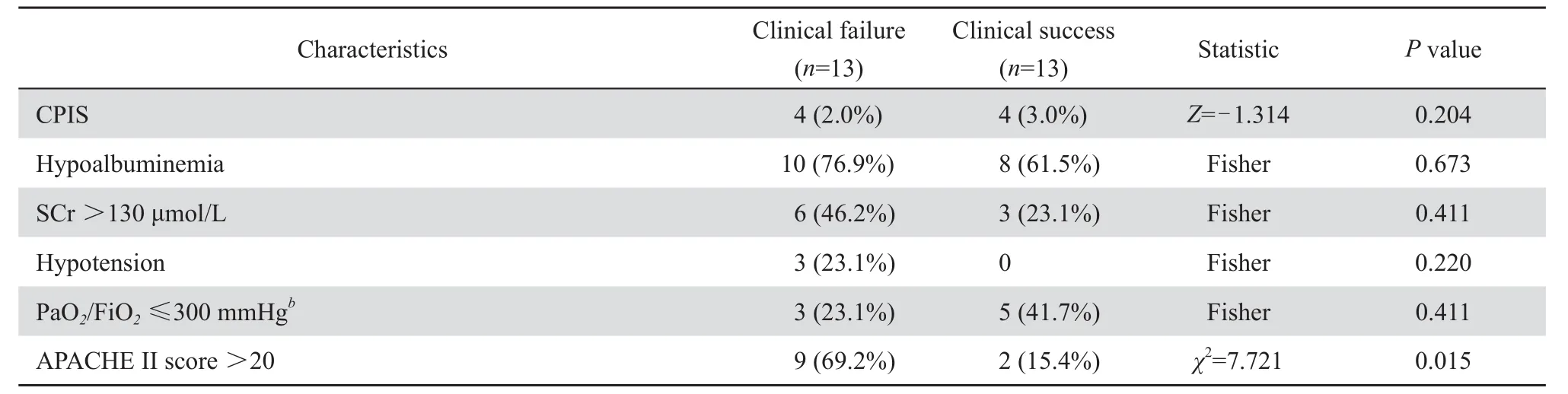
表2 (續)Table 2(continued)
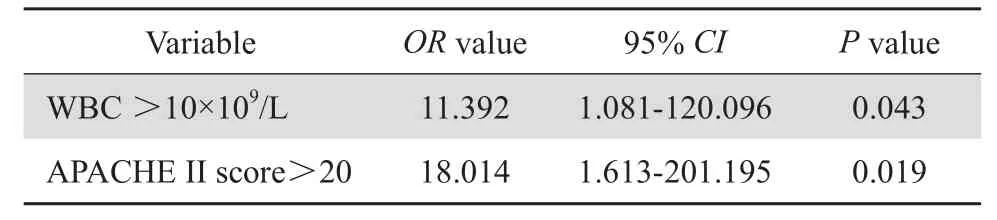
表3 26例替加環素治療療效的Logistic回歸分析Table 3 Multivariate analysis of the predictors for tigecycline treatment in 26 patients
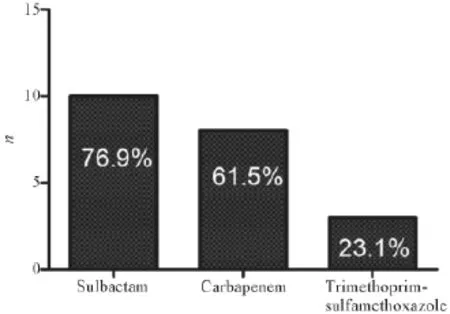
圖1 13例臨床治愈患者替加環素聯合其他抗菌藥物
2.5.2療程 臨床治愈組替加環素療程為(15.8± 5.5)d,9例患者應用替加環素療程≥2周。體溫恢復正常,所用天數中位數為3.5 d。臨床無效組替加環素療程為(7.9±3.2)d,1例患者應用替加環素療程≥2周。臨床治愈組療程顯著長于臨床無效組,t =-3.605,P<0.001。
2.5.3細菌學療效 臨床治愈組病原菌清除3例,假定清除3例,未清除7例。臨床無效組病原菌未清除6例,假定未清除7例。
3 討論
由于嚴峻的耐藥問題[4],CRAB醫院獲得性肺炎日益成為抗感染治療難題。本研究顯示替加環素治療CRAB成功率為50 %,復習文獻發現,對于重癥感染患者(非特定感染病原體),替加環素臨床治愈率比本研究高,為60 %~79.6 %[5-6]。對于患有多重耐藥或廣泛耐藥鮑曼不動桿菌肺炎的患者而言,治愈率50 %~60 %[7-8],與本研究結果接近。從上述數據看,替加環素治療效果與數據調查年代有關,調查開始時間最早的研究,其替加環素臨床治愈率最高,本研究調查時間結束晚,臨床治愈率低,考慮可能與鮑曼不動桿菌耐藥程度日益嚴重有關。
本研究還發現,其他影響替加環素臨床療效的因素有:應用替加環素前住院天數大于20 d的患者臨床治愈率明顯較低(30.8 % 對76.9 %),考慮原因與隨著住院時間的延長,耐藥鮑曼不動桿菌的暴露時間長、替加環素應用前抗菌藥物應用時間長有關,FALAGAS等[9]研究發現,應用替加環素前應用抗菌藥物是死亡的獨立預測因子。本研究多因素Logistic分析結果顯示,WBC>10× 109/L,APACHEⅡ評分>20分是替加環素治療CRAB醫院獲得性肺炎失敗的獨立預示因子。在感染性疾病中,WBC的升高與細菌感染相關。考慮對于鮑曼不動桿菌醫院獲得性肺炎而言,WBC升高的患者感染程度重,導致治療困難,影響替加環素的療效。APACHEⅡ評分是目前公認的危重患者臨床預后的評估指標。既往多項臨床研究均提示,病情危重程度影響替加環素的療效和患者預后[5,7,9]。因此,對于CRAB醫院獲得性肺炎患者盡早使用替加環素治療可以改善預后,在病程延長、病情加重后再使用則治療效果差。
對于耐藥菌感染,臨床常選擇聯合治療。藥敏結果顯示,CRAB對多黏菌素敏感率極高,動物實驗結果也顯示替加環素聯合多黏菌素治療多重耐藥鮑曼不動桿菌肺炎,組織內細菌數下降程度明顯高于單用替加環素[10]。雖然多黏菌素聯合替加環素在臨床上可能對多重耐藥鮑曼不動桿菌有較好的治療效果,但其腎臟和神經毒性限制其應用。本研究顯示,頭孢哌酮-舒巴坦敏感率雖然較低,但中介的比率仍相對較高,占42.3 %,含舒巴坦制劑常被選擇為聯合用藥。本研究中,替加環素治療成功的13例患者中,92.3 %為依據藥敏或經驗性選擇替加環素聯合其他抗感染藥物治療。30.8 %應用碳青霉烯類(亞胺培南-西司他丁或美羅培南)及含舒巴坦制劑聯合替加環素三聯抗感染,15.4 %應用含舒巴坦制劑、碳青霉烯類(亞胺培南-西司他丁或美羅培南)、甲氧芐啶-磺胺甲唑聯合替加環素四聯抗感染。對于治療困難的多重耐藥菌感染,聯合治療應能提高抗感染的成功率。
關于替加環素的應用。2012年國際嚴重膿毒癥和感染性休克診治指南[11]和2013年我國呼吸機相關性肺炎診斷、預防和治療指南[12]均推薦抗感染療程7~10 d,但對于起始治療反應慢、多重耐藥菌感染者應延長療程至10~14 d,甚至更長。我國鮑曼不動桿菌感染診治與防控專家共識對鮑曼不動桿菌肺炎的療程未給出明確建議,有學者推薦療程不少于2周[2]。本研究臨床治愈組患者替加環素療程為(15.8±5.5) d,69.2 %(9/13)臨床治愈患者應用替加環素療程至少2周。故考慮替加環素治療CRAB醫院獲得性肺炎的療程應在2周左右,根據患者個體對治療反應的快慢情況適當調整。本研究替加環素治療劑量全部采用標準替加環素治療劑量(50 mg每12小時1次,首劑加倍)。一項63例替加環素治療耐藥革蘭陰性桿菌(以耐碳青霉烯的肺炎克雷伯菌及鮑曼不動桿菌為主)所致呼吸機相關性肺炎的回顧性研究顯示,高劑量替加環素治療是臨床治愈的獨立預測因素[13]。研究表明在25 mg每12小時1次至100mg每12小時1次給藥范圍內,替加環素具有線性藥動學的特點,隨著劑量的增加濃度時間曲線下面積亦隨之增加[14],對于治療困難的CRAB而言,在不增加不良反應的同時,增加劑量可能會提高療效。本研究未涉及替加環素的不良反應,復習文獻顯示隨著劑量的增加,并沒有引起不良反應顯著增加[8-9,15]。
總之,替加環素對于CARB醫院獲得性肺炎具有治療價值,臨床治愈率為50.0 %,且安全性好,但需與其他抗菌藥物聯合使用。另外,病情嚴重程度對其療效具有顯著影響作用,APACHEⅡ評分>20分、血白細胞>10×109/L是治療無效的獨立危險因素。
[1] American Thoracic Society.Infectious Diseases Society of America. Guidelines for the management of adults with hospital—acquired, ventilator-associated, and healthcareassociated pneumonia[J]. Am J Respir Crit Care Med,2005,171(4):388-416.
[2] 陳佰義, 何禮賢, 胡必杰, 等. 中國鮑曼不動桿菌感染診治與防控專家共識[J]. 中國醫學雜志,2012,92(2):76-85.
[3] 《抗菌藥物臨床試驗技術指導原則》寫作組. 抗菌藥物臨床試驗技術指導原則[J].中國臨床藥理學雜志,2014,30(9):844-856.
[4] 胡付品,朱德妹,汪復,等. 2013年中國CHINET細菌耐藥性監測[J].中國感染與化療雜志,2014,14(5):365-374.
[5] MONTRAVERS P, DUPONT H, BEDOS JP, et al. Tigecycline use in critically ill patients:a multicentre prospective observational studyin the intensive care setting[J]. Int Care Med,2014,40(7):988-997.
[6] BASSETTI M, ECKMANN C, BODMANN KF, et al. Prescription behaviours for tigecycline in real-life clinical practicefrom fi ve European observational studies[J]. J Antimicrob Chemother,2013,68(Suppl 2):ii5-ii14.
[7] YE JJ, LIN HS, KUO AJ, et al. The clinical implication and prognostic predictors of tigecycline treatment for pneumonia involving multidrug-resistant Acinetobacter baumannii[J]. J Infect,2011,63(5):351-361.
[8] 譚建龍,張衛東,柳威,等. 替加環素治療多或泛耐藥鮑曼不動桿菌肺炎的療效觀察[J].中國呼吸與危重監護雜志,2013,12(6):581-585.
[9] FALAGAS ME, VARDAKAS KZ, TSIVERIOTIS KP, et al. Effectiveness and safety of high-dose tigecycline-containing regimens for the treatment of severe bacterial infections[J]. Int J Antimicrob Agents,2014,44(1):1-7.
[10] MUTLU YILMAZ E, SUNBUL M, AKSOY A, et al. Effi cacy of tigecycline/colistin combination in a pneumonia model caused by extensively drug-resistant Acinetobacter baumannii[J]. Int J Antimicrob Agents,2012,40(4):332-336.
[11] DELLINGER RP, LEVY MM, RHODES A, et al. Surviving Sepsis Campaign:international guidelines for management ofsevere sepsis and septic shock, 2012[J]. Int Care Med,2013,39(2):165-228.
[12] 中華醫學會重癥醫學分會. 呼吸機相關性肺炎診斷、預防和治療指南(2013)[J]. 中華內科雜志,2013,52(6):524-543.
[13] DE PASCALE G, MONTINI L, PENNISI M, et al. High dose tigecycline in critically ill patients with severe infections due to multidrug-resistant bacteria[J]. Crit Care,2014,18(3):R90.
[14] MURALIDHARAN G, MICALIZZI M, SPETH J, et al. Pharmacokinetics of tigecycline after single and multiple doses in healthy subjects[J]. Antimicrob Agents Chemother,2005,49(1):220-229.
[15] RAMIREZ J, DARTOIS N, GANDJINI H, et al. Randomized phase 2 trial to evaluate the clinical effi cacy of two high-dosage tigecyclineregimens versus imipenem–cilastatin for treatment of hospital-acquired pneumonia[J]. Antimicrob Agents Chemother,2013,57(4):1756-1762.
Efficacy of tigecycline in pneumonia caused by carbapenem-resistant Acinetobacter baumannii
SUN Lina, ZHOU Qingtao, SHEN Ning, HE Bei. (Department of Respiratory Medicine, Peking University Third Hospital, Beijing 100191, China)
Objective To investigate the efficacy of tigecycline in pneumonia caused by carbapenem-resistant Acinetobacter baumannii and the infl uencing factors. Methods A retrospective study was carried out in Peking University Third Hospital. The hospitalized patients with pneumonia caused by carbapenem-resistant A. baumannii were consecutively recruited between August 2012 and September 2014. All patients9/L (OR=11.392, P<0.05) were the independent predictors for clinical failure of tigecycline treatment. Conclusions Tigecycline has therapeutic value for pneumonia caused by carbapenem-resistant A. baumannii. The effi cacy of tigecycline treatment is signifi cantly infl uenced by the severity of disease.
tigecycline treatment. The treatment response was rated as success or failure. Results Twenty-six patients were included. Clinical success was observed in 13 patients while clinical failure was found in the other 13 patients. In the clinical success group, tigecycline was combined with other antibacterial agents containing sulbactam, carbapenem and trimethoprim-sulfamethoxazole in 92.3 % of the patients. Fewer patients stayed in hospital more than 20 days before tigecycline treatment in the clinical success group than in the clinical failure group (76.9 %, 10/13 and 30.8 %, 4/13, P=0.047). Multivariate logistic regression analysis indicated that APACHE II score >20 (OR=18.014, P<0.05) and white blood cell >10×10
tigecycline; pneumonia; Acinetobacter baumannii
R563.1;R378
A
1009-7708(2016)06-0716-06
10.16718/j.1009-7708.2016.06.006
首都醫學發展科研基金(2009-2025)。
北京大學第三醫院呼吸科,北京 100191。
孫麗娜(1982—),女,博士,主治醫師,主要從事慢性阻塞性肺疾病與肺部感染研究。
周慶濤,E-mail: qtzhou75@163.com。
2015-09-28
2016-05-10

