維拉帕米逆轉乳頭狀甲狀腺癌對多柔比星抗性中的L-Ca2+/calpain信號轉導機制*
汪軍兵, 丁向東, 鄭媛媛, 梁瑩瑩, 王 浩, 李光明, 江明亮, 董 軍△
(1廣州市番禺區中心醫院,廣東 廣州 511400; 2廣州金域醫學檢驗中心有限公司,廣東 廣州 510330; 3暨南大學醫學院,廣東 廣州 510632)
?
維拉帕米逆轉乳頭狀甲狀腺癌對多柔比星抗性中的L-Ca2+/calpain信號轉導機制*
汪軍兵1, 2▲, 丁向東2▲, 鄭媛媛3, 梁瑩瑩1, 王 浩1, 李光明3, 江明亮3, 董 軍3△
(1廣州市番禺區中心醫院,廣東 廣州 511400;2廣州金域醫學檢驗中心有限公司,廣東 廣州 510330;3暨南大學醫學院,廣東 廣州 510632)
目的: 探討維拉帕米逆轉乳頭狀甲狀腺癌對多柔比星抗性的L型鈣離子通道/鈣蛋白酶(L-Ca2+/calpain)信號轉導通路機制。方法: 以培養2 d的人乳頭狀甲狀腺癌TPC-1細胞為實驗對象,首先以CCK-8分析法測定細胞存活率對維拉帕米和多柔比星進行配伍試驗,確定合適的藥物作用濃度及時間。然后將細胞分為空白對照組、多柔比星組、維拉帕米組和多柔比星+維拉帕米組。以全細胞膜片鉗技術記錄TPC-1細胞的L-Ca2+通道電流,以Western blot法測定蛋白calpain 1及LC3的表達水平。結果: 多柔比星組、維拉帕米組與空白對照組相比,L-Ca2+通道電流密度減小(P<0.05);多柔比星+維拉帕米組與多柔比星組相比,L-Ca2+通道電流密度減小(P<0.01)。多柔比星組、維拉帕米組與空白對照組相比,calpain 1蛋白表達減弱(P<0.05);多柔比星+維拉帕米組與多柔比星組相比,calpain 1蛋白表達減弱(P<0.05)。多柔比星組和維拉帕米組與空白對照組相比,LC3蛋白表達增強(P<0.05);多柔比星+維拉帕米組與多柔比星組相比,LC3蛋白表達增強(P<0.01)。結論: TPC-1細胞抗多柔比星可能與其自噬活性增強有關;維拉帕米能進一步增強細胞自噬活性,致自噬性細胞死亡,從而對抗TPC-1細胞對多柔比星的抗性,其機制可能與自噬的L-Ca2+/calpain 1信號轉導通路有關。
自噬; 抗性; L型鈣離子通道; 鈣蛋白酶; 乳頭狀甲狀腺癌
全世界范圍內,甲狀腺癌在過去的幾十年間呈持續增長態勢,乳頭狀甲狀腺癌(papillary thyroid carcinoma,PTC)是最常見的甲狀腺惡性腫瘤,占甲狀腺惡性腫瘤的85%~90%[1]。PTC生物學行為表現為易轉移、易復發,約有20%~50%的PTC患者早期即發生頸部淋巴結轉移,14%的PTC患者復發[2]。對于進展型PTC轉移及復發的患者,目前手術及放療難以根治,因此找到一個好的根治方法的任務就顯得尤為迫切。
進展型PTC通常在放療后使用多柔比星進行化療,不幸的是,PTC對多柔比星的化療高度抵抗[3-4]。文獻顯示PTC對多柔比星抗性的產生與PTC自噬保護作用有關,自噬過度激活所致的自噬性死亡可能是PTC治療的一個有效途徑[5]。
細胞有多條自噬通路,L型鈣離子通道(L-type calcium channel, L-Ca2+)/鈣蛋白酶(calpain)通路是其中一條重要途徑,它對自噬起負調節作用[6]。維拉帕米是臨床常用的L型Ca2+通道阻斷劑,具有降血壓的作用。有文獻報道,維拉帕米可增強自噬活性[7-8]。我們猜想能否通過使用維拉帕米來進一步增強多柔比星作用的PTC細胞的自噬活性,使PTC出現自噬性死亡,從而消除PTC對多柔比星的抗性,提高PTC患者的治愈率。為驗證此假設,本實驗以人PTC細胞株TPC-1為研究對象,探討PTC對多柔比星產生抗性的通路機制,并探討維拉帕米是否能逆轉這種抗性及其機制,為PTC術后化療中多柔比星與維拉帕米聯合應用提供理論依據。
材 料 和 方 法
1 主要試劑
多柔比星及維拉帕米購自Sigma;血清購自四季青生物有限公司;胰酶購自Gibco;RPMI-1640培養液購自HyClone;抗LC3、calpain 1及GAPDH抗體購自Abcam;TPC-1細胞購自廣州吉妮歐生物科技有限公司。膜片鉗電極外液組成(mmol/L): NaCl 120, CsCl 5, TEA-Cl 10, BaCl210, HEPES 10, MgCl21, TTX 0.0005;膜片鉗電極內液組成(mmol/L):CsCl 120, MgCl22, Na2ATP 5, HEPES 10, Glucose 11, EGTA 11。
2 方法
2.1 細胞培養和實驗分組 TPC-1細胞生長于RPMI-1640 細胞培養液中,介質中加入10%胎牛血清和1%青、鏈霉素,用細胞培養瓶及細胞培養板培養。培養細胞置于37 ℃、5% CO2培養箱中,每天換液1次,待單層培養細胞生長匯合以后,用0.25%胰蛋白酶消化,傳代培養。傳代培養后,在倒置顯微鏡下觀察,當細胞即將匯合時開始加藥。本實驗分為空白對照組、多柔比星組、維拉帕米組和多柔比星+維拉帕米組。
2.2 CCK-8法測定TPC-1細胞存活率 取對數生長期細胞, 經胰酶消化分散記數后, 稀釋到4×108/L,接種于96孔培養板中, 每孔180 μL。培養至單層細胞即將匯合時加藥。各孔終體積為200 μL,體積不足者以相應培養基補足。每一組設6個平行孔,根據實驗需要加不同濃度藥物并培養不同時間后 , 棄去培養液; 每孔加入CCK-8試劑(臨用前以PBS 配成0.5 g/L)100 μL , 培養箱內繼續培養,足夠實驗時間后,于30 min內在Bio-Rad 3350型酶標儀上讀取490 nm處的吸光度(A)值。不加藥只含CCK-8試劑孔細胞的吸光度值減去空白孔的吸光度值作為基本對照 , 實驗孔吸光度值減去空白孔吸光度值與之相比得到各自的細胞存活率。公式為:
細胞存活率(%)=(實驗孔A值-空白孔A值)/(只含CCK-8對照孔A值-空白孔A值)×100%。
2.3 全細胞膜片鉗記錄TPC-1細胞的L型鈣離子通道電流 玻璃毛坯經P97微電極拉制儀經3步法拉制成尖端直徑為2~3 μm的電極,沖灌電極內液。換上電極外液,將皿置于倒置顯微鏡載物臺上,20倍物鏡找到胞體光亮飽滿的TPC-1細胞,安裝好沖灌玻璃微電極并在電壓鉗模式下用微操縱器引導玻璃微電極靠近細胞。將微電極尖端調整至胞體正上方,然后在持續正壓的同時讓電極尖端緩慢靠近細胞,待電極尖端接觸細胞表面時,輕輕給予電極內負壓,形成高阻封接(1 GΩ),此時形成貼附式膜片,正確補償電容,再給予負壓吸破電極尖端的細胞膜,補償電容電流和串聯電阻,形成全細胞膜片鉗,穩定3~5 min進行記錄。電流信號經Ag/AgCl電極引導,數據經Digtal 1320A轉換器記錄。記錄時,將高阻封接的細胞電位鉗制在-50 mV持續300 ms,階躍10 mV的10個去極化電壓鉗制記錄L型Ca2﹢通道電流-電壓曲線。實驗中鉗制電壓和電路電阻隨時被檢測,只有基線、鉗制電壓和電路電阻穩定的數據才被納入分析數據。
2.4 Western blot法測定calpain 1及LC3的蛋白表達 收集總蛋白,按說明書步驟提取總蛋白,用BCA法蛋白定量,蛋白樣品上樣進行SDS-PAGE后轉移至PVDF膜上,5%脫脂奶粉室溫封閉1 h,TBST洗膜后,分別加入抗 calpain 1、LC3和GAPDH抗體,抗體用含5%BSA稀釋,相應濃度均為1∶1 000,4 ℃孵育過夜。TBST洗膜后,加入HRP標記的II抗,37 ℃孵育1 h。TBST洗膜后,ECL發光試劑檢測蛋白印跡條帶,光密度掃描膠片,Image-Pro Plus 6.0軟件分析結果。以LC3-Ⅱ的灰度值與內參照GAPDH灰度值的比值來表示蛋白LC3的表達活性。
3 統計學處理
用SPSS 16.0統計軟件進行分析。數據均采用均數±標準差(mean±SD)表示,組間均數比較采用完全隨機設計單因素方差分析(one-way ANOVA),以P<0.05為差異有統計學意義。
結 果
1 CCK-8法測定TPC-1細胞的細胞存活率
1.1 進行藥物配伍實驗,確定藥物的合適實驗濃度及時間 以CCK-8測定TPC-1細胞的存活率,使用96孔板,每組設6個平行孔,對應孔取平均值。首先以不同濃度(0.25 μmol/L、0.5 μmol/L、0.75 μmol/L、1 μmol/L、2 μmol/L)的多柔比星分別作用于TPC-1細胞不同時間(2 h、6 h、12 h、24 h)。發現與對照組相比,低濃度短時間的多柔比星對TPC-1細胞的存活率無多大影響,隨著藥物作用時間延長和藥物濃度加大,細胞存活率逐漸下降,在2 h、6 h、12 h、24 h這4個時點均出現細胞存活率先減弱后增強現象,對應2 h、6 h、12 h的細胞存活率最低點的多柔比星的濃度分別為1 μmol/L、0.75 μmol/L、0.5 μmol/L。前述實驗說明TPC-1細胞對多柔比星具有抗性。然后,我們以不同濃度(1 μmol/L、2 μmol/L、3 μmol/L、7 μmol/L、8 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L)的維拉帕米作用于TPC-1細胞24 h,發現TPC-1細胞的細胞存活率從3 μmol/L開始下降,濃度越高下降幅度越大,這說明高濃度的維拉帕米對細胞有損害作用。綜合前面的實驗結果,我們選定藥物作用時間為24 h,多柔比星的作用濃度為1 μmol/L,維拉帕米的作用濃度為3 μmol/L。
1.2 觀察維拉帕米能否逆轉TPC-1細胞對多柔比星的抗性 作用時間與藥物濃度同上,實驗分為空白對照組、多柔比星組、維拉帕米組和多柔比星組+維拉帕米組。各組的細胞存活率分別為(100.0±0.0)%、(89.1±4.7)%、(99.0±5.2)%和(52.3±2.6)%。多柔比星+維拉帕米組與多柔比星組相比較,差異有統計學顯著性(P<0.05)。這說明維拉帕米能有效對抗TPC-1細胞對多柔比星的抗性,見圖1。

Figure 1.The viability of the TPC-1 cells in different groups at 24 h. Mean±SD.n=6.*P<0.05vsdoxorubicin group.
圖1 24 h后不同分組TPC-1細胞存活率的變化
2 維拉帕米對加入多柔比星后TPC-1細胞L型鈣離子通道電流峰值的影響
由電壓步階產生的內向L型鈣離子通道電流在加藥24 h后被記錄,從-50 mV~+40 mV的電壓步階產生的L型Ca2+通道電流在空白對照組、多柔比星組、維拉帕米組和多柔比星+維拉帕米組經膜電容標化后峰值電流密度(pA/pF)分別為-20.76±0.98、-15.18±0.74、-4.58±0.22和-3.61±0.17;多柔比星組與空白對照組比較,差異有統計學顯著性(P<0.05),說明多柔比星可使TPC-1細胞的L型鈣離子通道電流減弱;維拉帕米組與空白對照組相比較,差異有統計學顯著性(P<0.01),說明維拉帕米可有效地阻斷TPC-1細胞的L型鈣離子通道電流;多柔比星+維拉帕米組與多柔比星組相比較,差異有統計學顯著性(P<0.01),說明維拉帕米可有效地阻斷受多柔比星作用的TPC-1細胞的L型鈣離子通道電流,見圖2。
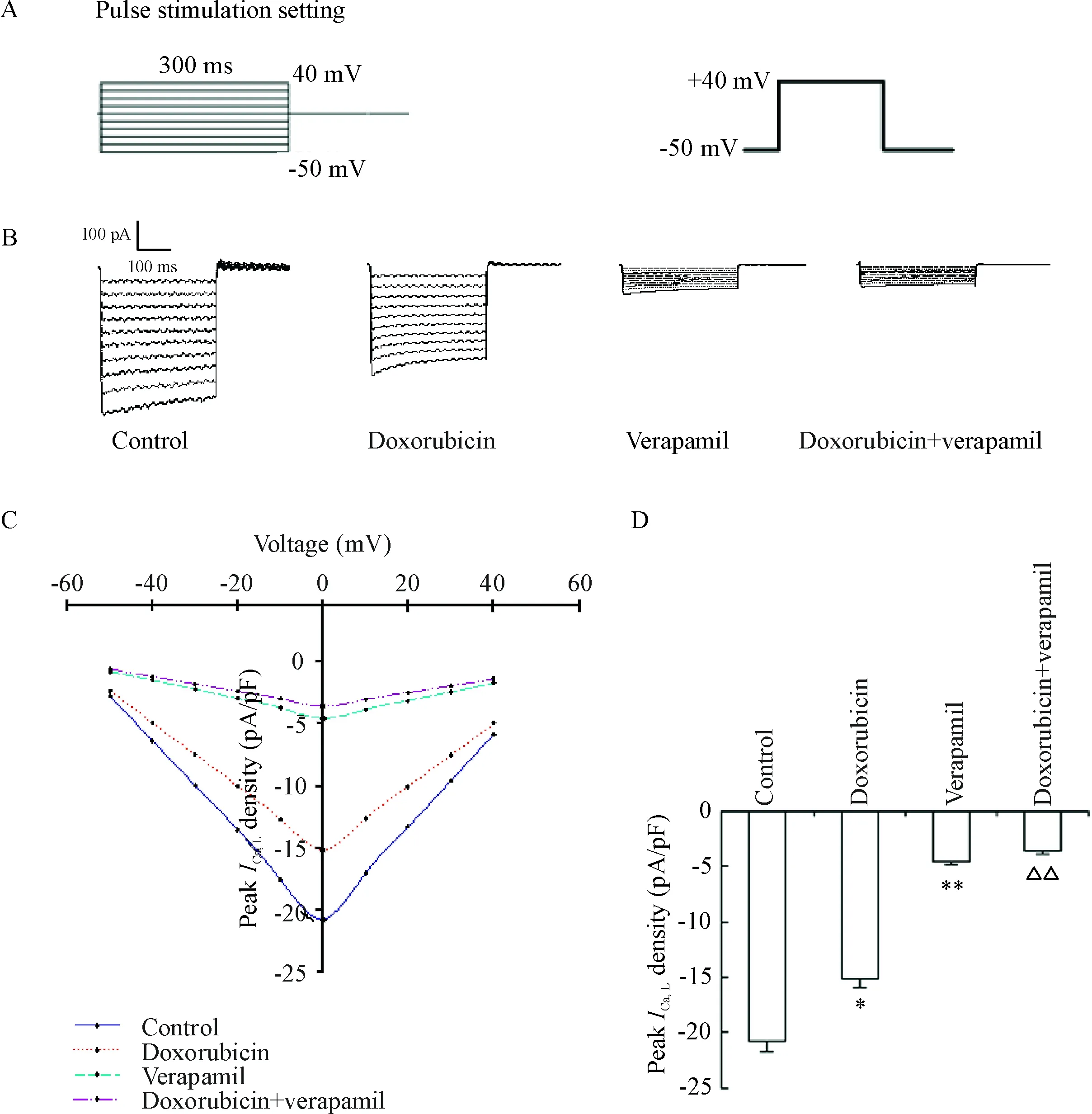
Figure 2.The effect of verapamil on peak L-type calcium channel current (ICa, L) in TPC-1 cells treated with doxorubicin. A: voltage steps of L-type calcium channel; B: average peak current amplitude in different groups; C: I-V curves of peak current density in different groups; D: the quantitative analysis of peak current density in different groups. Mean±SD.n=8.*P<0.05,**P<0.01vscontrol group;△△P<0.01vsdoxorubicin group.
圖2 維拉帕米對加入多柔比星后TPC-1細胞L型鈣離子通道電流峰值的影響
3 不同分組中TPC-1細胞calpain 1蛋白表達的Western blot實驗分析
與空白對照組相比較,多柔比星組calpain 1的蛋白表達減弱(P<0.05),維拉帕米組calpain 1的蛋白表達減弱(P<0.05);與多柔比星組相比較,多柔比星+維拉帕米組calpain 1的蛋白表達減弱(P<0.05),見圖3。
4 不同分組中TPC-1細胞LC3蛋白表達活性的Western blot實驗分析
與空白對照組相比較,多柔比星組LC3的蛋白表達活性增強(P<0.05),維拉帕米組LC3的蛋白表達增強(P<0.05);與多柔比星組相比較,多柔比星+維拉帕米組LC3的蛋白表達增強(P<0.01),見圖4。
討 論
自噬,又稱Ⅱ型程序性細胞死亡,是細胞內某些胞質成分通過一系列嚴格調控的途徑,最后被溶酶體內蛋白酶降解,釋放出大分子物質再循環的過程。自噬具有雙重功能:當自噬在對不同形式的細胞應激作出反應時自噬可被快速上調,這種快速的自噬誘導可以通過清除細胞內受損的細胞器及毒性代謝分子,并通過產生維持細胞重要功能所必需的細胞內構件的方式以利于細胞的生存[9],但自噬的持續過度性激活也可導致細胞最終發生自噬性細胞死亡[10]。

Figure 3.Western blot analysis of calpain 1 protein expression in the TPC-1 cells with different treatments after 24 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsdoxorubicin group.
圖3 24 h后不同分組中TPC-1細胞calpain 1蛋白表達的Western blot實驗分析
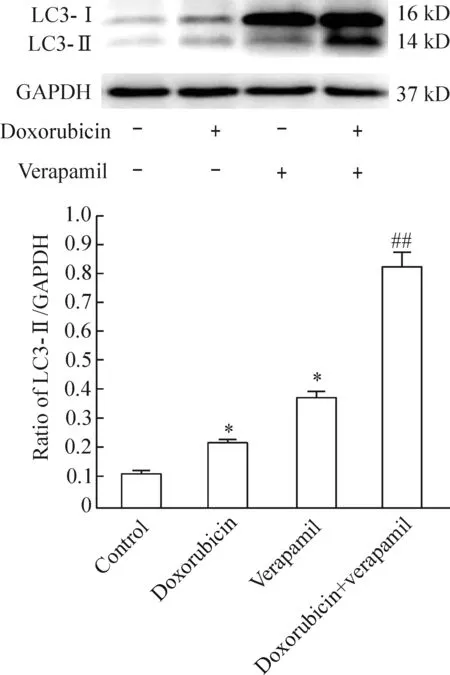
Figure 4.Western blot analysis of autophagy-related protein LC3 expression in the TPC-1 cells with different treatments after 24 h. Mean±SD.n=3.*P<0.05vscontrol group;##P<0.01vsdoxorubicin group.
圖4 24 h后不同分組中TPC-1細胞自噬相關蛋白LC3表達活性的Western blot實驗分析
自噬的信號轉導通路包括哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)及非mTOR信號轉導通路[9],后者主要指L-Ca2+/calpain信號轉導通路。Calpain是L型鈣依賴性的半胱氨酸蛋白酶,又可分為μ-calpain和m-calpain,二者均由1個80 kD左右的大片段及1個28 kD的小片段組成,對應的80 kD大片段分別稱為calpain 1和calpain 2,μ-calpain是L-Ca2+/calpain信號轉導通路中起作用的主要蛋白酶[11]。Calpain可以特異性水解多種酶及蛋白。作為非mTOR依賴信號通路的主要調節因子,calpain可結合由細胞膜L型鈣離子通道進入的及三磷酸肌醇(inositol 1,4,5-trisphosphate,IP3)誘導內質網內釋放的Ca2+,進而通過刺激型G蛋白的α亞單位(Gsα)通路激活環磷酸腺苷而抑制自噬[12];故L-Ca2+/calpain信號轉導通路對自噬起負調節作用。
自噬相關蛋白LC3是哺乳動物細胞中酵母自噬蛋白ATG8的同源物,定位于前自噬泡和自噬泡膜表面,是細胞自噬泡膜的通用標志物[13]。細胞中新合成的LC3蛋白經過加工,成為胞漿可溶性LC3-I,后者經泛素樣加工修飾過程,與自噬泡膜表面的磷脂酰乙醇胺結合,稱為LC3-II。LC3-II含量的多少在某種程度上反映了細胞的自噬活性。
本實驗通過CCK-8實驗測定TPC-1細胞的存活率,發現TPC-1細胞對多柔比星的抗性與藥物濃度及藥物作用時間有關, 與文獻報道的相一致[14-15]。同時,也發現當TPC-1細胞對多柔比星耐受時,加入不對細胞造成損害濃度的維拉帕米后導致TPC-1細胞的存活率降低,即能有效地對抗TPC-1細胞對多柔比星的抗性。
本實驗發現多柔比星組與空白對照組相比,TPC-1細胞的L型鈣離子通道電流減弱,calpain 1的蛋白表達亦減弱,而LC3的自噬活性增強,結合CCK-8實驗中TPC-1細胞對多柔比星耐受這個結果,可以認為TPC-1細胞對多柔比星的抗性與其自噬活性增強有關,且可能有L-Ca2+/calpain信號轉導通路的參與。同時,我們推測當TPC-1細胞處在多柔比星這種毒性藥物的作用下,細胞受損,但經過一段時間的適應,TPC-1細胞通過自噬活性的增強來保護自己,維持生存,從而產生了對多柔比星的抗性。
有文獻報道維拉帕米本身就有增強自噬的作用[7-8]。本實驗中,維拉帕米與空白對照組相比,TPC-1細胞的L型鈣離子通道電流大幅降低,calpain 1的蛋白表達減弱,而LC3的蛋白表達增強,結合CCK-8實驗中TPC-1細胞的存活率未見明顯下降這個結果,可以得出維拉帕米可增強自噬,且可能有L-Ca2+/calpain 1信號轉導通路參與的結論。這種自噬的增強未對細胞造成明顯損害。
另外,多柔比星+維拉帕米組與多柔比星組相比, TPC-1細胞的L型鈣離子通道電流大幅降低,calpain 1的蛋白表達減弱,而LC3的自噬活性增強,結合CCK-8實驗中TPC-1細胞存活率明顯降低這個結果,可以得出結論,維拉帕米對抗TPC-1細胞對多柔比星的抗性與自噬的進一步增強有關,可能有L-Ca2+/calpain 1信號轉導通路的參與。我們推測,由于多柔比星與維拉帕米均能通過L-Ca2+/calpain 1信號轉導通路增強自噬,導致自噬活性過度增強,TPC-1細胞出現了自噬性死亡,故細胞存活率明顯下降。
本實驗不但找到了TPC-1細胞對多柔比星產生抗性的原因及機制,還發現了維拉帕米對抗這種抗性的原因及機制。另外,本實驗組還收集了PTC患者切下的大體標本,與周圍正常組織比較,發現了蛋白LC3及calpain 1表達的變化,不過將另文發表。這些結論可為PTC術后化療多柔比星與維拉帕米聯合應用提供理論依據。
[1] Kondo T, Ezzat S, Asa SL. Pathogenetic mechanisms in thyroid follicular-cell neoplasia[J]. Nat Rev Cancer, 2006, 6(4):292-306.
[2] Cooper DS, Doherty GM, Haugen BR, et al. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2006, 16(2):109-142.
[3] Matuszczyk A, Petersenn S, Bockisch A, et al. Chemotherapy with doxorubicin in progressive medullary and thyroid carcinoma of the follicular epithelium[J]. Horm Metab Res, 2008, 40(3):210-213.
[4] 王 煥, 李小毛, 劉穗玲, 等. RAD001 通過誘導自噬提高人子宮內膜癌細胞對紫杉醇的敏感性[J]. 中國病理生理雜志, 2013, 29(11):1966-1971.
[5] Lin CI, Whang EE, Abramson MA, et al. Autophagy: a new target for advanced papillary thyroid cancer therapy[J]. Surgery, 2009, 146(6):1208-1214.
[6] Yousefi S, Perozzo R, Schmid I, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J]. Nat Cell Biol, 2006, 8(10):1124-1132.
[7] Salabei JK, Balakumaran A, Frey JC, et al. Verapamil stereoisomers induce antiproliferative effects in vascular smooth muscle cells via autophagy[J]. Toxicol Appl Pharmacol, 2012, 262(3):265-272.
[8] Park HW, Lee JH. Calcium channel blockers as potential therapeutics for obesity-associated autophagy defects and fatty liver pathologies[J]. Autophagy, 2014, 10(12):2385-2386.
[9] Levine B, Yuan J. Autophagy in cell death: an innocent convict?[J]. J Clin Invest, 2005, 115(10):2679-2688.
[10]Shi R, Weng J, Zhao L, et al. Excessive autophagy contributes to neuron death in cerebral ischemia[J]. CNS Neurosci Ther, 2012, 18(3):250-260.
[11]Goll DE, Thompson VF, Li H, et al. The calpain system[J]. Physiol Rev, 2003, 83(3):731-801.
[12]Gao X, Zhang Y, Arrazola P, et al. Tsc tumour suppressor proteins antagonize amino-acid-TOR signalling[J]. Nat Cell Biol, 2002, 4(9):699-704.
[13]Asanuma K, Tanida I, Shirato I, et al. MAP-LC3, a promising autophagosomal marker, is processed during the differentiation and recovery of podocytes from PAN nephrosis[J]. FASEB J, 2003, 17(9):1165-1167.
[14]Pan YZ, Wang X, Bai H, et al. Autophagy in drug resistance of the multiple myeloma cell line RPMI8226 to doxorubicin[J]. Genet Mol Res, 2015, 14(2):5621-5629.
[15]盧 娜, 白瑞櫻, 魏林郁, 等. 胞外高濃度ATP誘導SH-SY5Y細胞的自噬和凋亡[J]. 中國病理生理雜志, 2014, 30(8):1388-1393.
(責任編輯: 林白霜, 羅 森)
雜志網址: http://www.cjpp.net
[文章編號] 1000- 4718(2016)10- 1788- 11
Mechanism of L-Ca2+/calpain signal transduction in verapamil inversing resistance of papillary thyroid carcinoma to doxorubicin
WANG Jun-bing1, 2, DING Xiang-dong2, ZHENG Yuan-yuan3, LIANG Ying-ying1, WANG Hao1, LI Guang-ming3, JIANG Ming-liang3, DONG Jun3
(1PanyuCentralHospital,Guangzhou511400,China;2LimitedCorporationofGuangzhouJinyuMedicalExaminationCenter,Guangzhou510330,China;3SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:dongjunbox@163.com)
AIM: To investigate the mechanism of L-type calcium channel (L-Ca2+)/calpain signal transduction pathway in verapamil inversing resistance of papillary thyroid carcinoma to doxorubicin. METHODS: Human papillary thyroid carcinoma TPC-1 cells were cultured for 2 d. For determining the appropriate concentrations and treatment time of verapamil and doxorubicin, a compatibility test was conducted to detect the cell viability by CCK-8 assay. The cells were divided into control group, doxorubicin group, verapamil group and doxorubicin+verapamil group. The techniques of whole-cell patch-clamp was used to record L-Ca2+currents. The protein expression levels of calpain 1 and LC3 were detected by Western blot. RESULTS: Compared with control group, the density of L-Ca2+current decreased in doxorubicin group and verapamil group (P<0.05). Compared with verapamil group, the density of L-Ca2+current decreased in doxorubicin+verapamil group (P<0.01). Compared with control group, the expression of calpain 1 decreased in doxorubicin group and verapamil group (P<0.05). Compared with doxorubicin group, the expression of calpain 1 decreased in doxorubicin+verapamil group (P<0.05). Compared with control group, the expression of LC3 increased in doxorubicin group and verapamil group (P<0.05). Compared with doxorubicin group, the expression of LC3 increased in doxorubicin+verapamil group (P<0.01). CONCLUSION: The drug resistance of TPC-1 cells to doxorubicin may be related to the increase in autophagic activity. Verapamil further increases autophagic activity of TPC-1 cells, resulting in autophagic death and inversing the resistance of TPC-1 cells to doxorubicin. The mechanism may be involved in L-Ca2+/calpain 1 signal transduction pathway of autophagy.
Autophagy; Resistance; L-type calcium channel; Calpain; Papillary thyroid carcinoma
1000- 4718(2016)10- 1782- 06
2016- 06- 27
2016- 09- 07
國家自然科學基金資助項目(No. 81171134; No. 81471235);廣東省自然科學基金資助項目(No. 2014A030313360); 廣州市醫藥衛生科技計劃資助項目(No. 20141A011111); 廣州市番禺區科技計劃資助項目(No. 2014-203-26); 高等學校學科創新引智計劃(No. B14036)
△通訊作者 Tel: 020-85228289; E-mail: dongjunbox@163.com
▲并列第1作者
R363.1
A
10.3969/j.issn.1000- 4718.2016.10.009
雜志網址: http://www.cjpp.net

