癌基因iASPP-SV參與乳腺癌的形成
董一楠,孔凡銘,張新偉,魏 楓,孫 倩
天津醫科大學腫瘤醫院研究所免疫研究室,國家腫瘤臨床醫學研究中心,天津市“腫瘤防治”重點實驗室,天津市腫瘤免疫與生物治療重點實驗室,天津300060
癌基因iASPP-SV參與乳腺癌的形成
董一楠,孔凡銘,張新偉,魏 楓,孫 倩
天津醫科大學腫瘤醫院研究所免疫研究室,國家腫瘤臨床醫學研究中心,天津市“腫瘤防治”重點實驗室,天津市腫瘤免疫與生物治療重點實驗室,天津300060
背景與目的:p53凋亡刺激蛋白抑制劑(inhibitor of apoptosis-stimulating protein of p53,iASPP)屬于ASPP家族成員,其與p53結合,抑制p53靶基因的轉錄活性,抑制細胞凋亡,與腫瘤形成相關。先前該研究所在課題組發現了iASPP的一個新亞型iASPP剪切變異體(iASPP splice variant,iASPP-SV),其是包含407個氨基酸殘基的核蛋白,能與p53結合、抑制p53的轉錄活性,但是其與乳腺癌細胞增殖的作用還不清楚。因此,該研究旨在探討iASPP-SV在乳腺癌發生、發展中的作用。方法:用5’-基因末端快速擴增(rapid amplification of cDNA ends,RACE)方法檢測乳腺癌細胞系MCF-7的iASPP-SV mRNA的5’末端序列。將pFLAG-iASPP-SV和pFLAG-iASPP(828)分別轉染HEK 293細胞,采用蛋白[質]印跡法(Western blot)檢測HEK293細胞及8種人類腫瘤細胞iASPP-SV的表達情況。建立穩定表達FLAG-iASPP-SV和FLAG-iASPP(828)的NIH 3T3細胞系,細胞增殖分析、克隆形成實驗和軟瓊脂集落形成實驗檢測iASPP-SV、iASPP(828)是否促進細胞增殖、是否是癌基因。用實時熒光定量聚合酶鏈反應(real-time fluorescent quantitative polymerase chain reactive,RTFQ-PCR)的方法檢測原發性乳腺癌iASPP-SV和iASPP(828) mRNA表達水平,確定人乳腺癌中iASPP-SV是否上調。用熒光素酶報告基因實驗檢測iASPP-SV、iASPP(828)、p53與NF-κB/p65的關系。結果:5’-RACE方法顯示,MCF-7細胞中的iASPPSV由RAI序列(DQ986418.1)編碼。Western blot實驗顯示,多種人類腫瘤細胞系表達內源性iASPP-SV。細胞增殖分析、克隆形成實驗和軟瓊脂集落形成實驗證實iASPP-SV與iASPP(828)能促進腫瘤細胞增殖,是癌基因。RTFQ-PCR實驗顯示,p53野生型乳腺癌組織iASPP-SV表達水平的中位值比p53突變型顯著升高。熒光素酶報告基因實驗證實iASPP-SV、iASPP(828)能抑制NF-κB/p65轉錄,因此iASPP可能是雙功能蛋白。結論:iASPP-SV可能作為乳腺癌治療的有效靶點。
p53凋亡刺激蛋白抑制劑;p53凋亡刺激蛋白抑制劑剪切變異體;p53;NF-κB;乳腺癌
p53由TP53基因編碼,位于細胞核,是重要的腫瘤抑制因子,其重要的功能是通過誘導細胞凋亡,抑制腫瘤形成[1-2]。在正常情況下,p53低表達,并且與MDM2相互作用,處于失活狀態[1]。當細胞受到基因毒性或毒性應激如DNA損傷時,p53激活并且特定殘基磷酸化來保持其穩定性,抑制自我降解,p53水平上調[1,3]。p53是轉錄因子,其激活后能結合并活化具有促進細胞凋亡和細胞生長停滯作用的靶基因如p21CDKN1A和MDM2,導致細胞生長抑制或凋亡、損傷細胞自我修復或清除,阻止正常細胞惡性轉化[1,3-4]。有研究表明,p53突變或缺失與人類大多數種類的腫瘤細胞相關[1]。
p53凋亡刺激蛋白(apoptosis-stimulating protein of p53,ASPP)家族包括ASPP1、ASPP2和ASPP抑制劑(inhibitor of ASPP,iASPP)。ASPP1和ASPP2增強p53的促凋亡活性,而iASPP通過與p53結合,抑制p53靶基因的轉錄活性,抑制細胞凋亡[2,5]。更重要的是,iASPP和p53形成了負反饋環,p53的積累和活化能直接促進iASPP蛋白表達。iASPP的C端與ASPP1和ASPP2的C端相同,并且iASPP能和ASPP1、ASPP2競爭與p53的結合[6]。iASPP位于染色體19q13.3上,由人類PPP1R13L基因編碼[5]。iASPP在多個惡性腫瘤如白血病、胃癌中表達上調,iASPP過表達導致p53失去抑制腫瘤形成的功能,并且在腫瘤細胞系中RNAi抑制iASPP能恢復p53的凋亡活性[2,5,7]。研究表明,iASPP基因多態性與乳腺癌、肺癌相關。并且,iASPP過表達與宮頸鱗狀細胞癌預后差相關,iASPP高表達卵巢癌和宮頸癌患者無病生存期(disease-free survival,DFS)和總生存期(overall survival,OS)短[8-9]。抑制iASPP能促進p53依賴的凋亡,觸發腫瘤細胞死亡,抑制腫瘤細胞增殖,增強腫瘤對化療敏感性[5,8]。先前我們發現了iASPP的一個新亞型iASPP剪切變異體(iASPP splice variant,iASPP-SV),其是包含407個氨基酸殘基的核蛋白,能與p53結合、抑制p53的轉錄活性[10]。因此,iASPP基因至少轉錄iASPP(828)和iASPP-SV兩個亞型[10-11]。但是迄今為止,這些亞型的聯系尚不完全清楚。本研究旨在探討iASPP-SV在乳腺癌中的表達水平,及其在乳腺癌腫瘤形成和進展中的作用,為乳腺癌的治療提供新的思路和靶點。
1 材料和方法
1.1 細胞系及原發性乳腺癌組織
乳腺癌細胞系MCF-7和MDA-MB-231,腫瘤細胞系A549、HCT116、HuH1、Mino、Jeko-1和Ramos,以及NIH 3T3細胞系由美國模式培養物保藏所(American Type Culture Collection,ATCC)提供,培養于含有10%胎牛血清的培養基(Dulbecco modified Eagle medium,DMEM)中。所有原發性乳腺癌均經知情同意后在手術后收集,并且此研究通過了天津醫科大學腫瘤醫院及癌癥研究所人體試驗委員會批準。HEK293細胞由天津醫科大學腫瘤醫院腫瘤研究所免疫研究室提供,HKE293細胞常規培養于含10%滅活胎牛血清的DMEM中。
1.2 引物和抗體
用于實時熒光定量聚合酶鏈反應(real-time fluorescent quantitative p o l y m e r a s e c h a i n r e a c t i v e,RT F QP C R)的引物包括G A P D H(F o r w a r d 5’-CCACTCCTCCACCTTTGAC-3’,Reverse 5’-ACCCTGTTGCTGTAGCCA-3’)、iASPPSV(Forward 5’-TGTGCTGGTTGTATGCCC TGGAAG-3’,Reverse 5’-AGCCGGAACAA GAGCCCATCAGA-3’)和iASPP(828) (Forward 5’-TCTCCTCTGGCCAGCGACCG-3’,Reverse 5’-CTGCGAGGCAAAGTGCCCGA-3’);用于iASPP-SV 5’-RACE的引物包括:GSP1 5’-AGCCGGAACAAGAGCCCATCA-3’和GSP2 5’-ACTCCCTCTCCACAACTTCCAGG-3’;用于PCR的引物包括iASPP(828)5’-CGTAGAATTC CATGGACAGCGAGGCATTCCAGAGC-3’;用于反義質粒合成的引物包括iASPP-SV(Forward 5’-AATTAAGAGCCCATCAGAGGACAGGTCC CCAGGAGACACCCAACACTCCCTCTC-3’,Reverse 5’-TCGAGAGAGGGAGTGTTGGGTG TCTCCTGGGGACCTGTCCTCTGATGGGCTC TT-3’)、iASPP(828) (Forward 5’-AATTAGCAG GGAGCTCCCGAAGGCGGACGCTGGCGCGT CGTAGGCTGTGGC-3’,Reverse 5’-TCGAGC CACAGCCTACGACGCGCCAGCGTCCGCCT TCGGGAGCTCCCTGCT-3’)和iASPP(common)(Forward 5’-AATTCCGGTCAGCGCCGCGTCC AGGAGGAGCACCAGAGGGTTGAGGCG-3’,Reverse 5’-TCGACGCCTCAACCCTCTGGTGC TCCTCCTGGACGCGGCGCTGACCGG-3’)。
所用抗體包括iASPP羊抗人單克隆抗體(sc-74941,購自美國Santa Cruz公司)、β-actin鼠抗人單克隆抗體(A1978,購自美國Sigma公司)和FLAG鼠抗人單克隆抗體(F3165,購自美國Sigma公司)。
1.3 質粒構建
構建FLAG-iASPP(828)質粒:質粒PCMV-iASPP(SC318309,購自美國OriGene公司)通過PCR擴增,并且把PCR產物與載體pGEM-T連接,之后用EcoR Ⅰ和Xho Ⅰ雙酶切亞克隆到FLAG1-pcDNA3。構建FLAG-iASPP-SV質粒:按說明書用TRIzol試劑(購自美國Invitrogen公司)提取細胞總RNA,并測定RNA純度和濃度。2 μg總RNA用隨機引物進行反轉錄。設計特異性引物(正義序列:5’-GGAATTCCAT GTGCTGGTTGTATGCC-3’,反義序列: 5’-CTCGAGGTCAGCCTCAGAAACCTC-3’)用于擴增iASPP/RAI (AF078037)的774~2 028片段。總反應體系為50 μL,包括2 μL cDNA、2.5 U La Taq(Takara)和25 μL 2×GC Buffer I。PCR反應條件:預變性94 ℃,5 min;變性94 ℃,45 s;退火50 ℃,45 s;延長72 ℃,90 s;6個循環。之后在7500型RTFQ-PCR儀系統上按照標準程序進行PCR:94 ℃,45 s;56 ℃,45 s;72 ℃,90 s;30個循環。PCR產物與載體pGEM-T連接,之后用EcoR I和Xho I雙酶切亞克隆到FLAG1-pcDNA3。構建反義質粒,設計針對iASPP-SV/iASPP(828)反義寡核苷酸對,與pcDNA3連接。所有質粒經過測序驗證。
1.4 c D N A 5’-末端快速擴增(r a p i d amplification of cDNA ends,RACE)
購買5’-RACE kit試劑盒(18374-058,購自美國Invitrogen公司)。按說明書用TRIzol試劑提取MCF-7細胞總RNA,并測定RNA純度和濃度。用特異性iASPP-SV引物GSP1反轉錄總RNA,之后在dCTP存在下用末端脫氧核糖核酸轉移酶延長。按照說明書用5’-RACE錨定加尾引物和iASPP-SV引物GSP2來擴增cDNA。PCR產物連接到pGEM-T Vector(A3600,購自美國Promega公司),之后進行測序。
1.5 RTFQ-PCR分析
用TRIzol(購自美國Invitrogen公司)試劑提取細胞總RNA,DNA用TURBO DNA-freeTM(購自美國Applied Biosystems公司)去除。1 μg RNA用iScript cDNA合成試劑盒(購自美國BioRad公司)反轉錄合成cDNA。按照商家說明書進行RTFQPCR。特異性iASPP mRNA相對量由2-ΔΔCt呈現。在原發性乳腺癌中,ΔΔCt=ΔCt p53野生型乳腺癌組織-ΔCt p53突變型乳腺癌組織。
1.6 檢測p53基因突變
設計一對特異性引物(正義序列: 5-TGCATTCTGGGACAGCCAAG-3,反義序列:5-AACATCTCGAAGCGCTCACG-3)來擴增p53外顯子4~11的一個682 bp的片段。在包含10 μL cDNA和2.5 U pyrobest DNA polymerase[購自寶生物工程(大連)有限公司]的100 μL體系中,PCR擴增p53片段。為避免RTFQ-PCR期間出現錯誤的突變,在突變樣本中,重復RTFQ-PCR并測序。
1.7 轉染
在6孔板中每孔3 m L完全培養液,鋪5×105~10×105個細胞。12~24 h后,用LipofectamineTM2000(購自美國Invitrogen公司)轉染2 μg FLAG-iASPP(828)或FLAG-iASPP-SV質粒。為了建立穩定表達FLAG-iASPP-SV和FLAG-iASPP(828)的NIH 3T3細胞系,轉染后的細胞用500 mg/mL G418篩選穩定表達細胞系2~4周,并通過有限稀釋法挑單細胞克隆。
1.8 細胞增殖分析
在96孔板中每孔鋪1×103~2×103個細胞,每孔加入10 μL Cell Counting Kit-8 (購自日本同仁化學研究所)溶液,在細胞培養箱內繼續溫育1 h。按照說明書,不同時間點在450 nm處測定吸光度值。
1.9 克隆形成實驗
取對數生長期1×103個細胞鋪到10 cm的平板中,在37 ℃、CO2體積分數為5%的溫箱中培養10 d。培養結束后,用0.5%結晶紫染色并用倒置顯微鏡計數細胞數目大于40個的克隆數目。
1.10 軟瓊脂集落形成試驗
2×103個細胞與含0.35%瓊脂糖的0.4 mL培養液混勻,接種到12孔板,每孔0.8 mL含0.7%相同介質的固化瓊脂糖。在37 ℃、CO2體積分數為5%的溫箱中溫育3周后,用倒置顯微鏡計數細胞數目大于40個的克隆數目。
1.11 蛋白[質]印跡法(Western blot)實驗
收集細胞,用細胞裂解液RIPA裂解細胞、提取總蛋白,測定濃度。SDS-PAGE凝膠電泳分離,電轉移至PVDF印跡膜,封閉,分別滴加以1∶1 000稀釋的iASPP羊抗人單克隆抗體(sc-74941,購自美國Santa Cruz公司)及FLAG鼠抗人單克隆抗體(F3165,購自美國Sigma公司)進行溫育,PBST洗膜后,加入二抗室溫溫育,PBST洗膜后用化學發光法顯影。
1.12 熒光素酶報告基因實驗
轉染前24 h消化HEK293細胞并計數,在24孔板中每孔接種5×104個細胞,待細胞達到60%~70%融合度時,采用LipofectamineTM2000試劑,將pFLAG-iASPP(828)、pFLAG-iASPPSV和pFLAG-P53分別與pFLAG-P65、200 ng熒光素酶報告基因和30 ng pCMV-β-半乳糖苷酶共轉染HEK293細胞,設3個復孔。轉染后24 h,使用熒光素酶檢測系統(購自美國Promega公司)測定熒光素酶相對活性,按照Luciferase?Reporter Assay System說明書進行操作。
1.13 統計學處理
用SPSS 11.0軟件分析實驗數據。對數據不符合參數檢驗條件,采用配對樣本的非參數秩和檢驗,均數比較采用獨立樣本t檢驗,各組間比較采用方差分析。P<0.05為差異有統計學意義。
2 結 果
2.1 iASPP-SV mRNA的5’末端序列
iASPP-SV和iASPP(828)的區別在于N末端不同,我們首先用5’-RACE克隆MCF-7細胞的iASPP-SV mRNA的5’末端,并測序。5’-RACE產物序列分析結果見圖1。美國國家生物技術信息中心(National Center of Biotechnology Information,NCBI)提供的生物序列的同源性搜索數據顯示:iASPP-SV的5’末端與RAI(AF078037.1)幾乎相同。這表明iASPP-SV和iASPP(828)是由同一個基因轉錄,iASPP-SV由RAI序列(DQ986418.1)編碼。
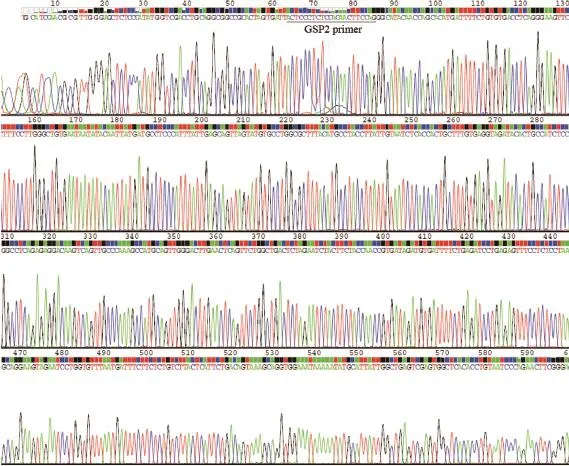
圖 1 5’-RACE克隆iASPP-SV的DNA產物測序Fig. 1 5’-RACE products of iASPP-SV were confirmed by DNA sequencing
2.2 多種腫瘤細胞系表達內源性iASPP-SV
為了確定是否人類腫瘤細胞表達內源性iASPP-SV,我們分別克隆iASPP(828)及iASPP-SV并插入到FLAG tag質粒中(圖2)。將pFLAG-iASPP-SV和pFLAG-iASPP(828)分別轉染HEK293細胞。轉染后的HEK293細胞抗iASPP(828)和抗iASPP-SV抗體兩個條帶大約105×103和55×103,并且這兩個條帶在8種腫瘤細胞中都存在(圖3)。為了確定這兩個條帶是否是iASPP(828)和iASPP-SV,我們分別轉染iASPPSV和iASPP(828)的反義質粒到MCF-7細胞。55×103和105×103蛋白明顯減少,同時iASPP-SV和iASPP(828) mRNA也減少(圖4)。上述結果表明,55×103的條帶是iASPP-SV,并且人類多種腫瘤細胞系表達內源性iASPP-SV。
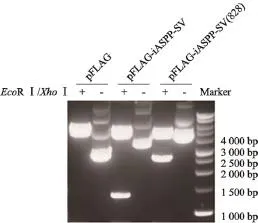
圖 2 Western blot實驗驗證構建的pFLAG-iASPP-SV和pFLAG-iASPP(828)質粒Fig. 2 Western blot detected the constructed plasmids pFLAG-iASPP-SV and pFLAG-iASPP(828)
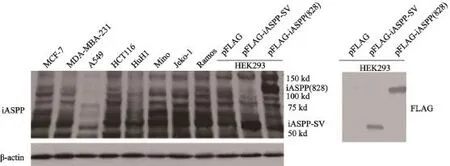
圖 3 Western blot實驗檢測人類腫瘤細胞系中iASPP(828)和iASPP-SV的表達水平Fig. 3 Western blot detected the expression levels of iASPP(828) and iASPP-SV in several human tumor cell lines
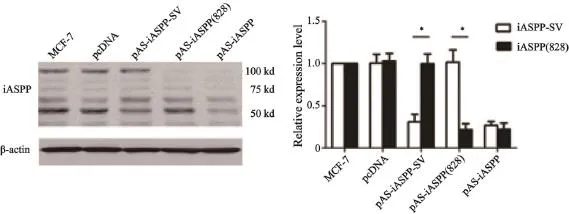
圖 4 Western blot實驗檢測轉染iASPP-SV和iASPP(828)的反義質粒后iASPP(828)和iASPP-SV表達水平,PTFQ-PCR檢測iASPPSV和iASPP(828) mRNA水平Fig. 4 Western blot (left figure) and RTFQ-PCR analysis (right figure) demonstrated that plasmids of antisense iASPP-SV suppressed endogenous iASPP-SV expression in MCF-7
2.3 iASPP-SV促進腫瘤細胞NIH 3T3增殖
我們首先建立了穩定表達FLAG-iASPP-SV和FLAG-iASPP(828)、能在500 μg/mL遺傳霉素中生長的NIH 3T3克隆(圖5)。細胞增殖分析結果顯示,iASPP-SV和iASPP(828)促進NIH 3T3細胞生長(圖6),并且克隆形成和軟瓊脂集落形成實驗表明iASPP-SV比iASPP(828)的致癌活性更強(圖7)。
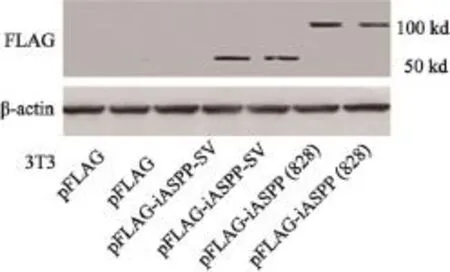
圖 5 Western blot實驗驗證構建的穩定表達FLAG-iASPP-SV和FLAG-iASPP(828)的NIH 3T3細胞系Fig. 5 Western blot detected the stable clones of NIH 3T3 expressing FLAG-iASPP-SV and FLAG-iASPP(828)
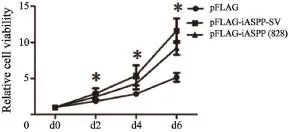
圖 6 用細胞計數試劑盒檢測穩定表達FLAG-iASPP-SV和FLAG-iASPP(828)的NIH 3T3細胞系第0、2、4和6天的細胞增殖情況Fig. 6 Cell proliferation of NIH 3T3 expressing FLAG-iASPPSV and FLAG-iASPP (828) was assayed with cell counting kit-8 assay on d 0, 2, 4 and 6
2.4 iASPP-SV在p53野生型乳腺癌表達上調
應用RTFQ-PCR的方法檢測原發性乳腺癌組織iASPP-SV和iASPP(828)mRNA表達水平。結果表明,p53野生型乳腺癌組織iASPP-SV和iASPP(828)表達水平的中位值比p53突變型顯著升高,并且iASPP-SV表達水平與iASPP(828)呈正相關(圖8)。
2.5 iASPP-SV抑制NF-κB/p65的轉錄活性
應用熒光素酶報告基因實驗檢測iASPP(828)和iASPP-SV與NF-κB/p65的關系。結果表明,p53、iASPP(828)和iASPP-SV都能與NF-κB/p65結合并抑制其轉錄活性(圖9)。

圖 7 克隆形成和軟瓊脂集落形成實驗檢測穩定表達FLAG-iASPP-SV和FLAG-iASPP(828)的NIH 3T3細胞系細胞的克隆形成及集落形成能力Fig. 7 Colony formation and soft agar colony formation assay were used to detect the clone formation and colony formation ability of NIH 3T3 expressing FLAG-iASPP-SV and FLAG-iASPP(828)
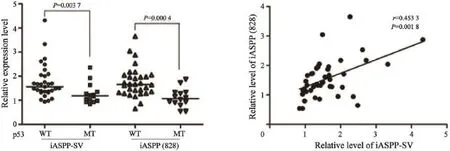
圖 8 RTFQ-PCR實驗檢測原發性乳腺癌iASPP-SV和iASPP(828) mRNA表達水平Fig. 8 RTFQ-PCR detected the levels of iASPP-SV and iASPP(828) mRNA in primary breast cancer
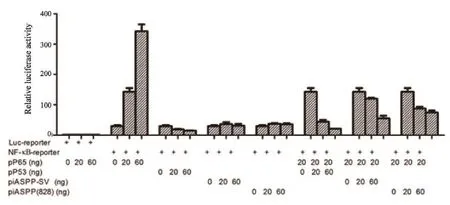
圖 9 熒光素酶報告基因實驗檢測p53、iASPP(828)和iASPP-SV與NF-κB/p65的關系Fig. 9 Luciferase assays were used to identify the relationship between iASPP-SV, iASPP(828) and p53 and NF-κB/p65
3 討 論
乳腺癌是全世界女性中最常見的惡性腫瘤,嚴重危害女性健康。我國華東地區乳腺癌的發病比例占中國人口的38%,近些年其發病率有明顯上升趨勢,引起國內外學者的關注[12]。iASPP是ASPP家族中的抑制性成員,能特異性抑制p53的促凋亡作用。iASPP基因通過選擇性剪接作用至少轉錄iASPP(828)和iASPP-SV兩個亞型[10-11],并且iASPP在多個惡性腫瘤中表達上調,與腫瘤預后不良相關[2,5,7-8]。
在本研究中,我們用5’-RACE檢測了MCF-7細胞中iASPP-SV mRNA的5’末端序列,并且生物序列的同源性搜索顯示,iASPP-SV與RAI(AF078037.1)序列相同,確定iASPP-SV和iASPP(828)兩個亞型來源于具有選擇性啟動子的iASPP的基因剪接。已有研究表明,iASPP能抑制p53,有致癌作用[2,5],并且我們先前的結果表明,iASPP-SV抑制p53的轉錄活性[10]。本研究發現,內源性iASPP-SV在多種腫瘤細胞系表達,并且iASPP-SV比iASPP(828)更能明顯促進NIH 3T3細胞增殖,iASPP-SV可能是癌基因。已有研究證實,人乳腺癌中iASPP表達上調,在野生型p53基因的乳腺癌和白血病中,敲除iASPP能增強乳腺癌細胞的化療凋亡率和敏感性[5,8-9]。然而,乳腺癌中iASPP(828)和iASPPSV表達水平不清楚。本研究發現,iASPP-SV和iASPP(828)在p53野生型人乳腺癌中較p53突變型過表達。
已證實人類95%的多外顯子基因具有選擇性剪接的調控機制,選擇性剪接保證了轉錄組和蛋白質多樣性[13]。很多癌癥相關基因如p53具有選擇性剪接作用。p53基因具有多個轉錄起始位點,通過選擇性剪接編碼多個亞型[14]。ASPP家族中,ASPP2基因也編碼兩個亞型53BP2(1005氨基酸)和ASPP2(1128氨基酸)[15]。已有研究表明,ASPP2/53BP2可以與p53和NF-κB/p65結合,ASPP2能通過p53非依賴途徑促進RAS誘導的凋亡和p53依賴途徑抑制腫瘤生成[16]。NF-κB/p65與ASPP2/53BP2結合,抑制ASPP2/53BP2誘導的細胞凋亡[17]。本研究發現,iASPP-SV能與NF-κB/p65結合并抑制其轉錄活性。并且有研究表明,敲低iASPP能通過NF-κB途徑降低原始淋巴細胞和正常纖維細胞凋亡水平[18]。這些研究表明,ASPP家族可能參與調節p53和NF-κB的活性,iASPP可能是雙功能蛋白,與不同蛋白相互作用,具有促進細胞生存和抑制細胞生存的特性[11,19]。因此,iASPP-SV可能作為乳腺癌治療的有效靶點。
綜上所述,癌基因iASPP-SV在p53野生型乳腺癌中表達上調并促進腫瘤形成。該研究為人們認識iASPP-SV在乳腺癌發生、發展中的作用機制提供了新的思路,iASPP-SV可能作為乳腺癌治療的有效靶點,為乳腺癌的治療提供了新的靶點和理論依據。
[1] HO D H, KIM H, KIM J, et al. Leucine-rich repeat kinase 2(LRRK2) phosphorylates p53 and induces p21 (WAF1/CIP1)expression[J]. Mol Brain, 2015, 8(1): 54.
[2] QIU S, CAI Y, GAO X, et al. A small peptide derived from p53 linker region can resume the apoptotic activity of p53 by sequestering iASPP with p53[J]. Cancer Lett, 2015, 356(2 Pt B): 910-917.
[3] HALABY M J, HARRIS B R, MISKIMINS W K, et al. Deregulation of IRES-mediated p53 translation in cancer cells with defective p53 response to DNA damage[J]. Mol Cell Biol, 2015, 35(23): 4006-4017.
[4] LóPEZ I, TOURNILLON A S, F?HRAEUS R, et al. p53-mediated control of gene expression via mRNA translation during endoplasmic reticulum stress[J]. Cell Cycle, 2015,14(21): 3373-3378.
[5] MENG W D, CHU R X, WANG B Z, et al. Helicobacter pylori infection and expressions of apoptosis-related proteins p53,ASPP2 and iASPP in gastric cancer and precancerous lesions[J]. Pathol Biol (Paris), 2013, 61(5): 199-202.
[6] SKENE-ARNOLD T D, LUU H A, UHRIG R G, et al. Molecular mechanisms underlying the interaction of protein phosphatase-1c with ASPP proteins[J]. Biochem J, 2013,449(3): 649-659.
[7] CHEN Y, YAN W, HE S, et al. In vitro effect of iASPP on cell growth of oral tongue squamous cell carcinoma[J]. Chin J Cancer Res, 2014, 26(4): 382-390.
[8] KONG F, SHI X, LI H, et al. Increased expression of iASPP correlates with poor prognosis in FIGO IA2-IIA cervical adenocarcinoma following a curative resection[J]. Am J Cancer Res, 2015, 3(5): 1217-1224.
[9] KIM J W, ROH J L, PARK Y, et al. Cytoplasmic iASPP expression as a novel prognostic indicator in oral cavity squamous cell carcinoma[J]. Ann Surg Oncol, 2015, 22(2): 662-629.
[10] ZHANG X, DIAO S, RAO Q, et al. Identification of a novel isoform of iASPP and its interaction with p53[J]. J Mol Biol, 2007, 368(4): 1162-1171.
[11] NOTARI M, HU Y, KOCH S, et al. Inhibitor of apoptosisstimulating protein of p53 (iASPP) prevents senescence and is required for epithelial stratification[J]. Proc Natl Acad Sci U S A, 2011, 108(40): 16645-16650.
[12] WANG F, YU L, WANG F, et al. Risk factors for breast cancer in women residing in urban and rural areas of eastern China[J]. J Int Med Res, 2015, 43(6): 774-789.
[13] MEIJER M, CIJSOUW T, TOONEN R F, et al. Synaptic effects of munc18-1 alternative splicing in excitatory hippocampal neurons[J]. PLoS One, 2015, 10(9): e0138950.
[14] MARCEL V, DICHTEL-DANJOY M L, SAGNE C, et al. Biological functions of p53 isoforms through evolution: lessons from animal and cellular models[J]. Cell Death Differ,2011, 18(12): 1815-1824.
[15] TAKAHASHI N, KOBAYASHI S, JIANG X, et al. Expression of 53BP2 and ASPP2 proteins from TP53BP2 gene by alternative splicing[J]. Biochem Biophys Res Commun,2004, 315(2): 434-438.
[16] TORDELLA L, KOCH S, SALTER V, et al. ASPP2 suppresses squamous cell carcinoma via RelA/p65-mediated repression of p63[J]. Proc Natl Acad Sci U S A, 2013, 110(44): 17969-17974.
[17] YANG J P, HORI M, TAKAHASHI N, et al. NF-kB subunit p65 binds to 53BP2 and inhibits cell death induced by 53BP2[J]. Oncogene, 1999, 18(37): 5177-5186.
[18] DIJSSELBLOEM N, GORIELY S, ALBARANI V, et al. A critical role for p53 in the control of NF-kappaB-dependent gene expression in TLR4-stimulated dendritic cells exposed to Genistein[J]. J Immunol, 2007, 178(8): 5048-5057.
[19] SLEE E A, GILLOTIN S, BERGAMASCHI D, et al. The N-terminus of a novel isoform of human iASPP is required for its cytoplasmic localization[J]. Oncogene, 2004, 23(56): 9007-9016.
iASPP-SV, as an oncogene, participates in breast tumorigenesis and progression
DONG Yinan, KONG Fanming, ZHANG Xinwei, WEI Feng, SUN Qian (Cell Immunology Lab, Tianjin Medical University Cancer Institute and Hospital, National Clinical Research Center for Cancer, Tianjin Key Laboratory of“Cancer Prevention”, Tianjin Key Laboratory of Immunology and Cancer Biotherapy, Tianjin 300060,China)
Correspondence to: ZHANG Xinwei E-mail: zhangxinwei@tjmuch.com
Background and purpose: Inhibitor of apoptosis-stimulating protein of p53 (iASPP) is one of the ASPP family. It binds to p53 to inhibit the transcriptional activity of p53-target genes and cell apoptosis, which is associated with tumor formation. Previously, we found a new subtype of iASPP, iASPP splice variant (iASPP-SV), which is a nuclear protein containing 407 amino acid residues and can bind to p53, inhibiting p53 transcriptional activity. However, the relationship of iASPP-SV and breast cancer is still obscure. Therefore, the purpose of this research was to study the role of iASPP-SV on breast cancer tumorigenesis and progression. Methods: 5’-rapid amplification of cDNA ends (RACE) was used to identify the 5’-end of iASPP-SV mRNA in MCF-7 cells. HEK 293 cells were transfected with pFLAG-iASPP-SV and pFLAG-iASPP (828). Then Western blot was used to identify whether endogenous iASPPSV was expressed in HEK 293 cells and 8 types of human tumor cell lines. This study established the stable clones ofNIH 3T3 expressing FLAG-iASPP-SV and FLAG-iASPP (828). Cell proliferation assay, colony formation and soft agar colony formation assay were used to identify whether iASPP-SV and iASPP (828) can promote cell proliferation and iASPP-SV is an oncogene. Real-time fluorescent quantitative polymerase chain reactive (RTFQ-PCR) was used to detect the levels of iASPP-SV and iASPP (828) mRNA in primary breast cancers. Luciferase assays were used to identify the relationships between iASPP-SV, iASPP (828), p53 and NF-κB p65. Results: The study identified that iASPP-SV was encoded by previously reported NF-κB p65 subunit (RelA)-associated inhibitor (RAI), and endogenously expressed in many human cancer cell lines. Analysis of cell proliferation, colony formation assay and soft agar assay for colony formation identified that similarly to iASPP (828), iASPP-SV promoted tumor cell proliferation and acted as an oncogene. RTFQ-PCR result showed that the median values of iASPP-SV and iASPP (828) in breast cancers with wild-type p53 were more significantly over-expressed than those of mutant p53. Luciferase assays showed that iASPP-SV and iASPP (828) could suppress NF-κB p65 transcriptional activity. Thus iASPP family may participate in the regulation of p53 and NF-κB activity, which imply that iASPP perhaps shows pro- or anti-survival activities when it interacts with different proteins. Conclusion: These findings indicate that iASPP-SV may be a potential target for breast cancer therapy.
Inhibitor of apoptosis-stimulating protein of p53; Inhibitor of apoptosis-stimulating protein of p53 splice variant; p53; NF-κB; Breast cancer
10.19401/j.cnki.1007-3639.2016.10.005
R737.9
A
1007-3639(2016)10-0831-09
天津市自然科學基金項目(14JCYBJC27100,13JCQNJC10400,14JCYBJC25500)。
張新偉 E-mail: zhangxinwei@tjmuch.com
(2015-11-09
2016-03-06)

