鹿特異性復合麻醉劑對大鼠腦區NOS活性及NO/cGMP信號轉導系統的影響
尹柏雙,宋永利,付連軍,呼顯生,沙萬里,方文山,高 利
(1.吉林農業科技學院動物醫學學院,吉林 吉林 132101;2.東北農業大學動物醫學學院,黑龍江 哈爾濱 150030)
鹿特異性復合麻醉劑對大鼠腦區NOS活性及NO/cGMP信號轉導系統的影響
尹柏雙1,宋永利1,付連軍1,呼顯生1,沙萬里1,方文山1,高利2
(1.吉林農業科技學院動物醫學學院,吉林 吉林 132101;2.東北農業大學動物醫學學院,黑龍江 哈爾濱 150030)
研究鹿特異性復合麻醉劑麻醉下大鼠不同腦區NOS活性、NO和cGMP濃度的變化,探討鹿特異性復合麻醉劑的中樞作用機理。將24只SD大鼠隨機分成4組,分別為對照組、誘導期、麻醉期和催醒期,于不同時期采集大鼠大腦皮質、小腦、腦干、海馬和丘腦。采用比色法測定各腦區NOS活性和NO含量,酶聯免疫吸附法測定各腦區cGMP濃度。結果表明,腹腔注射鹿特異性復合麻醉劑30 mg/kg體重后,麻醉期各腦區一氧化氮合酶(NOS)活性顯著降低(P<0.05或P<0.01);NO產量與對照組比較降低極顯著(P<0.01);鳥甘酸環化酶(cGMP)濃度降低顯著(P<0.05或P<0.01)。結果提示,鹿特異性復合麻醉劑抑制大鼠各腦區NOS活性,阻斷NO/cGMP信號轉導可能是其產生全麻作用的重要機理之一。
鹿特異性復合麻醉劑;一氧化氮合酶;一氧化氮/環鳥苷酸;信號轉導
一氧化氮(NO)是一種氣體信號分子,可激活鳥苷酸環化酶(cGMP),起到細胞間信號傳遞的作用[1-2]。cGMP作為第二信使,起到傳遞細胞內信息的作用[3]。一氧化氮合酶(NOS)是NO生成的關鍵酶[4]。NO/cGMP信號轉導通路是細胞內重要的信號通路[5-6],將胞外信號轉導至細胞核,參與肌肉收縮、神經傳遞和細胞生長等生理過程[7]。研究發現,NO/cGMP信號轉導通路介導了麻醉藥對神經突觸作用,引起興奮性突觸的抑制和抑制性突觸的增強,從而產生麻醉現象[8-10]。鹿特異性復合麻醉劑是根據平衡麻醉理論以賽拉嗪和強痛寧組方而成的針對于鹿生理特點,為鹿的鋸茸、野外分群和疾病診療等需要研制。本試驗旨在探討鹿特異性復合麻醉劑麻醉下大鼠各腦區NOS活性、NO和cGMP含量的變化,擬從NO/cGMP信號轉導系統的變化揭示鹿特異性復合麻醉劑作用的分子學機理。
1 材料與方法
1.1試驗材料及動物鹿特異性復合麻醉劑(噻啦嗪∶替來他明∶強痛寧=0.90∶0.82∶0.26);NOS測定試劑盒(南京建成生物工程研究所,批號:20130815);NO測定試劑盒(南京建成生物工程研究所,批號:20130812);考馬斯亮藍蛋白質含量測定試劑盒(南京建成生物工程研究所,批號:20130816);cGMP Elisa Kit(南京建成生物工程研究所,批號:20130915)。SD純種大鼠24只,體重200±20 g,雌雄不拘,吉林大學實驗動物中心提供,同一條件下飼養2周后進行試驗。
1.2動物分組與處理SD純種大鼠,共24只,隨機取6只作為生理鹽水對照組,其余大鼠為試驗組;試驗組大鼠隨機分成誘導期(注藥后5 min)、麻醉期(翻正反射消失)、催醒期(翻正反射恢復)3個亞組,每組6只。對照組大鼠腹腔注射30 mL/ kg體重的生理鹽水,試驗組大鼠腹腔注射30 mg/ kg體重的鹿特異性復合麻醉劑。
1.3樣品采集和處理對照組大鼠在腹腔注射給藥后5 min斷頭取腦,誘導期、麻醉期和催醒期分別在給藥后5 min、大鼠翻正反射消失即刻、翻正反射恢復即刻斷頭取腦,在生理鹽水冰面上迅速分離大腦皮層、海馬、丘腦、小腦和腦干,分別稱重,裝入凍存管后投入液氮中保存。
分別將腦組織取出置入冰冷的蔗糖緩沖液(0.32 mol/L,1/10,W/V)介質中勻漿,2 500 r/min離心10 min,制備成10%腦組織勻漿液,為待測樣品。
1.4檢測方法采用比色法測定NOS酶活性和NO含量,ELISA測定cGMP濃度,考馬斯亮藍法測定蛋白質含量。檢測具體方法參照各檢測試劑盒的操作說明書進行。
1.5試驗數據的分析與統計試驗結果數據以平均值±標準差(±SD)表示,用SPSS 13.0數據統計軟件對試驗數據進行統計學分析,組間比較采用t檢驗。
2 結果
2.1鹿特異性復合麻醉劑對大鼠不同腦區NOS活性的影響結果如表1所示,復合麻醉劑給藥后抑制了大鼠各腦區內NOS活性,誘導期海馬、腦干NOS活性與對照組比較分別降低了34.93%(P<0.01)和18.91%(P<0.05);麻醉期大腦皮質、小腦、腦干、海馬和丘腦NOS活性與對照組相比分別降低了32.73%(P<0.01)、11.47%(P<0.05)、31.79%(P<0.01)、35.65%(P<0.01)和28.52%(P<0.01);催醒期大腦皮質、小腦和丘腦NOS活性仍然較對照組低(P<0.05或P<0.01)。
2.2鹿特異性復合麻醉劑對大鼠不同腦區NO含量的影響由表2可見,復合麻醉劑降低了大鼠各腦區NO含量,誘導期大腦皮質、小腦、腦干和丘腦NO含量與對照組比較分別降低了53.35%(P<0.01)、35.53%(P<0.01)、39.83%(P<0.01)和36.55%(P<0.01);麻醉期大腦皮質、小腦、海馬、腦干和丘腦NO含量與對照組比較分別降低了74.96%(P<0.01)、70.09%(P<0.01)、48.89%(P<0. 01)、39.63%(P<0.01)和63.62%(P<0.01)。催醒期小腦NO含量仍低于對照組(P<0.01)。
表1 復合麻醉劑對大鼠不同腦區NOS活性的影響(n=6,D)[mol Pi/mg(prot)/h]
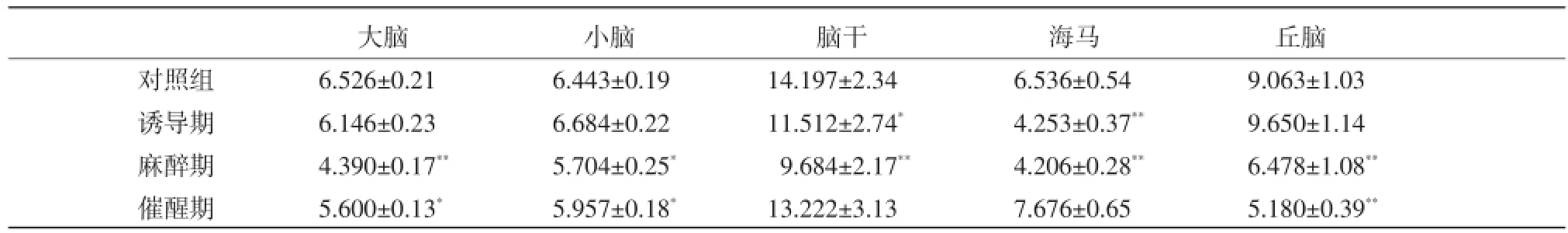
表1 復合麻醉劑對大鼠不同腦區NOS活性的影響(n=6,D)[mol Pi/mg(prot)/h]
注:與對照組比較;**:P<0.01,差異極顯著;*:P<0.05,差異顯著,下表同
大腦 小腦 腦干 海馬 丘腦對照組 6.526±0.21 6.443±0.19 14.197±2.34 6.536±0.54 9.063±1.03誘導期 6.146±0.23 6.684±0.22 11.512±2.74* 4.253±0.37** 9.650±1.14麻醉期 4.390±0.17** 5.704±0.25* 9.684±2.17** 4.206±0.28** 6.478±1.08**催醒期 5.600±0.13* 5.957±0.18* 13.222±3.13 7.676±0.65 5.180±0.39**
2.3鹿特異性復合麻醉劑對大鼠不同腦區cGMP濃度的影響結果如表3所示,復合麻醉劑引起大鼠麻醉期各腦區內cGMP濃度降低,與對照組比較差異顯著(P<0.05或P<0.01)。催醒期大鼠小腦和腦干cGMP濃度仍低于對照組(P<0.05或P<0.01)。
3 討論
NO在維持機體清醒狀態、調解生理機能等方面發揮著重要作用[11-12]。中樞神經通路的興奮性和抑制性與NO/cGMP信號轉導系統關系密切,CNS通過調節中樞NO/cGMP系統使神經細胞內cGMP含量升高引起興奮性;cGMP含量下降引起中樞抑制[13]。
表2 復合麻醉劑對大鼠不同腦區NO含量的影響(n=6,D)(U/mg)

表2 復合麻醉劑對大鼠不同腦區NO含量的影響(n=6,D)(U/mg)
大腦 小腦 腦干 海馬 丘腦對照組 1.957±0.17 7.500±0.78 3.839±0.57 4.502±0.65 3.587±0.28誘導期 0.913±0.12** 4.835±0.21** 2.310±0.36** 3.966±0.37 2.276±0.19**麻醉期 0.490±0.06** 2.243±0.19** 1.962±0.21** 2.718±0.15** 1.305±0.11**催醒期 1.847±0.23 4.393±0.42** 3.886±0.46 4.267±0.48 3.055±0.36
表3 復合麻醉劑對大鼠不同腦區cGMP濃度的影響(n=6,D)(pmol/mL)
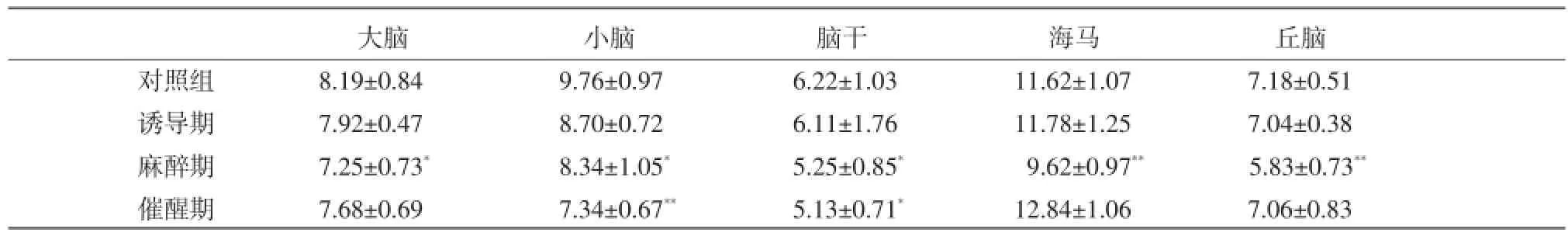
表3 復合麻醉劑對大鼠不同腦區cGMP濃度的影響(n=6,D)(pmol/mL)
大腦 小腦 腦干 海馬 丘腦對照組 8.19±0.84 9.76±0.97 6.22±1.03 11.62±1.07 7.18±0.51誘導期 7.92±0.47 8.70±0.72 6.11±1.76 11.78±1.25 7.04±0.38麻醉期 7.25±0.73* 8.34±1.05* 5.25±0.85* 9.62±0.97** 5.83±0.73**催醒期 7.68±0.69 7.34±0.67** 5.13±0.71* 12.84±1.06 7.06±0.83
過去的研究表明,多數麻醉藥能明顯減少大腦皮質、小腦等腦區cGMP的含量,提示NO/cGMP信號轉導系統的抑制可能促使了全身麻醉作用的出現[14]。王洪斌等研究結果表明,噻環乙胺麻醉下大鼠大腦皮層、海馬和丘腦內NOS活性被抑制,引起NO和cGMP含量明顯下降,提示噻環乙胺麻醉與NO/cGMP信號轉導系統被抑制相關[10]。劉煥奇等研究表明,NO/cGMP信號傳遞系統參與了賽拉唑產生全麻作用[15]。胡興國等研究表明,異丙酚明顯抑制大鼠小腦、海馬和大腦皮層中NOS活性,顯著減少腦區NO和cGMP含量,提示NO/cGMP信號轉導系統在異丙酚全麻分子機理中發揮重要作用[16]。本研究結果表明,腹腔注射鹿特異性復合麻醉劑30 mg/kg體重后,引起麻醉期各腦區NOS活性顯著降低,NO和cGMP含量下降,提示NO/cGMP信號轉導系統參與了鹿特異性復合麻醉劑全麻分子機理調控。
4 結論
本研究結果表明,鹿特異性復合麻醉劑抑制大鼠大腦皮質、小腦、海馬、腦干和丘腦內NOS活性,降低NO和cGMP含量,阻斷NO/cGMP信號轉導可能是其產生全麻作用的重要機理之一。
[1]沈政,鐵國棟,趙興緒,等.雌性動物生殖系統中的一氧化氮[J].細胞生物學雜志,2004,26(4):349-351.
[2]周振琪,潘玲梅,王恬,等.環鳥苷酸對卵巢細胞功能的調控[J].細胞生物學雜志,2005,27(6):603-606.
[3]朱亮,章孝榮,劉亞,等.一氧化氮與卵母細胞發育[J].動物醫學進展,2010,31(2):107-110.
[4]Okhotin V E,Shuklin A V.Significance of neuronal,endothelial and inducible NO-synthase isoforms in the cardiac muscle histophysiology[J].Morfologiia,2006,129(1):7.
[5]Basini G,Bussolati S,Santini S E,et al.The impact of the phytooestrogen genistein on swine granulosa cell function[J].J Anim Physiol Anim Nutr,2010,94(6):374-382.
[6]Heydarpour P,Salehi-Sadaghiani M,Javadi-Paydar M,et al.Estradiol reduces depressivelike behavior through inhibiting nitric oxide/cyclic GMP pathway in ovariectomized mice[J].Horm Behav,2013,63(2):361-369.
[7]Marathe N,Rangaswami H,Zhuang S,et al.Prosurvival effects of 17β-estradiol on osteocytes are mediated by nitric oxide/cGMP via differential actions of cGMP-dependent protein kinases I and II[J].J Biol Chem,2012,287(2):978-988.
[8]Ybksel K,Wilhelm B,S?nke B,et al.NO/cGMP signaling molecules in the rat epithelial rests of Malassez[J].Euro J Oral Sciences,2004,112(1):55-60.
[9]Sugunobu T A,Chock P B,Chiueh C C.Preconditioning mediated neuroprotection role of nitric oxide,cGMP,and new protein expression[J].Annals o f the New York Academy of Sciences,2002,962(5):127.
[10]王洪斌,范宏剛,盧德章,等.噻環乙胺對大鼠不同腦區NOS活性及NO產量和cGMP含量的影響[J].畜牧獸醫學報,2008,39(11):1599-1605.
[11]許木林,鄭開之,孫思宇,等.NOS及NO/cGMP信號通路對哺乳動物卵泡發育的調控作用[J].中國細胞生物學學報,2013,35(7):1063-1067.
[12]王偉鵬,李立環.臨床麻醉學[M].4版.北京:人民衛生出版社,2004:269-271.
[13]劉鵬,偉忠民,佟宇.NO、NOS對學習記憶和神經毒性作用的研究進展[J].遼寧醫學院學報,2009,30(4):369-373.
[14]莊心良,曾因明,陳伯鑾.現代麻醉學[M].3版.北京:人民衛生出版社,2004:397-399.
[15]劉煥奇,王洪斌,范洪剛,等.賽拉唑對大鼠不同腦區NONOS-cGMP信號轉導系統的影響[J].中國獸醫學報,2010,30(4):493-497.
[16]胡興國,王鈞,曾因明,等.異丙酚對大鼠腦NO/cGMP信號轉導系統的影響[J].臨床麻醉學雜志,2000,16(2):93-95.
Effects of theSpecificity Anesthetic for Deer on NOS activity and NO/cGMP Signal Pathway in Different Encephalic Region of Rats
YIN Bai-shuang1,SONG Yong-li1,FU Lian-jun1,HU Xian-sheng1,SHA Wan-li1,FANG Wen-shan1,GAO Li2
(1.Department of Animal Medicine,JiLin Agricultural Science and technology,Jilin 132101,China;2.College of Animal Medicine,Northeast Agricultural University,Harbin 150030,China)
NOS activity,NO and cGMP contents in different encephalic regions of rats were measured to explore the possible molecular mechanism of action of the deer specific anesthetic on the central nervous system.24 SD rats were divided randomly into four groups including the control,the induction the anesthesia and the recovery.Rats'brain samples of cerebral cortex,hippocampus,cerebellum,thalamus and stem were separated at the different time points under the deer specific anesthesia.The activities of NOS were measured by using colorimetry,and the concentrations of NO and cGMP were determined by Elisa.The NOS activities(P<0.05 or P<0.01),the NO contents(P<0.01),and the concentration of cGMP(P<0.05 or P<0.01)were all obviously decreased in all encephalic regions in the anesthesia group compared with control groups.These results indicated that the deer specific anesthetic inhibited NOS activity and blocked NO/cGMP signal transduction,which might be one of the important mechanisms for the drug to generate general anesthesia.
deer specific anesthetic;NOS;NO/cGMP;signal pathway
GAO Li
S859.791
A
0529-6005(2016)09-0114-03
2015-03-04
國家自然科學基金項目(31302150);長白山動植物資源保護與利用省級重點實驗室基金項目(吉農院合字2012701,2013S029);吉林農業科技學院博士啟動基金項目(吉農院合字2012307);吉林農業科技學院種子基金項目(吉農院合字2013905);吉林省教育廳“十二五”科學技術研究(吉教科合字2014379)
尹柏雙(1978-),男,副教授,博士,從事麻醉與鎮痛研究,E-mail:ybs3421@126.com
高利,E-mail:gaoli43450@163.com

