“物質結構”和“元素周期律”典例導學
安徽省界首一中 張登
“物質結構”和“元素周期律”典例導學
安徽省界首一中 張登
物質結構和元素周期律是化學中的重要理論知識,也是中學化學學習的重要內容。原子結構理論能幫助我們進一步認識元素與物質的關系;元素周期律和元素周期表的知識有助于我們整合元素化合物知識;化學鍵概念的建立,能使我們了解化學反應中物質變化和能量變化的實質。因此,這部分內容在必修模塊學習中起到承上啟下的作用。
一、學習目標
(1)了解元素、核素和同位素的含義。
(2)了解原子構成。了解原子序數、核電荷數、質子數、中子數、核外電子數及其相互關系。
(3)了解原子核外電子排布。
(4)掌握元素周期律的實質。了解元素周期表(長式)的結構(周期、族)及其應用。
(5)以第3周期為例,掌握同一周期元素性質的遞變規律與原子結構的關系。
(6)以ⅠA族和ⅦA族為例,掌握同一主族元素性質的遞變規律與原子結構的關系。
(7)了解金屬、非金屬元素在元素周期表中的位置及其性質的遞變規律。
(8)了解化學鍵的定義。了解離子鍵、共價鍵的形成。
二、典例導學
掌握元素周期律知識有利于指導我們學習元素化合物知識,而化學鍵知識又是學習電解質以及化學反應中的能量變化的基礎。在學習元素周期律、元素周期表內容時,我們應注意掌握元素的變化規律及其實質,在學習化學鍵時,注意概念間的對比。筆者參照全國高考新課標Ⅰ卷考試大綱和近年高考試題,歸納出相關的主要考點。
類型一:元素、核素、同位素、同素異形體之間的區別與聯系
例1下列關于20728Pt的說法正確的是()。
解析根據同位素定義中的兩個限制條件進行分析判斷。
答案A
類型二:有關原子結構的考查
例2已知R2+核內共有N個中子,R的質量數為A,m g R2+中含有電子的物質的量為()mol。

答案D
總結升華解答上述兩道典型例題,一要弄清微粒結構的特點,二要明確陰、陽離子中核電荷數(質子數)、電子數、離子所帶電荷數之間的關系。
知識鏈接1原子的基本構成微粒及其相互關系
(1)基本構成微粒
質子、中子、電子。質子數決定元素的種類;中子數決定一種元素的核素的種數;質子數和中子數共同決定核素的種類;互為同位素的原子的質子數和電子數都分別相等,其化學性質幾乎完全相同。
質量關系:質量數(A)=質子數(Z)+中子數(N)
電性關系:a.對于中性原子,核電荷數=質子數=核外電子數
b.對于陽離子,質子數>核外電子數,質子數=核外電子數+所帶電荷數
c.對于陰離子,質子數<核外電子數,質子數=核外電子數-所帶電荷數(3)核素、同位素
核素:具有一定數目的質子和一定數目的中子的一種原子。
同位素:同一元素的不同核素之間的關系互稱。
區別與聯系:同位素必是不同的核素,但不同的核素未必是同位素。
類型三:核外電子排布規律
例3在第n層電子層中,當它作為原子的最外層時,其最多容納的電子數與第(n-1)層相同,當它作為原子的次外層時,其最多容納的電子數比第(n-1)層多10個。則此電子層是()。
A.K層B.L層C.M層D.可為任意層
解析根據核外電子排布規律,當第n層為最外層時,最多可容納8個電子,而第(n-1)層也可容納8個電子,則第(n-1)層為次外層,故第n層應為M層;當第n層為次外層時,其最多容納的電子數比第(n-1)層多10個,則第n層最多可容納18個電子,即也為M層。
答案C
總結升華核外電子排布規律常常作為原子結構推斷題的突破口,我們在應用時應注意區分幾個概念:最外層電子數、最內層電子數、內層電子數、次外層電子數、電子層數、電荷數等。
類型四:元素周期律及其實質
例4下列關于元素周期律的敘述正確的是()。
A.隨著元素原子序數的遞增,原子最外層電子數總是從1到8重復出現
B.元素的性質隨著原子序數的遞增而呈周期性變化
C.隨著元素原子序數的遞增,元素的最高正價從+1到+7,負價從-7到-1重復出現
D.元素性質的周期性變化是元素原子核外電子排布周期性變化的必然結果
解析掌握元素周期律及其實質。
答案BD
總結升華元素周期律概括了元素性質的變化規律及其原子結構的關系,是學習、研究物質結構和元素化合物知識的主要理論依據。
知識鏈接2元素周期律及其實質
(1)電子層數相同(同周期)的元素,隨著原子序數的遞增,下列性質呈現周期性變化
①最外層電子數從1個遞增至8個(K層為最外層時,從1個增至2個);
②元素原子半徑從大至小(稀有氣體元素除外);
③元素的最高正價從+1至+7價(O、F除外),最低負價從-4至-1價再至0價。
(2)元素周期律的實質
元素性質隨著原子序數遞增呈現的周期性變化,是元素的原子核外電子排布周期性變化的必然結果。即原子結構的周期性變化是元素性質周期性變化的實質,這充分體現了“結構決定性質”的規律,結構變化是因,性質變化是果。
知識鏈接3元素化合價與結構和位置的關系
(1)在原子結構中,與化合價有關的電子叫價電子。主族元素的最外層電子即為價電子,但過渡金屬元素的價電子還與其原子的次外層或倒數第三層的部分電子有關。對于一般非金屬元素,最高正價+最低負價的絕對值=8(H、O、F例外),最高正價=價電子數=主族族序數。
(2)化合價與原子序數、原子的最外層電子數以及族序數的奇偶關系
價(主要化合價)奇序(原子序數)奇、價偶序偶(諧音“嫁雞隨雞,嫁狗隨狗”)
原子序數為奇數的元素,原子的最外層電子數為奇數,族序數為奇數,其主要化合價也多為奇數,如氯元素。原子序數為偶數的元素,原子的最外層電子數為偶數,族序數為偶數,其主要化合價也常為偶數,如硫元素。
知識鏈接4單核微粒半徑大小比較規律
(1)同一周期元素從左至右(稀有氣體元素除外),原子半徑漸小。
(2)同一主族元素自上而下,電子層數增多,原子半徑漸大。
(3)電子層結構相同的粒子,核電荷數越大,半徑越小。
(4)同種元素的陰離子半徑大于其原子半徑、陽離子半徑小于其原子半徑。
類型五:元素周期表的結構
例5若把長式元素周期表原先的主、副族及族號取消,由左至右改為18列,ⅠA族為第1列,0族為第18列。按此規定,下列說法錯誤的是()。
A.第9列元素中沒有非金屬元素B.只有第2列元素原子最外層有2個電子
C.第1列元素均為金屬元素D.在整個18列元素中,第3列的元素種類最多
解析盡管主、副族及族號取消,但每種元素在周期表中的位置不變,答題時應克服思維定式,根據題目中給出的信息和元素周期表的結構進行解答。
答案BC
總結升華解決此類問題,關鍵是了解元素周期表的結構,明確族序數與原子序數的關系。

?
知識鏈接5推斷原子序數的方法
(1)同周期時,要特別注意ⅡA族和ⅢA族元素原子
(2)A、B為同主族元素,A所在周期有m種元素,B所在周期有n種元素,A在B的上一周期,設A的原子序數為a
a.若A、B在ⅠA族、ⅡA族(過渡元素左邊),則B的原子序數為(a+m);
b.若A、B在ⅢA~ⅦA族(過渡元素右邊),則B的原子序數為(a+n)。
類型六:同周期、同主族元素性質的遞變規律
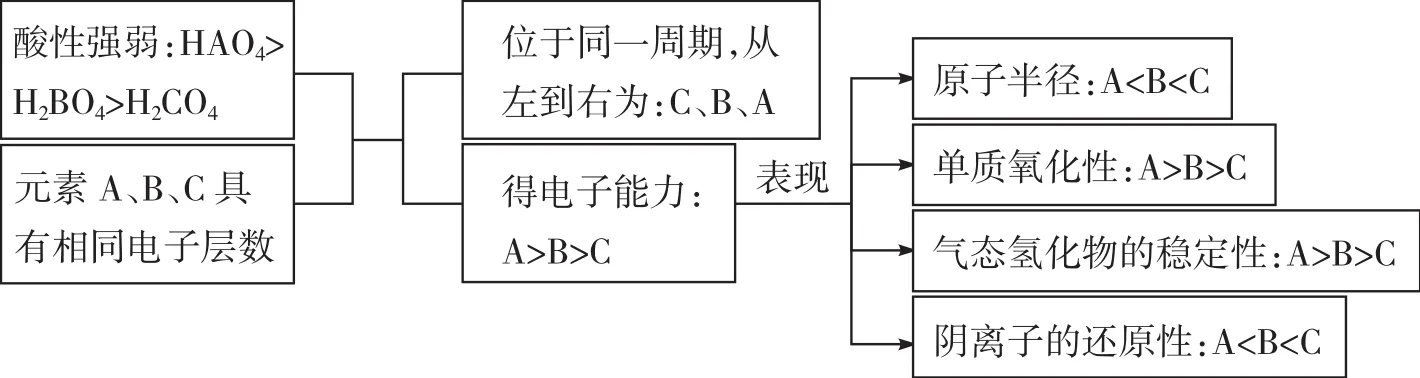
例6具有相同電子層數的A、B、C三種元素,已知它們最高價氧化物對應水化物的酸性強弱的順序是HAO4>H2BO4>H3CO4,則下列判斷正確的是()。
A.原子半徑:A>B>CB.單質的氧化性:A>B>C
C.氣態氫化物的穩定性:A 解析 答案BD 總結升華解答此類題目,一般先要根據性質判斷元素在元素周期表中的位置,進而根據元素性質、位置與結構的關系進行解答。 知識鏈接6元素性質、位置與結構的關系 (1)同一周期元素從左至右(位置),隨著核電荷數增多(結構),原子半徑減小,失電子能力減弱,得電子能力增強;金屬性減弱、非金屬性增強(性質)。 (2)同一主族元素從上往下(位置),隨著核電荷數增多,電子層數增多(結構),原子半徑增大,失電子能力增強,得電子能力減弱;金屬性增強、非金屬性減弱(性質)。 知識鏈接7元素原子得失電子能力(金屬性、非金屬性)強弱的判斷方法 (1)元素原子失電子能力(元素金屬性)強弱的判斷方法 ①根據物質的性質 a.比較其單質與水(或酸)反應置換出氫的難易程度(如劇烈程度等):置換反應越容易進行,元素原子的失電子能力越強; b.比較其最高價氧化物對應的水化物的堿性強弱:一般情況下,堿性越強,其原子失電子的能力越強; c.單質間的置換反應:一般失電子能力強的元素能把失電子能力弱的元素從其鹽溶液中置換出來。 ②根據元素在元素周期表中的位置,利用元素周期律 同一周期從左到右,元素原子失電子能力逐漸減弱;同一主族從上到下,元素原子失電子能力逐漸增強。 (2)元素原子得電子能力(元素非金屬性)強弱的判斷方法 ①根據物質的性質 a.比較其單質與氫氣化合的難易程度(如反應的劇烈程度或對反應條件的要求)以及氣態氫化物的穩定性。一般情況下,反應越容易進行,生成的氣態氫化物越穩定,元素原子得電子的能力越強; b.比較其最高價氧化物對應的水化物(最高價含氧酸)的酸性強弱:一般情況下,酸性越強,元素原子得電子的能力越強; c.利用單質間的置換反應:得電子能力強的元素能把得電子能力弱的元素從其鹽溶液中置換出來; d.利用其簡單陰離子還原性的強弱:簡單陰離子還原性越強,其原子得電子能力就越弱; e.利用不同非金屬單質與同一金屬單質反應的劇烈程度或產物中金屬化合價的高低:一般情況下,反應越劇烈或生成物中金屬化合價越高,則其原子得電子能力越強。 ②根據元素在元素周期表中的位置,利用元素周期律 同一周期從左到右,元素原子得電子能力逐漸增強;同一主族從上到下,元素原子得電子能力逐漸減弱。 類型七:化學鍵 例7已知元素X、Y和Z可結合形成化合物XYZ3,X、Y和Z的原子序數之和為26,Y和Z在同一周期。下列有關推測正確的是()。 A.XYZ3是一種可溶于水的酸,且X與Y可形成共價化合物XY B.XYZ3是一種微溶于水的鹽,且X與Z可形成離子化合物XZ C.XYZ3是一種易溶于水的鹽,且Y與Z可形成離子化合物YZ D.XYZ3是一種離子化合物,且Y與Z可形成離子化合物YZ3 解析首先根據題干中的限制條件及物質XYZ3的類別,推測XYZ3中可能存在的元素,然后分析X、Y、Z形成化合物的類別。 答案B 總結升華解答此類題目,首先判斷X、Y和Z所代表的具體元素,再根據化學鍵、離子化合物、共價化合物的概念,對A、B、C、D逐一進行分析即可。 原子結構理論是學習元素周期律、認識元素周期表的結構、建立化學鍵概念的理論基礎;元素周期律和元素周期表的學習能進一步發展我們對元素化合物性質的認識;化學鍵概念的建立,也為我們今后學習有機化學知識打下基礎。