抑制AMPK激活對腦缺血小鼠行為學和腦梗死體積的影響*
馬毓黨輝補娟景燕李紅燕朱沂
抑制AMPK激活對腦缺血小鼠行為學和腦梗死體積的影響*
馬毓①黨輝①補娟①景燕①李紅燕①朱沂①
目的:探討抑制磷酸腺苷活化蛋白激酶(AMPK)激活對腦缺血小鼠行為和腦梗死體積的影響。方法:選取雄性昆明小鼠66只,隨機分為假手術組、鹽水對照組及藥物干預組,每組22只。藥物干預組在缺血時腹腔注射AMPK特異性抑制劑Compound C(20 mg/kg),采用線栓法制作大腦中動脈栓塞/再灌注模型,鹽水對照組在相同時間給予等量0.9%氯化鈉注射液腹腔注射,假手術組不給予任何藥物。再灌注24 h后對小鼠進行神經功能評分,TTC染色觀察腦梗死體積,Westem-Blot法檢測缺血側大腦中pAMPK蛋白表達。結果:假手術組無神經功能缺損和腦梗死灶,腦組織有少量pAMPK蛋白表達,包括皮質(0.700±0.197)和海馬(0.690±0.228);腦缺血再灌注損傷后,鹽水對照組小鼠神經功能評分(2.63±0.52)分,腦梗死體積(49.57±9.71)%,缺血側腦組織pAMPK蛋白包括皮質(1.410±0.322)和海馬(1.510±0.418),均較假手術組增高(P<0.05);藥物干預組神經功能評分(1.88±0.64)分,腦梗死體積(24.07±7.74)%,缺血側腦組織中pAMPK蛋白包括皮質(0.930±0.229)和海馬(0.960±0.378),均較鹽水對照組降低(P<0.05)。結論:小鼠腦缺血再灌注損傷后,缺血側腦組織中AMPK被激活,抑制AMPK激活具有神經保護作用。
腦缺血再灌注損傷; 磷酸腺苷活化蛋白激酶; 神經保護
First-author's address:The People's Hospital of Xinjiang Uygur Autonomous Region,Urumqi 830001,China
腦梗死(cerebral infarction,CI)是指多種因素引起腦部血流受阻,相應血供障礙的腦組織出現不可逆損傷,最終導致局部腦組織發生缺血缺氧性壞死,是常見于中老年人的腦血管疾病,腦梗死占所有腦卒中的87%[1]。腦血管堵塞引發復雜的缺血誘導事件,包括細胞能量耗竭、代謝應激、離子穩態失衡、興奮性氨基酸毒性、梗死灶周邊去極化、脂質過氧化、錯誤蛋白合成、DNA損傷和細胞凋亡等[2-3]。缺氧引起細胞代謝急劇下降,抑制相關能源依賴途徑,破壞神經膠質細胞膜、血管內皮和脈絡膜內皮間穩定的溶質梯度,以上最終導致不可逆神經損傷[4]。腦梗死是能量衰竭始發的能量代謝障礙性疾病,能夠感知能量失衡的分子對減輕腦缺血損傷至關重要[5]。
磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)是進化上保守的絲氨酸/蘇氨酸蛋白激酶,是異質三聯體,包含α催化亞基(α1、α2)和β、γ調節亞基(β1、β2、γ1、γ2、γ3),通過α亞基上蘇氨酸-172的磷酸化被激活[6-7]。AMPK是許多生物(從酵母到哺乳動物)關鍵的能量監控器,也是細胞能量平衡的關鍵調節器,當細胞能量供應缺乏時,AMPK被激活[8-9]。在細胞水平,激活AMPK通過抑制消耗ATP的合成代謝途徑,同時激活產生ATP的分解代謝途徑維持能量儲備,啟動級聯反應確保代謝適應和細胞生存力[10]。在外周,AMPK調節細胞新陳代謝,減少能量儲備,增加能量利用,為能源不足細胞提供ATP[11]。此外,AMPK也是主要代謝轉換器,控制細胞和整體能量平衡,有研究表明AMPK通過與線粒體生物發生、蛋白質合成和降解途徑的相互作用在細胞生長中發揮重要作用[12]。因此,已將靶向AMPK治療糖尿病、肥胖、癌癥和心血管病等多種疾病。中樞神經系統神經元、神經膠質細胞和血管內皮細胞中均有AMPK表達,AMPK在中樞神經系統廣泛分布的特點為其成為有效神經保護靶標提供重要生物學基礎[13-15]。有研究已經提出AMPK代表內源性的神經保護通路,該信號通路在腦卒中病理生理過程中發揮重要作用[16]。在本研究中,筆者制作小鼠腦缺血再灌注模型,檢測缺血側腦組織中AMPK蛋白表達,觀察抑制AMPK后小鼠的行為結局和腦梗死體積,現報道如下。
1 材料與方法
1.1動物分組和處理 清潔級健康成年雄性昆明小鼠66只,體重25~30 g,由新疆實驗動物研究中心提供(許可證號:SCXK新2011-0001)。按照隨機數字表法將其分為假手術組、鹽水對照組(腦缺血再灌注損傷模型組)、藥物干預組(Compound C給藥組),每組22只。藥物干預組小鼠在造模、線栓剛插入時立即腹腔注射AMPK特異性抑制劑Compound C,即6-{4-[2-(1-哌啶基)乙氧基]苯基}-3-(4-吡啶基)吡唑并[1,5-A]嘧啶20 mg/kg(美國Sigma公司),鹽水對照組在相同時間點給予等量生理鹽水腹腔注射,假手術組則不予任何藥物[17]。
1.2方法
1.2.1制作動物模型 采用改良線栓法制作短暫性右側大腦中動脈栓塞模型[18]。應用氯胺酮復合麻醉劑(氯胺酮、安定、阿托品按2∶1∶1配伍,0.9%氯化鈉注射液稀釋至15 mL,新疆醫科大學一附院動物實驗研究中心)以1.5~2 mL/kg體重腹腔注射麻醉小鼠。沿頸部正中線縱行剪開2 cm切口,暴露右側頸總動脈、頸外動脈及頸內動脈,在頸外動脈遠端距分叉處約6 mm處斜剪一切口,將0.22 mm硅膠線栓(北京沙東生物技術有限公司生產)緩慢插入,沿頸內動脈向前推進約10 mm,有輕微阻力時則停止進入,此時開始記錄缺血時間,缺血60 min后,緩慢拔出線栓恢復血流再灌注,縫合手術切口。小鼠清醒后出現對側肢體偏癱,表示模型制作成功。假手術組僅分離頸總、頸外和頸內動脈,不插入線栓,術中控制小鼠體溫在37 ℃左右。
1.2.2神經功能評分 再灌注24 h后,按Longa等[19]方法對各組小鼠進行神經功能評分。評分標準如下:0分:無神經功能缺損征象;1分:缺血對側前肢內收;2分:行走時向癱瘓側轉圈;3分:行走時向癱瘓側傾倒;4分:不能自發行走、意識喪失或死亡。1~3分為模型成功,0、4分及出現癲癇發作、取材時發現腦出血者均予剔除并隨機補充。
1.2.3腦梗死體積測定 再灌注24 h后,頸椎脫臼法處死小鼠,速取腦組織,置入-20 ℃冰箱速凍10 min,離額極2 mm向后連續等距切取4個冠狀腦片,間距2 mm,將切片放進1%的 2,3,5-氯化三苯基四氮唑(TTC,美國Sigma公司)磷酸鹽緩沖液中,37 ℃恒溫箱避光孵育20 min,再在4%多聚甲醛(美國Gibco公司)液中固定2 h,數碼相機照相。正常腦組織染成紅色,梗死組織為白色。采用Image pro plus 5.0軟件測量梗死面積,計算梗死灶體積:V=∑(S1+S2)×d/2,V為總體積;S1、S2分別表示切片頭側和尾側面積;d為切片厚度。為除去患側腦水腫因素,腦梗死體積(%)=腦梗死體積/非梗死側大腦半球體積×100%。
1.2.4Westem-Blot法檢測缺血側腦組織中AMPK和磷酸化的AMPK(pAMPK)蛋白表達 再灌注24 h后,處死小鼠,速取腦組織在冰上分離缺血側腦皮質和海馬,分別置于細胞裂解液中低溫勻漿、離心、取上清,置-80 ℃冰箱保存。用BCA蛋白定量試劑盒(江蘇海門碧云天生物試劑有限公司)測定蛋白濃度,行SDS-PAGE電泳,再用蛋白轉移裝置將蛋白轉移到PVDF膜上。AMPK、pAMPK(Thr172)和β-actin用相應抗體檢測,β-actin為內參照。加入一抗[pAMPK(Thr172)(1∶1000,美國CST公司)、AMPK(1∶1000,美國CST公司)、β-actin(1∶5000,武漢博士德生物工程有限公司)]溶液,4 ℃孵育過夜,將PVDF膜移入TBST溶液(包含4%牛血清白蛋白和0.1% Tween-20)中,室溫下輕振蕩10 min;再將膜置于二抗[羊抗兔IgG(1∶5000,武漢博士德生物工程有限公司)]溶液中孵育,最后用ECL化學發光試劑盒(江蘇海門碧云天生物試劑有限公司)顯色。測定每一條帶灰度值,用pAMPK(Thr172)灰度值/AMPK灰度值表示pAMPK蛋白相對表達量。
1.3統計學處理 使用SPSS 17.0軟件對所得數據進行統計學分析,計量資料以(±s)表示,多組間比較用單因素方差分析,組間兩兩比較用LSD法,以P<0.05為差異有統計學意義。
2 結果
2.1小鼠腦缺血再灌注損傷后缺血側腦組織中pAMPK蛋白表達 假手術組小鼠腦組織中有少量pAMPK蛋白表達,包括皮質(0.700±0.197)和海馬(0.690±0.228),鹽水對照組包括皮質(1.410±0.322)和海馬(1.510±0.418),和假手術組相比pAMPK蛋白表達明顯增加,比較差異有統計學意義(皮質:P=0.000;海馬:P=0.000);給予20 mg/kg Compound C干預后,可顯著抑制pAMPK蛋白水平,包括皮質(0.930±0.229)和海馬(0.960±0.378),與鹽水對照組比較差異有統計學意義(皮質:P=0.005;海馬:P=0.017)。三組間比較皮質和海馬pAMPk蛋白表達比較差異均有統計學意義(F1=12.000,F2=8.530;P1=0.001,P2=0.003),各組小鼠腦皮質和海馬區pAMPK蛋白表達見圖1、2。

圖1 各組小鼠缺血側大腦皮質中pAMPK蛋白表達

圖2 各組小鼠缺血側腦海馬中pAMPK蛋白表達
2.2神經功能評分 假手術組小鼠未出現神經功能缺損癥狀,評分0分;鹽水對照組小鼠可見明顯神經功能缺損癥狀,如Horner征,左側前肢無力,行走時身體向左側旋轉,甚至徹底向左側跌倒或不能行走,提尾時左前肢屈曲,評分(2.63±0.52)分;藥物干預組小鼠僅出現輕微神經功能缺損癥狀,表現不能完全伸展左側前爪或爬行時向左側傾斜,評分(1.88±0.64)分。藥物干預組神經功能評分與鹽水對照組比較顯著降低,比較差異有統計學意義(P=0.005)。三組間比較差異有統計學意義(F=64.658,P=0.000),各組小鼠神經功能評分見圖3。
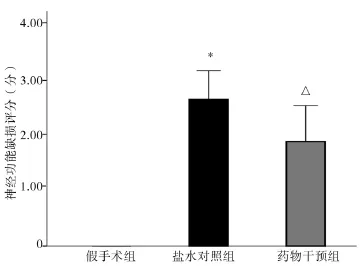
圖3 各組小鼠神經功能缺損評分
2.3腦梗死體積 再灌注24 h后,假手術組小鼠TTC染色腦組織完全紅染,無肉眼可見梗死灶,組織結構清晰;鹽水對照組和藥物干預組小鼠TTC染色后均可見腦組織蒼白色梗死灶,內部結構消失,腫脹明顯,部位主要累及大腦中動脈供血區(包括皮質和海馬),腦梗死體積分別為(49.57±9.71)%與(24.07±7.74)%,與鹽水對照組比較,藥物干預組腦梗死體積顯著縮小,比較差異有統計學意義(P=0.006)。三組間比較差異有統計學意義(F=39.959,P=0.000),各組小鼠腦組織TTC染色及腦梗死體積比較分別見圖4、5。

圖4 各組小鼠腦梗死體積(TTC染色)

圖5 各組小鼠腦梗死體積比較
3 討論
缺血性腦卒中是一個嚴重的能量缺乏狀態,乳酸積聚、自噬和再灌注期間失調的葡萄糖轉運蛋白導致的葡萄糖增加都會加重卒中損傷,在缺血缺氧性腦損傷早期,以能量代謝障礙為中心環節[11]。磷酸腺苷活化蛋白激酶(AMPK)是關鍵的應激與代謝感受器,涉及許多調解途徑,位于多個代謝通路的交叉點,對于調解能量平衡有非常重要的作用,故AMPK在缺血性腦卒中中的重要性已逐漸得到重視[20]。
筆者應用小鼠腦缺血再灌注模型,在缺血1 h、再灌注24 h后,應用Westem-Blot法檢測小鼠缺血側腦組織中pAMPK蛋白表達,結果顯示pAMPK蛋白水平顯著升高,即AMPK被過度激活,小鼠出現明顯神經功能缺損癥狀,大片腦梗死灶形成,說明AMPK激活在缺血腦中是有害的。
腦梗死發生時,氧糖缺乏導致神經元細胞遭受興奮性毒性和氧化損傷,在修復損傷過程中,許多能量消耗過程(如一連串的氧化和細胞死亡路徑)被激活,這些途徑過度激活導致完全的能量衰竭,ATP減少,同時AMP增加,能量衰竭是啟動腦梗死神經元損傷的主要因素。AMPK通過AMP感覺能量水平變化,激活能源恢復過程,抑制能源消耗過程,通過調節一系列分解代謝和合成代謝過程適應細胞的新陳代謝[21]。然而,作為機體針對缺血應激的代償性反應,有研究指出過度的AMPK激活可能在應激條件下具有不利作用[22]。缺血情況下,腦組織ATP供應不能滿足需要,ATP/AMP降低,AMPK在腦中迅速激活,最初的AMPK激活旨在恢復缺血腦中的能量平衡,然而細胞死亡啟動后,試圖進一步從代謝受損的細胞中產生ATP只會導致損傷惡化和更嚴重的代謝障礙,AMPK激活可促成病理條件下(包括卒中和AD)的神經元細胞死亡[23-24]。AMPK是糖酵解強烈刺激素,大腦中AMPK作為能量感受器,在應對增加的代謝應激時激活糖酵解,進而在缺血腦卒中產生乳酸鹽,缺血誘導的AMPK激活通過增加卒中誘導的乳酸酸中毒加重卒中損傷[25-26]。有研究表明,NMDA或谷氨酸興奮性毒性引起初級皮層或小腦顆粒細胞中AMPK激活,長時間的AMPK活化可同時激活ATP相關的細胞死亡過程——興奮性毒性的凋亡,增加促凋亡Bcl-2家族成員bim(參與凋亡和線粒體去極化的關鍵蛋白)的轉錄活性,導致神經元生存力逐步喪失[27]。AMPK活性增加是啟動自噬級聯反應的關鍵信號,可以激活自噬,研究表明自噬促進缺血后神經細胞死亡[28-29]。
為了解抑制AMPK激活在缺血腦卒中的效應,筆者給予AMPK特異性抑制劑Compound C干預,結果顯示缺血側腦組織中pAMPK蛋白表達顯著減少,即抑制了AMPK激活。另外,小鼠神經功能評分顯著降低,腦梗死體積明顯縮小,表明在缺血條件下抑制AMPK激活可以減輕腦卒中損傷。以上結果強烈支持筆者關于抑制缺血腦卒中AMPK過度活化發揮神經保護效應的假設。
Zhang等[30]發現在H2O2處理的SH-SY5Y細胞中AMPK和pAMPK的表達顯著上調,這是一個自我代償反應,減少能量利用,增加能量產生。然而,體外過度AMPK激活對SH-SY5Y細胞是有害的,抑制AMPK激活可以抑制氧化應激,增加細胞抗應激能力。另外,有研究證實谷氨酸在HT22細胞中誘導AMPK活性增加,AMPK活化促成谷氨酸氧化毒性誘導的神經元細胞死亡,抑制AMPK激活能保護神經元免受氧化毒性損傷[31]。當沙鼠前腦缺血后,海馬CA1區中AMPK被瞬時磷酸化,抑制AMPK激活通過減少海馬CA1區中ATP損耗和乳酸積聚保護神經元免受缺血缺氧性損傷[32]。在缺血性腦卒中急性能量缺失階段,抑制AMPK活性可能誘導一種“神經元冬眠”形式,和低溫的作用機制一樣,減少能量需求和隨后的代謝衰竭,可能延長再灌注治療的時間窗[33]。AMPK激活導致Kif5軸突動力蛋白驅動蛋白輕鏈磷酸化,破壞了它和磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)的聯系,故PI3K不能靶向軸突末梢,使軸突極化和生長被抑制[34-35]。AMPK激活抑制缺血事件后的軸突發生,急性抑制AMPK激活則對卒中發揮保護作用。AMPK信號參與腦缺血預處理,溫和短暫的代謝應激通過緩慢減少AMPK活性導致神經元發生代謝耐受效應[36]。文獻[37]指出,在小鼠局灶性腦缺血模型中,腦組織中AMPK活性增加,基因敲除法抑制AMPK活性具有神經保護作用,這與本研究結果一致。
綜上所述,AMPK活性增強對腦組織的作用是復雜的,AMPK激活的持續時間是卒中結局的關鍵決定因素[38]。筆者研究證實缺血性腦卒中后立即抑制卒中誘導的AMPK過度活化能夠減輕腦卒中損傷,具有顯著神經保護作用,建議AMPK可能是缺血性腦卒中治療的一個有前景的新靶點。
[1] Truong D T,Venna V R,McCullough L D,et al.Deficits in auditory,cognitive,and motor processing following reversible middle cerebral artery occlusion in mice[J].Exp Neurol,2012,238(2):114-121.
[2] Moskowitz M A,Lo E H,Iadecola C.The science of stroke:mechanisms in search of treatments[J].Neuron,2010,67(2):181-198.
[3] Miao Y,Liao J K.Potential serum biomarkers in the pathophysiological processes of stroke[J].Expert Rev Neurother,2014,14(2):173-185.
[4] Khanna A,Kahle K T,Walcott B P,et al.Disruption of ion homeostasis in the neurogliovascular unit underlies the pathogenesis of ischemic cerebral edema[J].Transl Stroke Res,2014,5(1):3-16.
[5] Hardie D G,Ross F A,Hawley S A.AMPK:a nutrient and energy sensor that maintains energy homeostasis[J].Nat Rev Mol Cell Biol,2012,13(4):251-262.
[6] Weisová P,Dávila D,Tuffy L P,et al.Role of 5-adenosine monophosphate-activated protein kinase in cell survival and death responses in neurons[J].Antioxid Redox Signal,2011,14(10):1863-1876.
[7] Oakhill J S,Steel R,Chen Z P,et al.AMPK is a direct adenylate charge-regulated protein kinase[J].Science,2011,330(6036):1433-1435.
[8] Carling D,Thornton C,Woods A,et al.AMP-activated protein kinase:new regulation,new roles[J].Biochem J,2012,445(1):11-27.
[9] Hardie D G,Ashford M L.AMPK:Regulating energy balance at the cellular and whole body levels[J].Physiology,2014,29(2):99-107.
[10] Bungard D,Fuerth B J,Zeng P Y,et al.Signaling kinase AMPK activates stress-promoted transcription via histone H2B phosphorylation[J].Science,2010,329(5996):1201-1205.
[11] Li J,McCulough L D.Effects of AMP-activated protein kinase in cerebral ischemia[J].J Cereb Blood Flow Metab,2010,30(3):480-492.
[12] Luo Z,Zang M,Guo W.AMPK as a metabolic tumor suppressor:control of metabolism and cell growth[J].Future Oncol Mar,2010,6(3):457-470.
[13] Bright N J,Thornton C,Carling D.The regulation and function of mammalian AMPK-related kinases[J].Acta Physiol,2009,196(1):15-26.
[14] Manwani B,McCullough L D.Function of the master energy regulator adenosine monophosphate-activated protein kinase in stroke[J].J Neurosci Res,2013,91(8):1018-1029.
[15] Osuka K,Watanabe Y,Usuda N,et al.Modification of endothelial nitric oxide synthase through AMPK after experimental subarachnoid hemorrhage[J].J Neurotrauma,2009,26(7):1157-1165.
[16] Kuramoto N,Wilkins M E,Fairfax B P,et al.Phosphodependent functional modulation of GABA(B) receptors by the metabolic sensor AMP-dependent protein kinase[J].Neuron,2007,53(2):233-247.
[17] Li J,Zeng Z,Viollet B,et al.Neuroprotective effects of adenosine monophosphate-activated protein kinase inhibition and gene deletion in stroke[J].Stroke,2007,38(11):2992-2999.
[18] Luo C X,Zhu X J,Zhou Q G,et al.Reduced neuronal nitric oxide synthase is involved in ischemia-induced hippocampal neurogenesis by up-regulating inducible nitric oxide synthase expression[J].J Neurochem,2007,103(5):1872-1882.
[19] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[20] Du L,Hickey R W,Bayir H,et al.Starving neurons show sex difference in autophagy[J].J Biol Chem,2009,284(4):2383-2396.
[21] Hardie D G.AMP-activated protein kinase:an energy sensor that regulates all aspects of cell function[J].Genes Dev,2011,25(18):1895-1908.
[22] Zheng S,Li W,Xu M,et al.Calcitonin gene-related peptide promotes angiogenesis via AMP-activated protein kinase[J].Am J Physiol Cell Physiol,2010,299(6):C1485-C1492.
[23] Venna V R,Li J,Benashski S E,et al.Preconditioning induces sustained neuroprotection by downregulation of adenosine 5-monophosphate-activated protein kinase[J].Neuroscience,2012,201(15):280-287.
[24] Kwon K J,Kim H J,Shin C Y,et al.Melatonin potentiates the neuroprotective properties of resveratrol against beta-amyloidinduced neurodegeneration by modulating amp-activated protein kinase pathways[J].J Clin Neurol,2010,6(3):127-137.
[25] Kahn B B,Alquier T,Carling D,et al.AMP-activated protein kinase:ancient energy gauge provides clues to modern understanding of metabolism[J].Cell Metab,2005,1(1):15-25.
[26] Yu L,Yang S J.AMP-activated protein kinase mediates activitydependent regulation of peroxisome proliferator-activated receptor gamma coactivator-1α and nuclear respiratory factor 1 expression in rat visual cortical neurons[J].Neuroscience,2010,169(1):23-38.
[27] Concannon C G,Tuffy L P,Weisová P,et al.AMP kinasemediated activation of the BH3-only protein Bim couples energy depletion to stress-induced apoptosis[J].J Cell Biol,2010,189(1):83-94.
[28] Egan D F,Shackelford D B,Mihaylova M M,et al. Phosphorylation of ULK1(hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy[J].Science,2011,330(6016):456-461.
[29] Wang W,Guan K L.AMP-activated protein kinase and cancer[J].Acta Physiol,2009,196(1):55-63.
[30] Zhang H A,Gao M,Zhang L,et al.Salvianolic acid a protects human SH-SY5Y neuroblastoma cells against H2O2-induced injury by increasing stress tolerance ability[J].Biochem Biophys Res Commun,2012,421(3):479-483.
[31] Jia J,Xiao Y,Wang W,et al.Differential mechanisms underlying neuroprotection of hydrogen sulfide donors against oxidative stress[J].Neurochem Int,2013,62(8):1072-1078.
[32] Nam H G,Kim W,Yoo D Y,et al.Chronological changes and effects of AMP-activated kinase in the hippocampal CA1 region after transient forebrain ischemia in gerbils[J].Neurol Res,2013,35(4):395-405.
[33] Li J,Benashski S,McCullough L D.Post-stroke hypothermia provides neuroprotection through inhibition of AMP-activated protein kinase[J].J Neurotrauma,2011,28(7):1281-1288.
[34] Amato S,Liu X,Zheng B,et al.AMP-activated protein kinase regulates neuronal polarization by interfering with PI 3-kinase localization[J].Science,2011,332(6026):247-251.
[35] Vingtdeux V,Chandakkar P,Zhao H,et al.Novel synthetic small-molecule activators of AMPK as enhancers of autophagy and amyloid-beta peptide degradation[J].FASEB J,2011,25(1):219-231.
[36] Avraham Y,Davidi N,Lassri V,et al.Leptin induces neuroprotection neurogenesis and angiogenesis after stroke[J].Curr Neurovasc Res,2011,8(4):313-322.
[37] Izumi Y,Shiota M,Kusakabe H,et al.Pravastatin accelerates ischemia-induced angiogenesis through AMP-activated protein kinase[J].Hypertens Res,2009,32(8):675-679.
[38] Li J,Benashski S E,Venna V R,et al.Effects of metformin in experimental stroke [J].Stroke,2010,41(11):2645-2652.
The Impact of Inhibiting Adenosine Monophosphate Activated Protein K inase on the Behavior and Cerebral Infarction Volume of Mice after Cerebral Ischemia
MA Y u,DANG Hui,BU J uan,et al.// Medical Innovation of China,2016,13(28):001-006
Objective:To discuss the impact of inhibiting adenosine monophosphate activated protein kinase(AMPK) on the behavior and cerebral infarction volume of mice after cerebral ischemia.Method:Sixtysix male Kunming mice were randomly divided into the sham operation group,saline control group and drug intervention group,each group had 22 mice.The AMPK specific inhibitor Compound C(20 mg/kg)was injected intraperitoneally in the drug intervention group during the time of ischemia,the middle cerebral artery occlusion/ reperfusion model was made by thread embolism method,saline control group was given intraperitoneal injection of normal saline at the same time and the sham operation group did not give any drugs.After reperfusion for 24 h,the neurological function score was evaluated in mice,TTC staining was used to observe the volume of cerebral infarction and Westem-Blot method was used to detect the expression of pAMPK protein in the ischemic side of the brain.Result:There were no neurologic impairments and cerebral infarctions in the sham operation group,there was a small amount of pAMPK protein expression includes cortex(0.700±0.197) and hippocampus(0.690±0.228).After cerebral ischemia reperfusion injury,the neurological function score were(2.63±0.52)in the saline control group,the volume of cerebral infarction was(49.57±9.71)%,ischemia side brain tissue pAMPK protein includes the cortex(1.410±0.322) and the hippocampus (1.510±0.418),were higher than those of the sham operation group(P<0.05).The neurological function scores were(1.88±0.64)in the drug intervention group,the volume of cerebral infarction was(24.07±7.74)%,ischemia side brain tissue pAMPK protein includes the cortex(0.930±0.229) and the hippocampus (0.960±0.378),were lower than those of the saline control group(P<0.05).Conclusion:After cerebral ischemia reperfusion injury,AMPK is overactivated in ischemic brain,inhibiting AMPK plays neuroprotective effect.
Cerebral ischemia reperfusion injury; AMP-activated protein kinase; Neuroprotection
新疆維吾爾自治區自然科學基金(2014211A057)
①新疆維吾爾自治區人民醫院 新疆 烏魯木齊 830001
朱沂
10.3969/j.issn.1674-4985.2016.28.001
(2016-06-16) (本文編輯:李穎)

