脾絡氨酸激酶-核因子κB 調控口腔癌相關巨噬細胞中癌痛相關環氧化酶2的機制研究
林潔王淼吉陽劉樂高攀李春潔
1.口腔疾病研究國家重點實驗室 華西口腔醫院口腔麻醉科(四川大學);2.頭頸腫瘤外科,成都 610041
脾絡氨酸激酶-核因子κB 調控口腔癌相關巨噬細胞中癌痛相關環氧化酶2的機制研究
林潔1王淼1吉陽1劉樂1高攀2李春潔2
1.口腔疾病研究國家重點實驗室 華西口腔醫院口腔麻醉科(四川大學);2.頭頸腫瘤外科,成都 610041
目的 通過體外原代巨噬細胞誘導以及分子生物學的方法,探究口腔癌相關巨噬細胞環氧化酶2(COX-2)上調的機制。方法 構建小鼠原代巨噬細胞,使用Cal27條件培養基(CM)刺激誘導形成口腔癌相關巨噬細胞,使用免疫熒光檢測原代巨噬細胞的純度。使用小分子抑制劑分別抑制脾絡氨酸激酶(Syk)及核因子κB(NFκB)通路。使用實時定量聚合酶鏈反應(PCR)、Western blot檢測COX-2及信號通路相關蛋白的變化。結果 所誘導的原代巨噬細胞均特異性表達CD68蛋白。Cal27 CM刺激能夠顯著提高COX-2的表達(P<0.001);抑制Syk的磷酸化即能夠進一步抑制NFκB-P65的磷酸化,從而導致COX-2的表達顯著降低(P<0.01);而抑制NFκB-P65的磷酸化不能抑制Syk的磷酸化但可以顯著降低COX-2的表達(P<0.01)。結論 Syk-NFκB信號通路導致COX-2在口腔癌相關的巨噬細胞中高表達,靶定該信號通路可能是控制口腔癌相關癌痛的新方向。
癌痛; 口腔癌; 環氧化酶2; 巨噬細胞
對于口腔癌患者來說,癌痛是常見的臨床癥狀,其主要原因是由于口腔處于身體淺表且感覺靈敏,加之口腔是重要的功能性部位,因此,早期且劇烈的癌性疼痛難以避免[1]。傳統的觀點認為,癌痛發生的主要因素在于腫瘤細胞釋放的細胞因子、生長因子中包含有疼痛介質進而引起疼痛,腫瘤生長、侵襲導致局部區域壓迫性的疼痛,腫瘤侵犯神經或阻塞神經滋養血管導致神經性疼痛。近些年來,隨著腫瘤微環境理論以及惡性腫瘤誘導正常間質細胞惡性演進理論的提出,研究者們認識到,不僅僅是腫瘤細胞,腫瘤間質中的其他細胞,特別是炎癥細胞是導致口腔癌相關癌性疼痛的重要組成部分[2]。
腫瘤相關的巨噬細胞是口腔癌微環境中的主要炎性細胞,其環氧化酶2(cyclooxygenase-2, COX-2)在腫瘤微環境中高表達并且介導了大量巨噬細胞疼痛因子的分泌[3]。COX-2的表達是巨噬細胞促炎能力的表現,而巨噬細胞參與炎癥主要受到核因子κB (nuclear factor κB, NFκB)、脾絡氨酸激酶(spleen tyrosine kinase,Syk)等信號通路的調節[4]。因此,本文擬通過體外原代巨噬細胞誘導以及分子生物學的方法,探究NFκB及Syk信號通路與口腔癌相關巨噬細胞COX-2上調的關系及機制,進而尋找口腔癌相關癌痛控制的新途徑。
1 材料和方法
1.1 試劑和儀器
DMEM/F12培養基、胎牛血清(fetal bovine serum,FBS)、10×PBS、胰蛋白酶(Gibco公司,美國),重組小鼠巨噬細胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)(PeproTech公司,美國),40 μm細胞濾網(BD公司,美國),兔抗鼠COX-2抗體(Santa Cruz公司,美國),異硫氰酸熒光素(fluorescein isothiocyanate,FITC)直標兔抗鼠CD68抗體(Biolegend公司,美國),鼠抗鼠磷酸甘油醛脫氫酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗體(Millipore公司,美國),鼠抗鼠Syk抗體、兔抗鼠磷酸化Syk抗體(Abcam公司,美國),鼠抗鼠p65抗體、兔抗鼠磷酸化p65抗體(Cell Signalling公司,美國),IRDey800直標羊抗兔IgG、IRDey800直標兔抗鼠IgG、IRDey800直標驢抗羊IgG(Rockland公司,美國),Bay11-7082、白皮杉醇(piceatannol,PIC)(上海Selleck公司),預染蛋白質相對分子質量標準液(Invitrogen公司,美國)。PureLink?RNA小量試劑盒(Life technologies公司,日本),逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)試劑盒(TAKARA公司,日本),Sybrgreen(Biorad公司,美國),聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(PALL公司,美國),細胞爬片器(Millipore公司,美國),Odyssey雙色紅外激光成像系統(LICOR公司,美國),Steri-Cycle 37 ℃ CO2培養箱(Thermo Scientific公司,美國),CFX96實時定量聚合酶鏈反應(polymerase chain reaction,PCR)檢測系統(Biorad公司,美國)。
1.2 細胞培養及鑒定
人舌癌Cal27細胞株由四川大學口腔疾病研究國家重點實驗室提供。使用含10%FBS的DMEM/F12培養基進行培養。提取Cal27條件培養基(conditional medium,CM)時,在細胞鋪滿80%時采用無血清的DMEM/F12培養基培養24 h后收集上清。
原代巨噬細胞的培養:麻醉下消毒C57BL/6J小鼠,取雙側股骨及脛骨,用消毒眼科剪剪開長骨兩端關節,使用PBS液反復沖洗骨髓腔,使用40 μm濾網過濾。離心收集骨髓細胞,加入9 mL蒸餾水,吹打20 s去除紅細胞,再加入1 mL 10×PBS液,再次使用40 μm濾網過濾,離心收集骨髓細胞,予50 ng·mL-1M-CSF加入含10%FBS的DMEM/F12培養基中培養,4 d后傳代,繼續予50 ng·mL-1M-CSF培養3 d,傳代后即可使用。
傳代后的巨噬細胞按照每孔8×105個鋪6孔板,貼壁后饑餓24 h,然后分別加入1∶1 000二甲基亞砜(dimethyl sulfoxide,DMSO)、0.5 μmol·L-1NFκB抑制劑Bay11-7082(DMSO溶解)或25 μmol·L-1Syk小分子抑制劑PIC(DMSO溶解)刺激1 h,再予10% Cal27上清或正常培養基刺激,24 h后收集細胞蛋白;或者于1、3、6、12、24 h后收集mRNA。或者予正常培養基、5%、10%、20%、50%Cal27上清刺激,于6 h后收集mRNA。
1.3 免疫熒光染色
將第3代巨噬細胞按照每孔5×104個的密度加入細胞爬片器中,待貼壁后予10%Cal27上清或正常培養基刺激,刺激24 h后,取出細胞爬片,予丙酮固定1 min,PBS洗凈后予5%牛血清白蛋白(bovine serum albumin,BSA)封閉1 h,然后加入FITC直標兔抗鼠CD68抗體(1∶100),常溫孵育1 h,PBS清洗,DAPI染核后封片。
1.4 實時定量PCR
按PureLink?RNA小量試劑盒提取細胞mRNA,分光光度法測定RNA濃度后調平RNA濃度,按逆轉錄說明書將mRNA逆轉錄為cDNA。使用CFX96實時定量PCR檢測系統檢測mRNA的表達量。引物由日本Life technologies公司合成。COX-2上游引物序列:5’-GCCCAGCACTTCACGCATCAG-3’;下游引物序列:5’-AGACCAGGCACCAGACCAAAGACC-3’;GAPDH上游引物序列:5’-TGCTGAGTATGTCGTGGAGTCTA-3’;下游引物序列:5’-AGTGGGAGTTGCTGTTGAAATC-3’。用各組mRNA與GAPDH的Ct值的差值表示各組mRNA的相對表達量。
1.5 Western blot
將蛋白樣品及預染蛋白質相對分子質量標準液分別上樣到十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)膠加樣孔后,使用60 V低電壓恒壓電泳,待蛋白相對分子質量標準液分離開后即更換為120 V高電壓恒壓電泳,待溴酚藍到達膠的底端處停止電泳。使用Bio-Rad的標準濕式轉膜裝置,設定轉膜電壓為120 V,轉膜時間為90 min,將蛋白轉移到PVDF膜上。用10%BSA/TBST溶液封閉1 h,然后加入靶蛋白一抗(比例1∶1 000),4 ℃孵育過夜;TBST洗膜3次后,加入相應二抗常溫孵育1 h;TBST洗膜3次后掃膜。使用ImageJ軟件進行定量分析,以GAPDH作為內參。
1.6 統計學分析
使用GraphPad Prism 5(GraphPad Software公司,美國)進行單因素及多因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 原代巨噬細胞體外培養的鑒定及口腔癌相關巨噬細胞的形態觀察
使用巨噬細胞特異的CD68標記原代巨噬細胞并進行免疫熒光染色,結果顯示,使用M-CSF培養的原代巨噬細胞純度高,且均特異性表達CD68。Cal27上清刺激24 h后,巨噬細胞變為長梭形,符合腫瘤相關巨噬細胞的形態特征[5](圖1)。
2.2 Cal27 CM刺激原代巨噬細胞上調COX-2的檢測2.2.1 時間依賴試驗結果 使用10%Cal27 CM刺激原代巨噬細胞后巨噬細胞COX-2 mRNA表達不斷上調,于6 h后達到高峰。3、6、12 h時,COX-2 mRNA較對照組相比明顯上調(P<0.001)(圖2)。
2.2.2 劑量依賴試驗結果 10%~50%Cal27 CM均能夠明顯提高COX-2 mRNA的表達(P<0.001),且10%、20%、50%的濃度之間并無顯著差異(圖3),故后續研究均采用10%Cal27 CM進行。
2.3 Syk-NFκB信號通路參與調控COX-2的表達
使用PIC以及Bay11-7082分別作用于口腔癌相關巨噬細胞,使用Western blot檢測其對COX-2的表達影響,結果顯示,PIC和NFκB抑制劑均能夠顯著降低COX-2的表達(P<0.01)(圖4)。
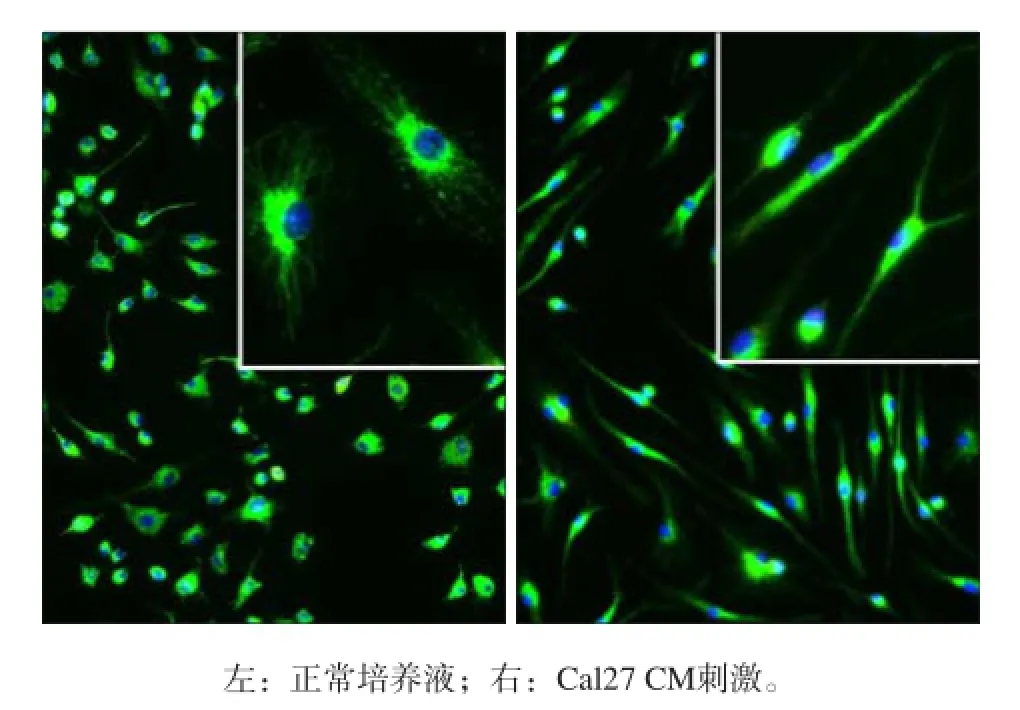
圖 1 FITC-CD68免疫熒光染色檢驗原代巨噬細胞純度 免疫熒光顯微鏡 × 200Fig 1 Purity of primarily cultured macrophage detected by FITC- CD68 immunofluorescent staining immunofluorescence microscope × 200
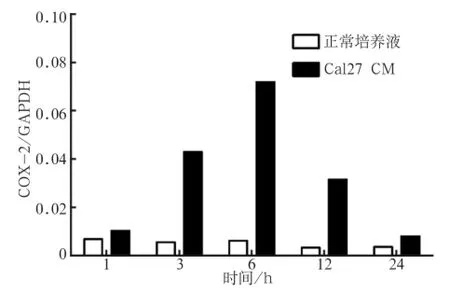
圖 2 Cal27 CM刺激后COX-2 mRNA的表達變化Fig 2 COX-2 mRNA expression after Cal27 CM stimulation
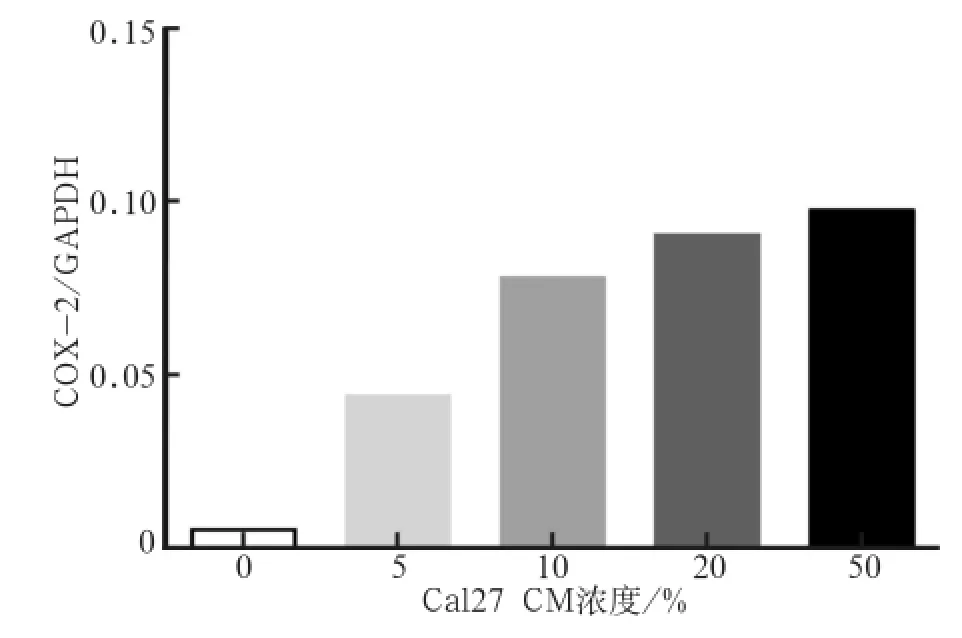
圖 3 不同濃度Cal27 CM刺激后COX-2 mRNA的表達變化Fig 3 COX-2 mRNA expression after different concentration Cal27 CM stimulation
Western blot結果顯示,使用PIC能夠顯著減少Syk的磷酸化進而達到抑制Syk信號通路的作用,同時,Syk信號通路的抑制能夠減少P65總蛋白以及磷酸化的P65。而Bay11-7082僅能夠通過抑制pP65而對pSyk及Syk無顯著作用。由此可見,在口腔癌微環境中,口腔癌相關巨噬細胞通過Syk磷酸化激活NFκB,進而導致COX-2表達上調。
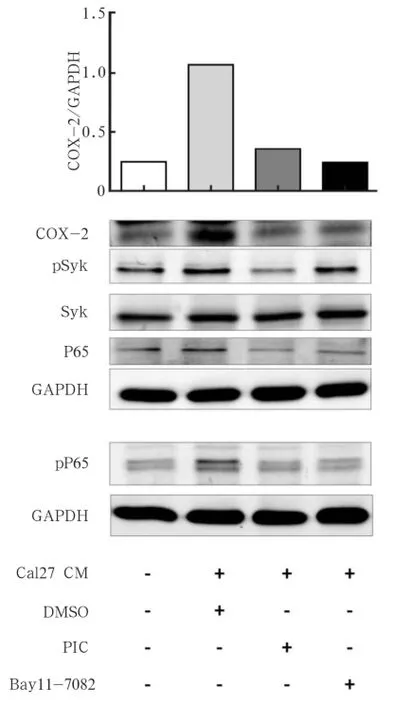
圖 4 Syk及NFκB抑制劑處理后COX-2及信號通路相關蛋白的變化Fig 4 Changes of COX-2 and pathway related proteins after Syk and NFκB inhibitor stimulation
3 討論
口腔癌引發的癌痛嚴重影響患者口腔功能,同時,使其生存質量明顯下降。雖然目前針對癌痛已有規范化的“三階梯治療”原則[6];然而,目前的治療方法對口腔癌相關癌痛的控制仍然不夠理想,并且各階梯治療方法均會給患者帶來明顯的不良反應[7]。因而,尋找口腔癌相關癌痛的新的治療方式勢在必行,而尋找有效治療方式的前提則是需要明確口腔癌相關癌痛的發生機制。
癌痛的發生發展機制仍不十分清楚,尤其在口腔癌領域,對癌痛的研究仍處于起步階段[8]。從目前的研究熱點來說,分別靶定惡性腫瘤細胞以及腫瘤微環境導致的癌痛從而尋找新的治療方式是目前研究的重點。腫瘤細胞通過間質細胞構建腫瘤微環境,進而導致腫瘤壓迫或侵犯神經,分泌疼痛因子,導致癌痛。而腫瘤本身對疼痛因子分泌較晚,而且,相對于間質細胞來說,分泌量也比較小,因此,腫瘤微環境中大量的疼痛因子主要來自于間質細胞,特別是炎癥細胞[9]。巨噬細胞是腫瘤微環境中主要的炎癥細胞之一,由于其在促進腫瘤發生發展過程中有重要的功能,因此,又名腫瘤相關巨噬細胞[10]。這些巨噬細胞是免疫-神經交互作用中十分重要的一環,因而其對于疼痛的作用也受到了學者的關注[11]。
早前的研究[12]表明,疼痛小鼠模型中的巨噬細胞被選擇性清除后,疼痛的進展明顯延緩。這說明巨噬細胞是疼痛發生和發展的必要因素。進一步的研究[13]顯示,巨噬細胞分泌的前列腺素2(prostaglandin E2,PGE2)是疼痛發生和發展過程中的重要因素,當巨噬細胞COX-2基因被選擇性敲除后,其分泌的PGE2、腫瘤壞死因子α和白細胞介素(interleukin,IL)1β等疼痛介質明顯下降,疼痛小鼠模型的檢測結果表明,巨噬細胞分泌的PGE2與疼痛顯著相關。雖然目前大量研究[14]顯示,巨噬細胞分泌的IL-18等對促進癌痛具有一定作用,然而,目前經體內外研究及臨床研究共同證實的僅有COX-2及其下游細胞因子。
巨噬細胞中的COX-2是催化花生四烯酸加氧形成PGE2的主要環節。目前控制癌痛的第一階梯治療即是通過COX抑制劑抑制COX-2功能,進而減少PGE2的產生以控制疼痛。然而,第一階梯治療往往帶來較大不良反應,因而,尋找新的途徑抑制COX-2是癌痛控制的新途徑[15]。
COX-2在腫瘤相關巨噬細胞中的高表達早已有報告,其不僅維持腫瘤相關巨噬細胞表型同時與巨噬細胞來源的疼痛因子的產生密切相關[16];然而,COX-2高表達的機制尚不十分清楚[17]。尤其是在口腔癌的研究中,尚無報告涉及口腔癌相關巨噬細胞COX-2的表達機制。
本研究通過使用小分子抑制劑對Syk及NFκB進行抑制,并通過實時定量PCR和Western blot等方式檢測巨噬細胞COX-2的表達,結果發現,抑制Syk的磷酸化即能夠進一步抑制NFκB-P65的磷酸化,從而導致COX-2的表達明顯降低;而抑制NFκB-P65的磷酸化不能抑制Syk的磷酸化但可以降低COX-2的表達。由此可見,在口腔癌微環境中,巨噬細胞通過上調Syk的磷酸化從而激活NFκB信號通路進而導致COX-2表達上調。
Syk及NFκB信號通路參與調控人體多種重要的功能,其在癌癥研究中有十分重要的地位,Syk信號通路的激活能夠顯著提升腫瘤的侵襲及轉移能力[17];NFκB的激活也與腫瘤進展密切相關[18]。而在腫瘤微環境中,Syk-NFκB構成的信號通路與癌痛密切相關,它們不僅調節COX-2的表達,同時與疼痛因子的表達及分泌密切相關;Syk一般與膜上的Fc受體結合,激活后被磷酸化,通過與CAD9結合后導致NFκB的激活并入核,從而引起下游變化;簡單抑制NFκB往往會引起較大副作用,因此,靶定Syk信號通路進而抑制其引發的NFκB的激活能夠取得更好的效果。因此,一些Syk抑制劑已被考慮運用到臨床惡性腫瘤的治療中[19]。目前,臨床上已出現靶向控制Syk信號通路激活以抑制其他疾病相關疼痛的藥物[20],因此,該通路可能為癌痛控制提供新的方向。下一步的研究需要明確引發口腔癌相關巨噬細胞COX-2上調的整個信號通路的具體情況,如明確胞外配體、包膜受體以及胞內信號傳導的具體方式,為臨床控制腫瘤相關巨噬細胞引發的癌痛提供更多的選擇。
綜上所述,本研究顯示,Syk-NFκB信號通路導致COX-2在口腔癌相關的巨噬細胞中高表達,靶定該信號通路可能是控制口腔癌相關癌痛的新方向。
[1] Reyes-Gibby CC, Anderson KO, Merriman KW, et al. Survival patterns in squamous cell carcinoma of the head and neck: pain as an independent prognostic factor for survival [J]. J Pain, 2014, 15(10):1015-1022.
[2] Schmidt BL, Hamamoto DT, Simone DA, et al. Mechanism of cancer pain[J]. Mol Interv, 2010, 10(3):164-178.
[3] Mantyh PW, Clohisy DR, Koltzenburg M, et al. Molecular mechanisms of cancer pain[J]. Nat Rev Cancer, 2002, 2(3): 201-209.
[4] Yamasaki S, Ishikawa E, Sakuma M, et al. Mincle is an ITAM-coupled activating receptor that senses damaged cells[J]. Nat Immunol, 2008, 9(10):1179-1188.
[5] Su S, Liu Q, Chen J, et al. A positive feedback loop between mesenchymal-like cancer cells and macrophages is essential to breast cancer metastasis[J]. Cancer Cell, 2014, 25(5):605-620.
[6] Kaasa S. Is cancer pain control improved by a simple WHO pain analgesic ladder approach combined with tumor-directed treatment[J]. J Clin Oncol, 2016, 34(5):399-400.
[7] Viet CT, Dang D, Ye Y, et al. Demethylating drugs as novel analgesics for cancer pain[J]. Clin Cancer Res, 2014, 20(18): 4882-4893.
[8] Connelly ST, Schmidt BL. Evaluation of pain in patients with oral squamous cell carcinoma[J]. J Pain, 2004, 5(9):505-510.
[9] Cools-Lartigue JJ, Lewandowski E, Chernin TS, et al. The expression of prostaglandin E2 (PGE2) and interleukin 6 (IL-6) in macrophage and uveal melanoma conditioned media [J]. Invest Ophthalmol Vis Sci, 2003, 44(13):1560.
[10] Noy R, Pollard JW. Tumor-associated macrophages: from mechanisms to therapy[J]. Immunity, 2014, 41(1):49-61.
[11] Ristoiu V. Contribution of macrophages to peripheral neuropathic pain pathogenesis[J]. Life Sci, 2013, 93(23):870-881.
[12] Mert T, Gunay I, Ocal I, et al. Macrophage depletion delays progression of neuropathic pain in diabetic animals[J]. Naunyn Schmiedebergs Arch Pharmacol, 2009, 379(5):445-452.
[13] Chen L. Macrophage prostaglandin E2 mediates inflammatory pain in peripheral tissues[J]. J Pain, 2013,14(4):S72.
[14] Yang Y, Li H, Li TT, et al. Delayed activation of spinal microglia contributes to the maintenance of bone cancer pain in female Wistar rats via P2X7 receptor and IL-18[J]. J Neurosci, 2015, 35(20):7950-7963.
[15] Epstein JB, Thariat J, Bensadoun RJ, et al. Oral complications of cancer and cancer therapy: from cancer treatment to survivorship[J]. CA Cancer J Clin, 2012, 62(6):400-422.
[16] Nakanishi Y, Nakatsuji M, Seno H, et al. COX-2 inhibition alters the phenotype of tumor-associated macrophages from M2 to M1 in ApcMin/+ mouse polyps[J]. Carcinogenesis, 2011, 32(9):1333-1339.
[17] Luangdilok S, Box C, Patterson L, et al. Syk tyrosine kinase is linked to cell motility and progression in squamous cell carcinomas of the head and neck[J]. Cancer Res, 2007, 67 (16):7907-7916.
[18] Nagel S, Ehrentraut S, Meyer C, et al. NFkB is activated by multiple mechanisms in hairy cell leukemia[J]. Genes Chromosomes Cancer, 2015, 54(7):418-432.
[19] Borge M, Remes Lenicov F, Nannini PR, et al. The expression of sphingosine-1 phosphate receptor-1 in chronic lymphocytic leukemia cells is impaired by tumor microenvironmental signals and enhanced by piceatannol and R406[J]. J Immunol, 2014, 193(6):3165-3174.
[20] Weinblatt ME, Kavanaugh A, Genovese MC, et al. Effects of fostamatinib (R788), an oral spleen tyrosine kinase inhibitor, on health-related quality of life in patients with active rheumatoid arthritis: analyses of patient-reported outcomes from a randomized, double-blind, placebo-controlled trial [J]. J Rheumatol, 2013, 40(4):369-378.
(本文編輯 杜冰)
In vitro investigation on the mechanism of cyclooxygenase-2 upregulation induced by spleen tyrosine kinase-nuclear factor κB signaling in cancer pain caused by oral cancer-associated macrophage
InLin Jie1, Wang Miao1, Ji Yang1, Liu Le1, Gao Pan2, Li Chunjie2.
(1. State Key Laboratory of Oral Diseases, Dept. of Dental Anesthesia, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China; 2. State Key Laboratory of Oral Diseases, Dept. of Head and Neck Oncology, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: Scientific Research Foundation for Young Teachers of Sichuan University (2014SCU11032); Scientific Research Foundation for Young Investigators of West China Hospital of Stomatology, Sichuan University (2015-06). Correspondence: Li Chunjie, E-mail: lichunjie@scu.edu.cn.
Objective This study explores the mechanism of cyclooxygenase-2 (COX-2) upregulation in oral cancers associated with macrophage by using molecular biology techniques and primary culture of murine macrophage. Methods Murine macrophage was induced by macrophage colony-stimulating factor (M-CSF) and Cal27 conditional medium (CM). Purity of the macrophage was detected through CD68 immunofluorescence staining. Inhibitors of spleen tyrosine kinase (Syk) and nuclear factor κB (NFκB) were used to inhibit these pathways. In addition, real-time polymerase chain reaction and Western blot analysis were used to detect alterations in COX-2 and pathway-related proteins. Results All of the induced cells specifically expressed CD68. Cal27 CM could significantly induce COX-2 expression (P<0.001). Moreover, inhibition of Syk pathway attenuated NFκB-P65 phosphorylation and reduced COX-2 expression (P<0.01), and inhibition of NFκB pathway exerted no effects on Syk phosphorylation but significantly inhibited COX-2 upregulation (P<0.01). Conclusion Syk-NFκB is responsible for COX-2 overexpression in oral cancer associated with macrophages. Targeting this pathway is possibly a new approach to control oral cancer-related pain.
cancer pain; mouth neoplasm; cyclooxygenase-2; macrophage
R 739.8
A [doi] 10.7518/hxkq.2016.05.004
2016-03-16;
2016-07-12
2014年四川大學青年教師科研啟動基金(2014SCU1103-2);2015年四川大學華西口腔醫院青年科學研究基金(2015-06)
林潔,主治醫師,碩士,E-mail:514541402@qq.com
李春潔,副教授,博士,E-mail:lichunjie@scu.edu.cn

