h-BN負載納米NbH對LiBH4放氫性能的協同改性作用
屠國平, 何劍靈, 肖學章, 陳立新, 任錢江, 杜錫勇, 駱明兒
(1. 浙江大學材料科學與工程學院, 杭州 310027; 2. 紹興市質量技術監督檢測院, 紹興 312071)
?
h-BN負載納米NbH對LiBH4放氫性能的協同改性作用
屠國平1,2, 何劍靈2, 肖學章1, 陳立新1, 任錢江2, 杜錫勇2, 駱明兒2
(1. 浙江大學材料科學與工程學院, 杭州 310027; 2. 紹興市質量技術監督檢測院, 紹興 312071)
制備了h-BN負載納米NbH改性劑(NbH@h-BN), 并采用X射線衍射(XRD)、 X射線光電子能譜(XPS)、 透射電子顯微鏡(TEM)以及X射線能譜(EDS)等測試手段對其進行表征, 分析了NbH@h-BN對LiBH4放氫反應的摻雜改性作用及機理. 結果表明: 經NbH@h-BN摻雜改性后, LiBH4的放氫峰值溫度和表觀活化能分別降低至380 ℃和142.31 kJ/mol, 放氫動力學性能也得到大幅改善. 分析認為: NbH@h-BN具備協同改性LiBH4的放氫性能是因為NbH@h-BN可以生成穩定的粒徑為5~10 nm的NbH顆粒, 并且可以避免納米NbH在摻雜改性過程和放氫過程中發生團聚, 能夠充分發揮納米NbH和h-BN各自的改性作用.
儲氫材料; 硼氫化鋰; 協同效應
氫能是一種極具發展潛力的理想清潔能源, 因而其相關研究廣受關注. 安全、 高效且低成本的儲氫技術是目前氫能開發應用亟需解決的瓶頸技術[1]. 硼氫化鋰(LiBH4)具有18.5%的質量儲氫密度和121 kg H2/m3的體積儲氫密度, 已成為目前高容量儲氫材料研究的熱點之一[2,3]. 然而, LiBH4熱力學穩定性較高, 吸放氫動力學性能較差, 可逆吸氫的條件過于苛刻, 嚴重阻礙了其實用化進程[4].
近年來, 研究者發現多種金屬氧化物和金屬鹵化物對LiBH4能夠產生很好的去穩定化作用, 但前者的去穩定化產物是熱力學穩定性高的LiMOx[5], 而后者則容易產生B2H6副產物, 導致體系不可逆性[6~8]. 添加金屬/金屬氫化物可以實現可逆儲氫, 但其對改善放氫性能作用不明顯[9,10]. 例如, 在LiBH4中添加MgH2可以改變放氫路徑, 降低放氫反應焓變[11], 但主要放氫溫度仍高于400 ℃, 并且由于該體系放氫生成MgB2的過程是一個非常緩慢的形核過程, 致使其動力學過程也極其緩慢[12].
本課題組研究發現氮化硼(h-BN)摻雜改性LiBH4可以大幅提高LiBH4放氫速率[13], NbCl5摻雜改性LiBH4的機理是原位生成的納米NbH顆粒改善提高了LiBH4的儲氫性能[14]. 本文制備了h-BN負載納米NbH并將其用作改性劑, 研究了其對LiBH4的協同改性作用及機理.
1 實驗部分
1.1試劑與儀器
LiBH4(純度>95%)、 NbCl5(純度>99.9%)和LiH(純度>97%)購于Alfa Aesar公司; h-BN(純度>99%)和鈮粉(純度>99.9%)購于Aladin公司; 無水四氫呋喃購于Acros Organics公司, 經單質Na進一步除水后使用.
X’Pert Pro型X射線衍射儀(荷蘭PANalytical公司), CuKα輻射源,λ=0.15406 nm; ESCALAB MARK Ⅱ型能譜儀(英國VG公司), MgKα射線源 (1253.6 eV); STA449F3&Q403C差示掃描量熱-質譜聯動分析儀(德國Netzsch公司); Su-70型掃描電子顯微鏡(日本Hitachi公司); Tecnai G2 F0型透射電子顯微鏡(美國FEI公司).
1.2實驗過程
1.2.1改性劑的制備在充有高純氬氣的手套箱內, 稱取1.81 mmol NbCl5和18.1 mmol h-BN的混合物置于球磨罐中, 密封后機械球磨2 h. 然后加入9.05 mmol LiH作為還原劑, 密封后再充入4 MPa氫氣, 繼續球磨反應4 h后取出樣品. 將樣品裝入反應器中密封, 加熱至300 ℃, 恒溫并用真空泵抽真空30 min, 然后充入4 MPa氫氣并恒溫30 min, 接著繼續恒溫抽真空30 min, 如此循環3~5次后, 樣品自然緩慢冷卻. 將樣品分散在四氫呋喃中, 使生成的副產物LiCl溶解, 然后高速離心分離, 所得粉末固體繼續加入四氫呋喃, 如此循環操作直至LiCl完全被除去. 然后在密封反應器中在80 ℃下抽真空干燥, 而后取出樣品置于手套箱內備用, 記為NbH@h-BN.
稱取1.81 mmol NbCl5, 9.05 mmol LiH和18.1 mmol LiCl置于球磨罐中, 采用制備NbH@h-BN的流程制備納米NbH, 記為NbHnano.
稱取2 g金屬鈮粉裝入球磨罐后密封, 充入4 MPa氫氣. 球磨反應6 h, 每隔1 h重新取下球磨罐, 手工將粘在球磨罐壁上的物料刮下, 重新充分混合, 然后繼續球磨. 球磨完成后取出微米NbH樣品置于手套箱內備用, 樣品記為NbHmicro.
1.2.2NbH@h-BN改性劑摻雜LiBH4在手套箱內按n(LiBH4)∶n(NbH)∶n(h-BN)=1∶0.03∶0.3稱取LiBH4和NbH@h-BN改性劑, 轉移至球磨罐后密封, 球料比為40∶1, 然后充入 3 MPa氫氣. 使用行星式球磨機在200 r/min轉速下球磨制備樣品, 標記為S1.
30%h-BN(摩爾分數)摻雜LiBH4(樣品S2)、 3%NbHnano(摩爾分數)摻雜LiBH4(樣品S3)、 3%NbHmicro(摩爾分數)摻雜LiBH4(樣品S4)、 NbHmicro/h-BN復合摻雜改性LiBH4(樣品S5)以及純LiBH4(樣品S0)的制備工藝參數與NbH@h-BN摻雜改性LiBH4樣品的相同.
2 結果與討論
2.1NbH@h-BN改性劑的表征
圖1為不同反應時間后NbH@h-BN改性劑樣品的XRD譜圖. 由圖1可見, 反應1 h后, NbCl5的特征衍射峰完全消失, 并出現了Nb與LiCl的特征衍射峰, 說明NbH@h-BN改性劑制備過程中NbCl5與LiH發生氧化還原反應生成Nb單質和LiCl. 反應2 h后, 測試樣品的XRD譜圖中開始出現NbH的特征衍射峰, 并且同時存在Nb的特征衍射峰. 反應4 h后, Nb單質相完全消失, 其XRD譜中只有h-BN和NbH的特征衍射峰.
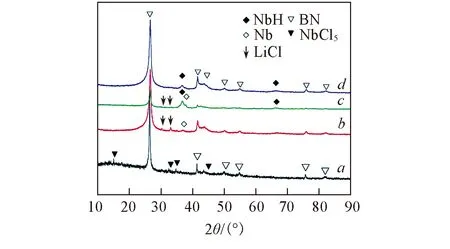
Fig.1 XRD patterns of NbH@h-BN samples during preparation Reaction time/h: a. 0; b. 1; c. 2; d. 4.

Fig.2 XPS spectra of NbH@h-BN samples during preparation Reaction time/h: a. 0; b. 1; c. 2; d. 4.
圖2為NbH@h-BN制備過程中不同反應時間樣品的Nb3dXPS圖譜. 由圖2可見, 反應起始物NbCl5的Nb3d3/2和Nb3d5/2XPS特征峰分別出現在205.2 eV和208.0 eV處. 經過1 h的球磨反應后, NbCl5的Nb3d3/2和Nb3d5/2XPS特征峰完全消失, 在202.2 eV和205.0 eV的位置出現了2個新的特征峰, 查閱文獻和XPS數據庫可以得出[15,16], 這2個特征峰分別對應Nb0的Nb3d3/2和Nb3d5/2XPS特征峰, 說明反應1 h后, NbCl5完全轉變Nb0相. 反應進行2 h后, 從測試樣品的XPS圖譜中可以看到2個峰寬較大且不對稱的峰. 通過分峰軟件擬合分析可得202.2, 203.2, 205.0和205.9 eV的分峰. 與文獻資料和XPS數據庫中的數據[15,17]對比得出, 202.2和205.0 eV處的特征峰屬于Nb0, 203.2和205.9 eV的特征峰對應的是NbH. 反應進行4 h后, 樣品的XPS圖譜則只出現了203.2和205.9 eV處的特征峰, 說明Nb單質相完全消失.
結合XRD和XPS分析結果可得出NbH@h-BN制備過程分兩步進行: 首先NbCl5與LiH發生如下化學反應:
(1)
然后Nb在球磨過程中與H2反應, 進一步轉變為NbH:
(2)
NbH@h-BN的TEM照片如圖3所示. 由圖3(A)和(B)可以看到, 原本光滑的h-BN表面[圖3(C)]被均勻覆蓋了粒徑為5~10 nm的納米顆粒. 在其高角環形暗場像-掃描投射電子顯微鏡(HAADF-STEM)照片中亦可以清楚地觀測到白色亮點均勻分散在h-BN表面[圖3(D)]. 對圖3(D)圓圈位置的亮點進行EDX元素點分析, 結果如圖3(D)插圖所示. 該亮點處僅含有Nb, N和Cu元素, 其中Cu是由TEM測試所用的銅網引入的, 而N元素是來自h-BN, 因此該亮點是由Nb元素組成的, 結合XRD和XPS數據可知h-BN表面的納米顆粒是NbH. TEM照片及EDX結果說明成功制備了負載型納米改性劑NbH@h-BN.

Fig.3 TEM images of NbH@h-BN sample(A,B), neat h-BN(C) and HAADF-STEM image and the corresponding EDX spectrum of NbH@h-BN(D and the inset)
2.2NbH與h-BN協同改性作用對LiBH4放氫性能的影響

Fig.4 Dehydrogenation curves of samples S0, S1, S2 and S3
為了研究h-BN負載納米NbH對LiBH4放氫性能的協同改性作用, 采用等溫放氫方法測試了樣品S0, S1, S2和S3的放氫動力學性能, 結果如圖4所示. 由圖4可見, 樣品S3在20 min內可釋放2.0%(質量分數)氫氣; 樣品S2可以釋放出約4.4%(質量分數)氫氣; 樣品S1則可在20 min內釋放12%的氫氣, 大于樣品S2和S3在同樣時間所能釋放的氫氣量的和(6.4%). 說明NbH@h-BN對LiBH4放氫速率的改善效果不僅僅是NbHnano和h-BN兩種改性劑單獨摻雜改性效果的疊加, 而是二者協同改性LiBH4的放氫性能.
采用DSC-MS方法對比分析了樣品S0, S1, S2和S3的放氫溫度. 由DSC曲線[圖5(A)]可見: 未進行任何摻雜改性的樣品S0的放氫反應的峰值溫度為464 ℃; 經NbHnano摻雜改性后, 樣品S3的放氫反應的峰值溫度降低到451 ℃; 經h-BN摻雜改性后, 樣品S2的放氫反應的峰值溫度降低至438 ℃; 而經NbH@h-BN摻雜改性后, 樣品S1的放氫反應的峰值溫度則降低到380 ℃. 由MS譜圖[圖5(B)]可見, NbH@h-BN摻雜改性后, 樣品S1的放氫反應的峰值溫度降低到377 ℃, 低于樣品S0, S2和S3的放氫峰值溫度, 結果與DSC的數據一致; 并且放氫反應過程中只有氫氣釋放出來, 并無NH3和B2H6等雜質氣體逸出. DSC-MS分析結果同樣說明NbH@h-BN摻雜改性LiBH4的效果優于NbHnano和h-BN 2種改性劑單獨摻雜的效果, 具有一定的協同改性作用.

Fig.5 DSC curves(A) and MS spectra(B) of samples S0, S1, S2 and S3

Fig.6 DSC curves of samples S0(A), S1(B), S2(C) and S3(D) with different heating rates Heating rate/(K·min-1): a. 5.0; b. 7.5; c. 10.0; d. 12.5; e. 15.0.

Fig.7 Kissinger plots of different LiBH4 samplesa. Ball milled LiBH4, y=-23853x+20.7921, Ea=198.316 kJ/mol, R2=0.9890; b. LiBH4-0.03 NbHnano, y=-20645.6x+16.96, Ea=171.646 kJ/mol, R2=0.9977; c. LiBH4-0.03 h-BN, y=-18740x+14.7909, Ea=155.804 kJ/mol, R2=0.99863; d. LiBH4-0.03 NbH@h-BN, y=-17117x+14.84, Ea=142.31 kJ/mol, R2=0.99723.
為了對NbH@h-BN摻雜改性LiBH4的效果有更直觀的了解, 采用Kissinge方法[18~20]分別測定了樣品S0, S1, S2和S3放氫反應的表觀活化能. 首先采集在不同升溫速率下各個樣品的DSC曲線, 如圖6(A)~(D)所示, 得到測試樣品放氫反應的峰值溫度, 并利用Kissinger方法作圖, 計算出各個樣品放氫反應的表觀活化能, 結果見圖7. 樣品S0的放氫反應表觀活化能為198.31 kJ/mol, 與文獻報道的數值相符[21,22]; 樣品S3和S2放氫反應的表觀活化能分別為171.64和155.80 kJ/mol; 樣品S1放氫反應的表觀活化能為142.31 kJ/mol, 遠小于樣品S0, S2和S3. 這說明通過摻雜NbH@h-BN可以更好地降低LiBH4放氫反應活化能壘, 進而改善體系的放氫反應動力學性能.
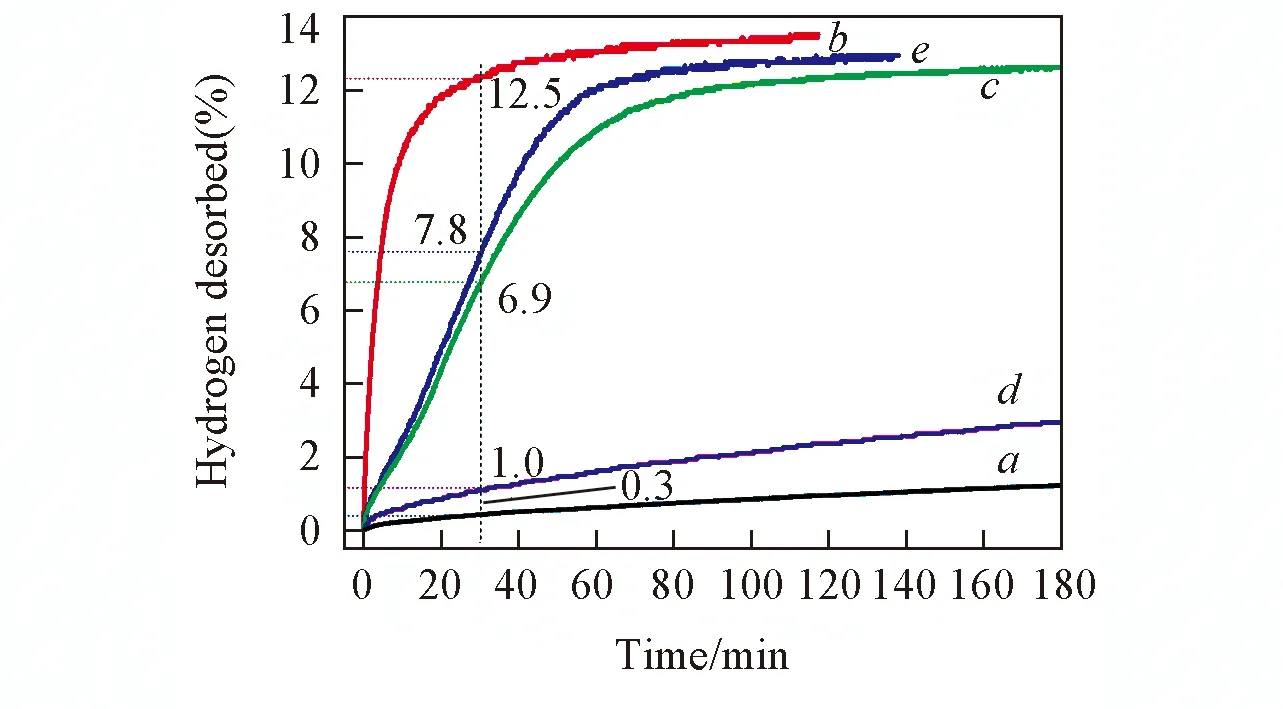
Fig.8 Dehydrogenation curves of samples S0(a), S1(b), S2(c), S4(d) and S5(e) at 400 ℃
2.3NbH@h-BN對LiBH4放氫性能的協同改性機理分析
為了說明h-BN與NbH協同改性作用對LiBH4放氫性能的影響, 將NbHmicro與h-BN按照同樣的摩爾比及同樣的摻雜方式復合摻雜至LiBH4體系中, 然后對比分析其與NbH@h-BN摻雜LiBH4體系的放氫性能. 由圖8可見, 樣品S0, S4和S5在30 min內分別能夠釋放出1.0%(質量分數)、 6.9%和7.8%(質量分數)的氫氣, 樣品S5的放氫量只是樣品S0和S4放氫量的疊加. 而樣品S1在相同條件下則可以釋放12.5%氫氣. 說明NbH@h-BN的改性效果優于NbHmirco和h-BN復合摻雜改性LiBH4. 結合對NbH@h-BN微觀結構的分析[圖3(B)], 我們認為, NbH@h-BN中的NbH以納米顆粒形式存在是其協同改性LiBH4儲氫性能的關鍵因素.
圖9為樣品S4, S3和S1放氫后的SEM照片以及各自對應的Nb元素的EDX元素面分析結果. 由圖9(A)和(D)可以清楚地看到樣品S4中Nb元素分布不均勻, 而且Nb是以塊體的形式分散在樣品體系中, 顆粒尺寸較大. 從圖9(B)可以看出, 樣品S3的部分Nb集中聚在一起形成尺寸約為1 μm的亮點. 即NbH是以納米顆粒形式摻入LiBH4[NbHnano改性劑的納米結構見圖9(B)插圖], 其納米結構也不穩定, 會在摻雜過程或吸放氫反應過程中團聚, 從而降低了其摻雜改性的效果. 由圖9(C)和(F)可以看出, 樣品S1放氫后, Nb在樣品體系中分散得很均勻, 而且沒有出現大尺寸顆粒. NbH@h-BN在摻雜改性和放氫后依舊能夠很好地保持納米NbH均一穩定地分散在h-BN表面. 因此, 我們認為NbH@h-BN摻雜改性LiBH4具有顯著的協同改性作用是因為NbH@h-BN可以生成穩定的粒徑為5~10 nm的NbH顆粒, 并且可以避免納米NbH在摻雜改性過程和放氫過程發生團聚, 能夠充分發揮納米NbH和h-BN各自的改性作用. 因此NbH@h-BN改性效果要優于NbHnano和h-BN 2種改性劑單獨摻雜改性效果的疊加.

Fig.9 SEM images(A—C) and corresponding EDX elements map of Nb(D—F) of samples S4(A, D), S3(B, E) and S1(C, F) after dehydrogenation at 400 ℃ Inset of (A) is the TEM image of NbHmicro. Inset of (B) is the TEM image of NbHnano.
3 結 論
制備了粒徑為5~20 nm的NbH均勻分散在h-BN表面的NbH@h-BN改性劑. NbH@h-BN可顯著改善LiBH4的放氫動力學性能, 放氫峰值溫度和表觀活化能分別降低至380 ℃和142.31 kJ/mol. NbH@h-BN對LiBH4的改性效果優于NbH和h-BN分別單獨改性LiBH4效果的疊加, 具有協同改性LiBH4放氫的性能. NbH@h-BN協同改性LiBH放氫性能的原因是NbH@h-BN可以生成穩定的粒徑為5~10 nm NbH顆粒, 并且可以避免納米NbH在摻雜改性過程和放氫過程中發生團聚, 能夠充分發揮納米NbH和h-BN各自的改性作用.
[ 1 ]Zhang L. N., Tao J. H., Ji K. J., Yue Q. F.,Chem.J.ChineseUniversities, 2014, 35(6), 1318—1322(張玲娜, 陶金慧, 紀開吉, 岳群峰. 高等學校化學學報, 2014, 35(6), 1318—1322)
[ 2 ]Züttel A., Borgschulte A., Orimo S.,ScriptaMater., 2007, 56, 823—828
[ 3 ]Yan Y., Remhof A., Hwang S., Li H., Mauron P., Orimo S., Züttel A.,Phys.Chem.Chem.Phys., 2012, 14, 6514—6519
[ 4 ]Vajo J., Skeith S., Mertens F.,J.Phys.Chem.B, 2005, 109, 3719—3722
[ 5 ]Yu X. B., Grant D., Walker G.,J.Phys.Chem.C, 2009, 113, 17945—17949
[ 6 ]Zhang B. J., Liu B. H.,Int.J.HydrogenEnerg., 2010, 35, 7288—7294
[ 7 ]Yuan P. P., Liu B. H., Zhu H. P., Pan W. Y., Li Z. P.,J.AlloyCompd., 2013, 557, 124—129
[ 8 ]Guo Y. H., Yu X. B., Gao L., Xia G. L., Guo Z. P., Liu H. K.,Energ.Environ.Sci., 2010, 3, 465—470
[ 9 ]Liu H., Xu F., Sun L. X., Cao Z., Zhou H. Y.,Chem.J.ChineseUniversities, 2013, 34(8), 1953—1958(劉昊, 徐芬, 孫立賢, 曹忠, 周懷營. 高等學校化學學報, 2013, 34(8), 1953—1958)
[10]Zhou Y. F., Liu Y.F, Wu W., Zhang Y., Gao M. X., Pan H. G.,J.Phys.Chem.C, 2012, 116, 1588—1595
[11]Bosenberg U., Doppiu S., Mosegaard L., Barkhordarian G., Eigen N., Borgschulte A., Jensen T. R., Cerenius Y., Gutfleisch O., Klassen T., Dornheim M., Bormann R.,ActaMater., 2007, 55, 3951—3958
[12]Boesenberg U., Kim J., Gosslar D., Eigen N., Jensen T., Colbe J. V., Zhou Y., Dahms M., Kim D., Guenther R., Cho Y., Oh K., Klassen T., Bormann R., Dornheim M.,ActaMater., 2010, 58, 3381—3389
[13]Tu G. P., Xiao X. Z., Qin T., Jiang Y. Q., Li S. Q., Ge H. W., Chen L. X.,RSCAdv., 2015, 5, 51110—51115
[14]Kou H. Q., Sang G., Zhou Y. L., Wang X. Y., Huang Z. Y., Luo W. H., Chen L. X., Xiao X. Z., Yang G. Y., Hu C. W.,Int.J.HydrogenEnerg., 2014, 39, 11675—11682
[15]Measurements, Standards and Information Services for Industry and Science, http://srdata.nist.gov/xps/Default.aspx
[16]Tu G. P., Xiao X. Z., Jiang Y. Q., Qin T., Li S. Q., Ge H. W., Wang Q. D., Chen L. X.,Int.J.HydrogenEnerg., 2015, 40, 10527—10535
[17]Gu H., Zhu Y. F., Li L. Q.,Int.J.HydrogenEnerg., 2009, 34, 7707—7713
[18]Du X. J., Li X. D., Yang R. J., Li Y. C., Pang S. P.,Chem.Res.ChineseUniversities, 2014, 30(1), 130—136
[19]Kissinger H.,Anal.Chem., 1957, 29, 1702—1706
[20]Ge Q. F.,J.Phys.Chem.A, 2004, 108, 8682—8690
[21]Shao J., Xiao X. Z., Fan X. L., Zhang L. T., Li S. Q., Ge H. W., Wang Q. D., Chen L. X.,J.Phys.Chem.C, 2014, 118, 11252—11260
[22]Ward P. A., Teprovich J. A., Peters B., Wheeler J., Compton R. N., Zidan R.,J.Phys.Chem.C, 2013, 117, 22569—22575
(Ed.: F, K, M)
Synergetic Effect of NbH@h-BN on Dehydrogenation of LiBH4?
TU Guoping1,2, HE Jianling2, XIAO Xuezhang1, CHEN Lixin1*,REN Qianjiang2, DU Xiyong2, LUO Minger2
(1.SchoolofMaterialsScienceandEngineering,ZhejiangUniversity,Hangzhou310027,China;2.ShaoxingTestingInstituteofQualityTechnicalSupervision,Shaoxing312071,China)
NbH@h-BN was prepared by mechanically milling h-BN, NbCl5and LiH, and the samples were detected by X-ray diffraction(XRD), X-ray photoelectron spectroscopy(XPS), transmission electron microscopy(TEM) and energy dispersive spectrometry(EDS). The enhancement of NbH@h-BN on the dehydrogenation of LiBH4and its mechanism were investigated. The results showed that the onset dehydroge-nation temperature and the apparent activation energy(Ea) of LiBH4were reduced to 380 ℃ and 142.31 kJ/mol respectively after the addition of NbH@h-BN, and the dehydrogenation kinetics of LiBH4was improved significantly. These remarkable results are largely attributed to the nano NbH particles which were dispersed on the surface of h-BN stably.
Hydrogen storage material; LiBH4; Synergetic effect
10.7503/cjcu20160468
2016-07-01. 網絡出版日期: 2016-09-23.
國家自然科學基金(批準號: 51471151, 51571179, 51671173)資助.
O611.6; O643
A
聯系人簡介: 陳立新, 男, 博士, 教授, 博士生導師, 主要從事儲氫材料研究. E-mail: lxchen@zju.edu.cn
? Supported by the National Natural Science Foundation of China(Nos.51471151, 51571179, 51671173).

