抵抗素對HepG2肝細胞胰島素信號通路IRS-2/Akt的影響
羅招凡 李芳萍 程 樺
(中山大學孫逸仙紀念醫(yī)院檢驗科,廣東 廣州 510120)
?
抵抗素對HepG2肝細胞胰島素信號通路IRS-2/Akt的影響
羅招凡李芳萍1程樺1
(中山大學孫逸仙紀念醫(yī)院檢驗科,廣東廣州510120)
目的探討抵抗素對HepG2肝細胞中胰島素信號通路IRS-2/Akt的影響及其與腺苷酸活化蛋白激酶(AMPK)通路之間的關系。方法50 ng/ml重組人抵抗素處理肝HepG2細胞株,siRNA技術抑制HepG2細胞AMPK α2亞基表達,采用實時RT-PCR技術檢測胰島素信號通路相關細胞信號抑制因子3(SOCS-3)和胰島素受體底物2(IRS-2)mRNA的水平,采用蛋白印跡技術檢測蛋白激酶B(Akt)的蛋白含量及磷酸化水平。結果在基礎及胰島素刺激狀態(tài)下,抵抗素上調SOCS-3 mRNA的表達(P<0.05),下調IRS-2 mRNA的表達(P<0.05),僅在胰島素刺激狀態(tài)下降低Akt總蛋白含量及其磷酸化水平(P<0.05),且未轉染與轉染AMPKα2 siRNA組比較,Akt總蛋白含量及其磷酸化水平差異無統(tǒng)計學意義(P>0.05)。結論抵抗素對HepG2細胞胰島素信號通路IRS-2/Akt起抑制作用,這可能是其導致肝臟胰島素抵抗的機制之一;抵抗素對IRS-2/Akt信號通路與AMPK通路的影響可以相互獨立。
抵抗素;胰島素抵抗;蛋白激酶B;HepG2細胞
抵抗素(Resistin)是一種富含半胱氨酸的蛋白質,屬于抵抗素樣分子(RELMs),又稱FIZZs(found in inflammatory zone)家族成員,在嚙齒類動物中它是一種脂肪分泌因子〔1〕,曾被認為是聯(lián)系肥胖和糖尿病之間的紐帶〔2〕。體試驗表明,輸注抵抗素后能極顯著增加肝糖輸出及損傷肝臟胰島素作用,其主要機制是通過抑制腺苷酸活化蛋白激酶(AMPK)磷酸化上調肝糖異生關鍵酶G6Pase、PEPCK的表達。然而,抵抗素在人類的病理作用還存在爭議〔3,4〕,因為人抵抗素同小鼠的抵抗素在氨基酸水平上只有59%的同源性,而且其來源也不盡相同,人抵抗素主要來源于單核細胞。肝臟胰島素抵抗(IR)被認為是導致2型糖尿病(T2DM)的重要原因〔5〕。其分子機制是胰島素信號通路異常改變〔6〕。胰島素信號通路包括磷脂酰肌醇3-激酶(PI3K)和絲裂原活化蛋白激酶(MAPK)信號通路,其中PI3K/蛋白激酶B(Akt)通路是主要的胰島素信號通路,調節(jié)著體內的糖脂代謝。基于此,本課題擬研究人抵抗素是否對HepG2肝細胞PI3K/Akt通路產(chǎn)生影響,并探討其與AMPK通路之間的關系。
1 材料與方法
1.1材料及主要試劑抵抗素 (美國Phoenix.Inc);胰島素(Humulin,40 IU/ml)(Lily公司);AMPK α2 siRNA及CY3熒光標記對照siRNA、siPORTNeoFX轉染試劑盒(美國Ambion公司);DMEM培養(yǎng)基及胎牛血清 (美國Gibco公司);兔抗磷酸化AMPK α(Thr172)抗體、Akt及磷酸化Akt(Ser473)(美國Cell Signaling公司);SYBR GreenⅠPCR 通用混合試劑(美國Applied Biosystems公司)。
1.2方法
1.2.1細胞培養(yǎng)及分組干預人肝HepG2細胞株來源于中山大學實驗動物中心。HepG2細胞用含10%胎牛血清的DMEM 培養(yǎng)液培養(yǎng),消化傳代,取對數(shù)生長期細胞進行實驗。按1×105個/孔的密度接種細胞于培養(yǎng)板,經(jīng)AMPK α2 siRNA(res50+ siRNA group)、陰性對照siRNA(res50+ con siRNA group)轉染24 h的HepG2細胞用含50 ng/ml抵抗素的低糖DMEM培養(yǎng)液處理24 h,同時未轉染的HepG2細胞在相同條件下用無(res0 group)或50 ng/ml抵抗素(res50 group)處理24 h,之后用去血清的無糖DMEM培養(yǎng)液(仍含對應濃度的抵抗素)饑餓3~5 h,最后用無或含100 nmol/L胰島素的低糖DMEM培養(yǎng)液處理2 h后收集細胞。
1.2.2siRNA序列合成及轉染根據(jù)GenBank AMPK α2基因已知序列(Accession No.NM-006252),已確證的AMPK α2 siRNA(Silencer?Validated siRNA)由Ambion公司提供,AMPK α2 siRNA正義鏈:5′-GGUUUCUUAAAAACAGCUGtt-3′,并采用CY3熒光標記的陰性對照siRNA(siRNA control) 監(jiān)測轉染效率,用轉染試劑處理組作為空轉對照組(mock組)。
1.2.3RNA的提取及實時定量RT-PCR檢測mRNA水平用TRIZOL分離提取細胞總RNA,逆轉錄成cDNA,用SYBR GreenⅠ實時定量PCR進行擴增,擴增條件為95℃變性10 min,然后95℃15 s,60℃1 min,共40個循環(huán)。在PCR反應結束后采用溶解曲線方法驗證反應的特異性。實驗結果以管家基因18 sRNA的循環(huán)閾值(Ct)作標準化,稱為ΔCt,最終各基因的表達結果為2-ΔΔCT,其中-ΔΔCT 等于處理組ΔCt減去對照組ΔCT,對照組2-ΔΔCT值為1。各基因引物用Primer Express2.0軟件設計,其特異性及有效性在實驗前均被證實。各正義及反義引物序列見表1。

表1 實時定量PCR引物
1.2.4Western印跡檢測總Akt、AMPK及Akt磷酸化蛋白表達收集6孔板細胞,加200 μl的裂解液,按Western印跡操作流程進行檢測,用Image-Quant分析軟件測定結果中條帶灰度值,以目的蛋白與β-actin 條帶灰度值的比值表示各組蛋白的相對表達量。

2 結 果
2.1AMPK α2 siRNA對AMPK α2 mRNA和蛋白表達的影響轉染24 h后,AMPK α2 mRNA表達抑制率為(52.3±0.8)%,轉染72 h后AMPK α2蛋白表達抑制率為(48.1±2.3)%。
2.2抵抗素在基礎及胰島素刺激狀態(tài)下對HepG2細胞胰島素信號通路相關基因mRNA表達的影響與res0組比較,在基礎及胰島素刺激狀態(tài)下,抵抗素增加SOSC-3 mRNA的表達(P<0.05),降低IRS-2 mRNA的表達(P<0.05);單獨抵抗素處理組(res50 group)與轉染AMPK α2 siRNA的抵抗素處理組(res50+siRNA group)比較,IRS-2和SOSC-3 mRNA的表達差異無統(tǒng)計學意義,見表2。
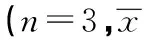
表2 抵抗素在基礎及胰島素刺激狀態(tài)下對HepG2細胞胰島素信號通路相關基因mRNA相對表達量的影響±s)
與res0組比較:1)P<0.05;與基礎狀態(tài)下對應組比較:2)P<0.05
2.3抵抗素在基礎及胰島素刺激狀態(tài)下對HepG2細胞AMPK及Akt蛋白及磷酸化水平的影響與res0組比較,在基礎及胰島素刺激狀態(tài)下抵抗素降低AMPK的磷酸化水平(P<0.05),僅在胰島素刺激狀態(tài)下降低Akt總的蛋白含量及其磷酸化水平(P<0.05);單獨抵抗素處理組(res50 group)與轉染AMPK α2 siRNA的抵抗素處理組(res50+siRNA group)比較,Akt總蛋白含量及其磷酸化水平無統(tǒng)計學差異,而AMPK的磷酸化水平有統(tǒng)計學差異(P<0.05),見圖1,表3。

表3 在基礎及胰島素刺激狀態(tài)下抵抗素對HepG2細胞AMPKα(Thr172)、Akt蛋白及Akt (Ser473)磷酸化水平的影響
與res0組比較:1)P<0.05,與res50組比較:2)P<0.05,與res50+control siRNA組比較:3)P<0.05;與基礎狀態(tài)下對應組比較:4)P<0.05

圖1 抵抗素在基礎及胰島素刺激狀態(tài)下對HepG2細胞AMPK磷酸化及Akt蛋白總量及磷酸化水平的影響
3 討 論
絲/蘇氨酸激酶(Akt)主要負責由PI3K始動的生物信息的傳導,Akt處于這一通路的中心環(huán)節(jié),它在細胞代謝、細胞周期調控、細胞生長凋亡等多種生物學過程中發(fā)揮著重要作用,與IR的發(fā)生發(fā)展密切相關。以往對抵抗素的研究發(fā)現(xiàn),抵抗素可能通過抑制PI3K/Akt通路導致IR〔7〕,另也有報道胰島素信號級聯(lián)途徑的Akt并不受抵抗素的影響〔8〕,因此各家報道并不一致。本研究主要觀察抵抗素對HepG2細胞胰島素IRS-2/PI3K/Akt信號通路的影響,結果發(fā)現(xiàn)人抵抗素在胰島素刺激條件下可下調IRS-2 mRNA的表達、減低Akt的蛋白量及其磷酸化水平,抵抗素這一抑制作用可能與其導致肝臟IR的機制有關。
SOCS家族是近年發(fā)現(xiàn)含有肉瘤同源區(qū)段2(SH2)結構域的蛋白質家族,現(xiàn)共發(fā)現(xiàn)8個SOCS家族成員(CIS,SOCS-1~SOCS-7),廣泛分布于胸腺、腦、心臟、骨骼肌、肝臟等組織器官,其中SOCS-3主要參與負調控細胞因子及一些激素誘導的細胞信號轉導。2005年Steppan等〔9〕首先發(fā)現(xiàn)抵抗素可誘導3T3-L1脂肪細胞SOCS-3表達增加,而后者可與胰島素受體競爭性結合。隨后Zhou等〔7〕也報道人抵抗素可刺激L-02肝細胞SOCS-3 mRNA的表達而阻止胰島素信號通路,Qi等〔10〕則報道抵抗素基因敲除鼠SOCS-3水平降低,導致肌肉Akt磷酸化水平上升,使胰島素敏感性增強。
IRS-2是胰島素受體信號耦聯(lián)的重要轉導蛋白,胰島素與受體結合后,激活IRS分子,募集含SH2結構域的多種分子并與它們結合,通過這些分子向多個方向進一步傳遞胰島素信號。細胞IRS表達水平的高低是胰島素信號轉導正常與否的基礎,當IRS的濃度下降到一定程度,胰島素信號的胞內轉導就會受到阻滯。資料表明,肝細胞中IRS-2在維持糖代謝平衡及IRS-2缺陷對T2DM發(fā)生發(fā)展比IRS-1更重要〔11〕。
本實驗表明,HepG2細胞與人抵抗素慢性孵育24 h后,在基礎及胰島素刺激狀態(tài)下,人抵抗素作為細胞因子可上調HepG2細胞SOSC-3 mRNA的表達、下調IRS-2 mRNA的表達,僅在胰島素刺激狀態(tài)下減低Akt總蛋白含量及其Ser473磷酸化水平。推測抵抗素使表達上調的SOCS-3的SH2結構域競爭性結合胰島素受體,抑制了IRS-2的表達,而IRS-2的下調可使胰島素信號傳導減弱,導致了胰島素生物效應降低,從而誘發(fā)肝細胞IR。以上結果與Zhou等〔12〕報道結果相似。
目前對AMPK通路與Akt通路之間的關系尚存在爭議。在3T3-L1脂肪細胞中,AMPK可以增加葡萄糖轉運以及GLUT-4的轉位,該作用與胰島素信號通路不盡相同,研究提示AMPK可能是通過遠離Akt作用位點的胰島素信號通路,或者是一條非胰島素激活的信號通路〔13〕。但另有研究表明,在C2C12肌細胞中AMPK可使胰島素信號級聯(lián)途徑的上游組分IRS-1磷酸化,表明AMPK是胰島素信號通路上游潛在的調節(jié)子〔14〕。出現(xiàn)以上不同的結果可能是由于研究細胞特性不同、所處環(huán)境不同、采用的實驗條件及方法不同等。
在本研究中,我們發(fā)現(xiàn)在胰島素刺激狀態(tài)下,HepG2細胞單獨抵抗素組與AMPK α2 siRNA轉染后的抵抗素處理組SOSC-3和IRS-2 mRNA的表達、Akt的蛋白量及其磷酸化水平并無顯著差異,說明人抵抗素可以影響HepG2細胞胰島素信號通路,但這一影響并不依賴于AMPK。以上結果提示,人抵抗素對HepG2細胞AMPK通路與胰島素PI3K/Akt通路的影響可以相互獨立,但兩條通路之間的關系極為復雜,有待進一步探討。
1Holcomb IN,Kabakoff RC,Chan B,etal.FIZZ1,anovel cysteine rich secreted protein associated with pulmonary inflammation,defines a new gene family〔J〕.Embo J,2000;19(15):4046-55.
2Steppan CM,Bailey ST,Bhat S,etal.The hormone resistin links obesity to diabetes〔J〕.Nature,2001;409(6818):307-12.
3Lee JH,Chan JL,Yiannakouris N,etal.Circulating resistin levels are not associated with obesity or insulin resistance in humans and are not regulated by fasting or leptin administration:cross-sectional and interventional studies in normal,insulin-resistant,and diabetic subjects〔J〕.J Clin Endocrinol Metab,2003;88(10):4848-56.
4Cantley J.The control of insulin secretion by adipokines:current evidence for adipocyte-beta cell endocrine signalling in metabolic homeostasis〔J〕.Mamm Genome,2014;25(9-10):442-54.
5Kim SP,EllmererM,van Citters GW,etal.Primacy of hepatic insulin resistance in the development of the metabolic syndrome induced by and isocaloric moderate-fat diet in the dog〔J〕.Diabetes,2003;52(10):2453-60.
6Pessin JE,Saltiel AR.Signaling pathways insulin action:molecular targets of insulin resistance〔J〕.J Clin Invest,2000;106(1):165-69.
7Zhou L,Li L,Xia T,etal.Resistin overexpression impaired glucose tolerance in hepatocytes〔J〕.Eur Cytokine Netw,2006;17(2):189-95.
8Moon B,Kwan JJ,Duddy N,etal.Resistin inhibits glucose uptake in L6 cells independently of changes in insulin signaling and GLUT4 translocation〔J〕.Am J Physiol Endocrinol Metab,2003;285(1):E106-15.
9Steppan CM,Wang J,Whiteman EL,etal.Activation of SOCS-3 by resistin〔J〕.Mol Cell Biol,2005;25(4):1569-75.
10Qi Y,Nie ZY,Lee YS,etal.Loss of resistin improves glucose homeostasis in leptin deficiency〔J〕.Diatetes,2006;55(11):3083-90.
11Rother KI,Imai Y,Caruso M,etal.Evidence that IRS-2 phosphorylation is required for insulin action in hepatocytes〔J〕.J Biol Chem,1998;273(28):17491-97.
12Zhou L,Sell H,Eckardt K,etal.Conditioned medium obtained from in vitro differentiated adipocytes and resistin induce insulin resistance in human hepatocytes〔J〕.FEBS Lett,2007;581(22):4303-8.
13Yamaguchi S,Katahira H,Ozawa S,etal.Activators of AMP-activated protein kinase enhance GLUT4 translocation and its glucose transport activity in 3T3L1 adipocytes〔J〕.Am J Physiol Endocrinol Metab,2005;289(4):E643-9.
14Jakobsen SN,Hardie DG,Morrice N,etal.5'-AMP-activated protein kinase phosphorylatesIRS-1 on Ser-789 in mouse C2C12 myotubes in response to 5-aminoimidazole-4-carboxamideriboside〔J〕.J Biol Chem,2001;276(50):46912-6.
〔2015-12-03修回〕
(編輯李相軍)
國家自然科學基金資助項目(30570886);教育部留學回國人員科研啟動基金資助項目(教外司留〔2015〕1098號)
羅招凡(1972-),女,醫(yī)學博士,副主任技師,主要從事代謝綜合征與腫瘤的基礎研究。
R589
A
1005-9202(2016)15-3629-03;doi:10.3969/j.issn.1005-9202.2016.15.008
1中山大學孫逸仙紀念醫(yī)院內分泌科

