氫氧化亞鐵制備實驗的改進與創(chuàng)新
陳彩鳳 陳迪妹 胡加烽 沈怡
摘要:傳統(tǒng)化學教材氫氧化亞鐵的制備實驗中難以保證“白色”沉淀這一現(xiàn)象的穩(wěn)定性,影響學生對實驗現(xiàn)象的觀察。本研究主要對氫氧化亞鐵制備原理和實驗裝置作改進。根據(jù)雙水解反應原理,通過定性實驗比較Fe2+與碳酸根或碳酸氫根的雙水解,通過定量實驗探究最佳濃度,以提高實驗成功率。同時對實驗裝置進行了微型化設計,增強了實驗的趣味性。
關鍵詞:氫氧化亞鐵制備;微型化實驗;雙水解;實驗改進
文章編號:1005–6629(2016)9–0046–03 中圖分類號:G633.8 文獻標識碼:B
1 問題的提出
氫氧化亞鐵的制備實驗中白色的氫氧化亞鐵會逐漸轉變?yōu)榛揖G色的氫氧化鐵,使學生誤認為氫氧化亞鐵的顏色是灰綠色。有不少研究者都從避開氧氣的角度對該實驗進行了改進。
其中一類是將NaOH溶液煮沸以除去其中的溶解氧[1]。此方法有一定效果,但是煮沸難以將溶解氧全部除盡,所以白色沉淀能維持的時間要略長一些,但僅幾分鐘而已。
另一類是利用煤油、石蠟油等有機物對反應體系進行液封。由于反應時體系難以與外界空氣接觸,就會相應延緩氫氧化亞鐵被氧化的速率。最常見到的改進一般是將這幾種思路進行混合,將各自的優(yōu)點進行融合,以達到更佳的除氧效果,延緩氧化速率[2]。但這些改進均不是很理想,白色沉淀存在時間仍比較短。
還有一類是通過離心技術來盡可能地除去反應體系中的氧氣。一般利用試管中生成的Fe(OH)2除去NaOH、FeSO4溶液中的溶解氧。首先是在已生成Fe(OH)2沉淀的試管中加入過量NaOH溶液,利用Fe(OH)2除去NaOH溶液中的溶解氧;另外也在已生成Fe(OH)2沉淀的試管中加入過量FeSO4溶液,利用Fe(OH)2除去FeSO4溶液中的溶解氧。接著取2種溶液相互滴加,這樣處理之后生成的Fe(OH)2基本上處于無氧環(huán)境中,不易被氧化[3],白色沉淀的維持時間最長可達2h以上。但是這樣改進的最大缺點就在于操作復雜,很難在課堂上實施演示,失去其實際意義。
鑒于以上種種改進方法,本文也從減少氧氣的角度出發(fā),結合煮沸除去溶解氧,而且將橫截面積小于試管的軟管作為反應容器,來減少反應中接觸到的氧氣。除此之外,還改變了反應方式,利用Fe2+與HCO3-的雙水解產(chǎn)生二氧化碳以排出氧氣,以延長白色沉淀的存在時間。同時由于該反應原理為雙水解,反應處于動態(tài)平衡之中,受外界干擾較小。通過透明軟管將此實驗進行微型化設計,簡化了步驟,增強了趣味性,有利于課堂實驗的展開與實驗現(xiàn)象的觀察。
2 實驗原理探究
2.1 產(chǎn)生淺綠色的原理
Fe2++2OH-=Fe(OH)2↓
該反應生成的氫氧化亞鐵是白色膠狀沉淀,因吸附了溶液中淺綠色的亞鐵離子,而使白色沉淀變成淺綠色。氫氧化亞鐵沉淀的顏色與吸附過量的淺綠色的亞鐵離子有關[4,5]。通過雙水解促進亞鐵離子水解生成白色氫氧化亞鐵,從而使沉淀變成較純白色,便于觀察。
2.2 雙水解的原理
2.2.1 實驗原理
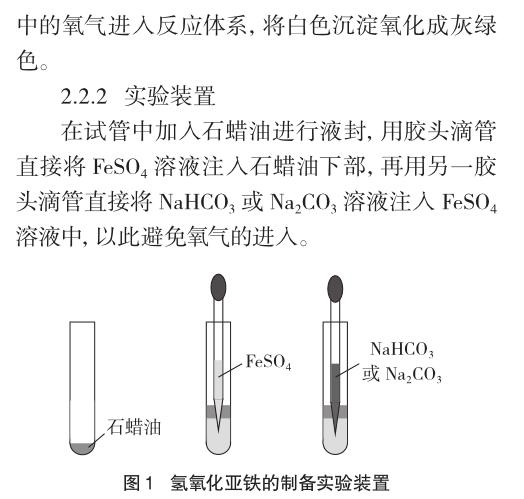
2.2.3 實驗內(nèi)容
(1)液封:用石蠟油將試管液封,用滴管分別在9支試管底部注入2mL 0.5 mol/L的FeSO4溶液。
(2)不同濃度Na2CO3溶液對比:用滴管分別將2mL的0.1 mol/L、0.5 mol/L、1.0 mol/L、1.5 mol/L的Na2CO3溶液注入上述4支FeSO4溶液中,使其發(fā)生反應,分別觀察實驗現(xiàn)象。
(3)不同濃度NaHCO3溶液對比:用滴管分別將2mL的0.1 mol/L、0.5 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L的NaHCO3溶液注入上述另5支FeSO4溶液中,使其發(fā)生反應,分別觀察實驗現(xiàn)象并進行對比。
(4)實驗現(xiàn)象對比:
不同濃度Na2CO3溶液對比:隨著濃度的增大,白色沉淀的存在時間增長。
不同濃度NaHCO3溶液對比:隨著濃度的增大,白色沉淀的存在時間增長。
從實驗過程與現(xiàn)象可以看出,在相同處理的情況下,同濃度的NaHCO3溶液的反應效果要優(yōu)于Na2CO3溶液。因此,我們選用NaHCO3溶液進行實驗。
3 實驗試劑最佳濃度探究
分別用2mL的0.1 mol/L、0.5 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L NaHCO3溶液與FeSO4溶液反應,實驗現(xiàn)象見表1。
從實驗現(xiàn)象與數(shù)據(jù)中可以看到反應物濃度偏大時白色沉淀較純,且維持時間較長。但當濃度大于2 mol/L時,由于溶液在常溫下達到過飽和狀態(tài)會產(chǎn)生干擾現(xiàn)象。于是得出最佳濃度是NaHCO3溶液:1.0~2.0 mol/L;FeSO4溶液:1.0~1.5 mol/L。
4 新實驗設計方案
4.2 實驗儀器和試劑
(1)實驗儀器:長15cm白色透明橡膠管、2支50mL注射器、酒精燈、150mL燒杯、三腳架、石棉網(wǎng)、火柴
(2)實驗試劑:1.5 mol/L NaHCO3溶液、1.5 mol/L FeSO4溶液(含還原鐵)
4.3 實驗裝置
4.4 實驗步驟
(1)除去溶解氧:點燃酒精燈,將1.5 mol/L NaHCO3溶液加熱至80℃左右,以除去溶液中的溶解氧。
(2)搭建裝置:將長15cm白色透明橡膠管卡在150mL燒杯口,呈“V”形。兩支注射器分別吸取2mL 1.5 mol/L熱NaHCO3溶液和2mL 1.5 mol/L FeSO4溶液。
(3)加料:將2mL 1.5 mol/L熱NaHCO3溶液從管口注射入橡膠管中,另一只注射器在橡膠管中部刺入,將2mL FeSO4溶液注射入NaHCO3溶液中(如圖2所示),使其發(fā)生反應。
(4)觀察實驗現(xiàn)象:從中部開始逐漸產(chǎn)生白色沉淀,且維持時間較長,2min左右橡膠管兩端的沉淀開始轉變?yōu)榛揖G色。
4.5 實驗注意事項
(1)FeSO4溶液中加入少量還原鐵粉,防止實驗過程中被氧化,避免溶液中產(chǎn)生Fe3+。
(2)NaHCO3溶液加熱時要注意溫度,盡可能將溶解氧除去,但是要避免沸騰再次溶入氧氣。
(3)注射溶液時注意速度,避免從另一管口溢出。
5 實驗創(chuàng)新點
(1)使用雙水解的原理,將反應維持在動態(tài)平衡中,延長了白色沉淀的穩(wěn)定時間,克服了這個實驗的最大難點,同時也便于學生觀察與記錄現(xiàn)象。
(2)加熱NaHCO3溶液除去溶解氧,直接將FeSO4溶液注入NaHCO3溶液中部,省去了液封這一步驟,簡化了實驗。
(3)反應生成的二氧化碳將氧氣排出軟管,減少并延緩產(chǎn)物Fe(OH)2被氧化。
(4)設計成微型化實驗,既增強趣味性,又減少實驗試劑的用量,使實驗更加環(huán)保。還可以安排讓學生分組實驗。
(5)可以將本實驗用于雙水解的知識新授課。
參考文獻:
[1]趙亭.氫氯混合氣體光照爆炸實驗和氫氧化亞鐵制備實驗的再改進[J].化學教育,2012,(12):77.
[2]程偉平.氫氧化亞鐵的制備實驗改進[J].化學教育,2013,(4):75.
[3]吳名勝.再議制備氫氧化亞鐵的實驗改進[J].化學教育,2010,(6):84.
[4]徐建飛,張平,杜淑賢.制備氫氧化亞鐵實驗方案再探究[J].化學教學,2015,(7):54~57.
[5]劉彩虹,張文蘭,劉麗君.氫氧化亞鐵制備實驗的設計[J].化學教學,2014,(9):52~54.

