lncRNA-AK058003誘導肝癌細胞凋亡的作用機制
何曉琴 徐細明 余佳駿 甘園園 韓娜娜 張美霞
武漢大學人民醫院腫瘤中心,湖北武漢430060
lncRNA-AK058003誘導肝癌細胞凋亡的作用機制
何曉琴徐細明余佳駿甘園園韓娜娜張美霞
武漢大學人民醫院腫瘤中心,湖北武漢430060
目的探討lncRNA-AK058003在肝癌細胞凋亡中的作用機制。方法采用lip2000轉染法分別將過表達質粒(lncRNA-AK058003組)和空質粒(Vector組)轉入HepG2和SMMC-7721細胞株,應用流式細胞術和蛋白質免疫印跡法來檢測凋亡細胞及凋亡相關蛋白。結果構建上調lncRNA-AK058003的表達質粒,轉染HepG2和SMMC-7721細胞株后,凋亡細胞數和凋亡率明顯高于Vector組(P<0.05);過表達lncRNA-AK058003能抑制MAPK信號通路關鍵磷酸化蛋白的表達。結論lncRNA-AK058003能夠調控MAPK信號通路促進肝癌細胞凋亡。
lncRNA-AK058003;肝癌;MAPK通路;凋亡
[Abstract]Objective To explore the mechanism of lncRNA-AK058003 in liver cancer cells apoptosis.Methods Flow cytometry and protein immunoblot methods were applied to detecting cell apoptosis and related proteins,after transfected lncRNA-AK058003 or vector in HepG2 and SMMC-7721 cells with lip2000.Results Transfected HepG2 and SMMC-7721 with construction of over-expression lncRNA-AK058003 plasmid,the number of apoptotic cells and apoptotic rate are significantly higher than the empty plasmid group(P<0.05).The key phosphorylated proteins of MAPK signal pathway were suppressed by lncRNA-AK058003.Conclusion LncRNA-AK058003 can promote liver cancer cells apoptosis by adjusting MAPK signaling pathways.
[Key words]lncRNA-AK058003;Liver cancer;MAPK signal pathway;Apoptosis
原發性肝癌是全球常見的惡性腫瘤之一,其中男性肝癌死亡率在腫瘤相關性死亡中位居第二[1],而肝癌發生發展的分子機制仍不明確。前期研究表明肝癌的發生與細胞凋亡分子和信號通路異常相關[2-4]。因此從分子水平研究肝癌細胞凋亡的機制,并將特異性分子作為臨床治療新靶點。
長鏈非編碼RNA(long non-coding RNA,lncRNA)是近年來備受矚目的一類長度大于200 nt的非編碼RNA,其位于細胞核與細胞質中,是RNA聚合酶Ⅱ轉錄的副產物[5-7]。由于lncRNA無開放閱讀框,所以沒有或很少具有編碼蛋白質的能力,主要是以RNA形式,在表觀遺傳學(包括DNA甲基化、組蛋白修飾、染色質重構)、轉錄調控(通過募集或者干擾一些轉錄因子在蛋白編碼基因上游啟動子區定位,而影響下游基因的表達)及轉錄后水平調節基因的表達[8-9]。目前,已有文獻證實部分lncRNA在腫瘤凋亡中發揮重要作用[10-11],而lncRNA與肝癌凋亡相關的文獻相對較少。因此,深入探討lncRNAs在肝癌凋亡的作用及其分子機制,將有助于全面地了解肝癌發生的過程。
1 對象與方法
1.1細胞培養
人肝癌細胞系HepG2和SMMC-7721購于中科院上海細胞庫,按照50%培養基,40%血清和10% DMSO進行梯度凍存,保存于液氮中。HepG2采用含有10%Gibico胎牛血清和1%青-鏈霉素的Hyclone DMEM培養基,而SMMC-7721在含10%Gibico胎牛血清和1%青-鏈霉素的Hyclone RPMI培養基置于37℃、5%CO2細胞培養箱培養。
1.2逆轉錄聚合酶鏈反應(RT-PCR)和實時定量聚合酶鏈反應(qRT-PCR)
將構建的過表達質粒及空質粒分別轉染HepG2和SMMC-7721細胞。轉染48 h后,用Trizol提取總RNA[12],并用Nano-Drop2000C紫外分光光度計測定RNA濃度及純度。然后按TOYOBO試劑盒(QPK-201,日本)說明書將RNA反轉錄成cDNA。最后按照Takara qRT-PCR試劑盒說明書進行操作,設立3個復孔,GAPDH為內參基因,7500 Fast System SDS軟件分析Ct值,采用2-ΔΔCt法計算相對表達量。引物序列由武漢巴菲爾生物有限公司設計合成:GAPDH-F:5'-AGAAGGCTGGGGCTCATTG-3';GAPDH-R:5'-AGGG GCCATCCACAGTCTTC-3';AK058003-F:5'-GGGAAC AAAGATGGTTTCTACGT-3';AK058003-R:5'-ACTGGT TCATAGTTAGGCTGGAT-3'。
1.3過表達lncRNA-AK05800質粒的構建
用PCR儀擴增并獲取目的基因,瓊脂糖電泳進行驗證。然后將10 μL的PCR產物與載體GV144(上海吉凱基因化學技術有限公司)交換反應產物轉化到100 μL感受態細胞E.coli中,取適量菌液均勻涂布在含有卡那霉素抗性的瓊脂糖平板,置于恒溫培養箱中培養16 h。最后對菌液和質粒進行PCR鑒定和測序。
1.4脂質體轉染人肝癌細胞系
細胞融合度達50%~80%時,更換成無血清培養基培養2 h。分別用Optimem稀釋lip2000(Thermo,Invitrogen)和質粒,靜置5 min后將兩者輕輕混合,室溫孵育20 min加入培養皿內繼續培養[10]。
1.5細胞凋亡檢測
收集轉染48 h的腫瘤細胞上清,用胰酶消化細胞,PBS洗滌兩次,用凋亡試劑盒(杭州聯科生物技術股份有限公司)240 μL 1xBinding buffer重懸細胞,調整細胞濃度為2×105/mL,加入5 μL Annexin V-APC和10 μL 7-氨基放線菌素D(7-AAD)輕輕混勻,室溫避光反應30 min,再加入260 μL 1×Binding buffer稀釋。用流式細胞儀分析(Becton-Dickinson,USA),采用FACS express version 3軟件分析結果。
1.6蛋白質免疫印跡實驗(Western blot)
提取肝癌細胞系總蛋白,4℃,12 000 r/min離心5 min,將上清分裝到1.5 mL的離心管中放于-20℃保存。制備SDS-PAGE凝膠,根據蛋白濃度計算出上樣體積,與上樣緩沖液1∶1混勻,沸水浴30 min,加樣。60 mA恒流電泳約1 h,轉膜,封閉,一抗過夜孵育(表1),二抗(生物素標記山羊抗兔IgG 1∶10 000)孵育,漂洗,經ECL試劑盒(BestBio,上海)顯色,凝膠成像系統掃描處理。通過Pathway分析預測lncRNA-AK058003與MAPK信號通路相關,采用Western blot檢測MAPK信號通路中的3個主要蛋白:ERK、P38、JNK及磷酸化的蛋白。
1.7統計學方法
采用SPSS 20.0統計學軟件進行數據分析,計量資料數據用均數±標準差(x±s)表示,兩組間比較采用t檢驗;計數資料用率表示,組間比較采用χ2檢驗,以P<0.05為差異有統計學意義。
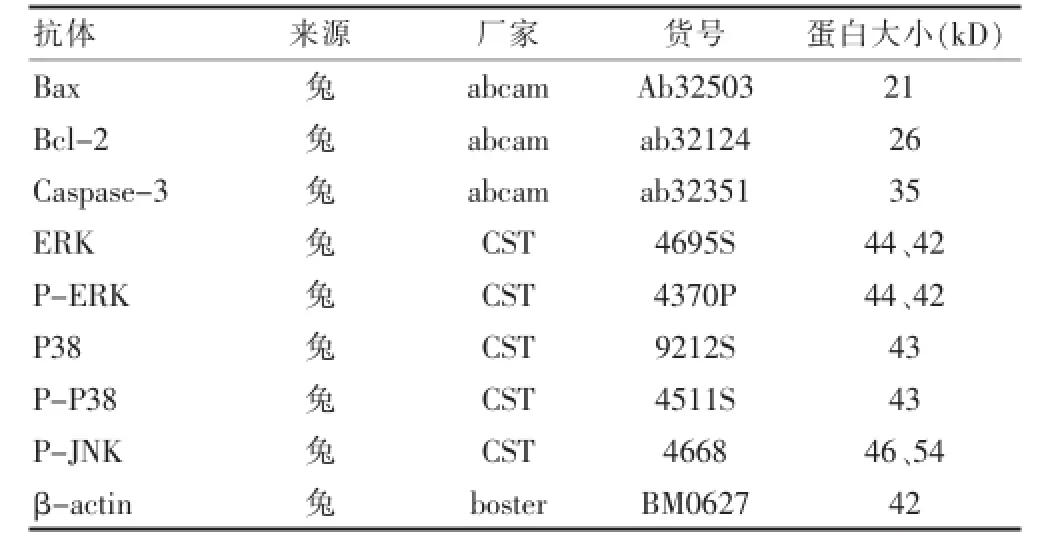
表1 抗體詳細信息
2 結果
2.1lncRNA-AK058003質粒構建和克隆篩選
構建lncRNA-AK058003過表達的質粒(圖1A),以瓊脂糖凝膠電泳初步表明lncRNA-AK058003目的序列成功與載體結合(圖1B)。經測序分析,進一步證明重組體中含過表達的目的片段,且堿基序列完整(圖1C)。
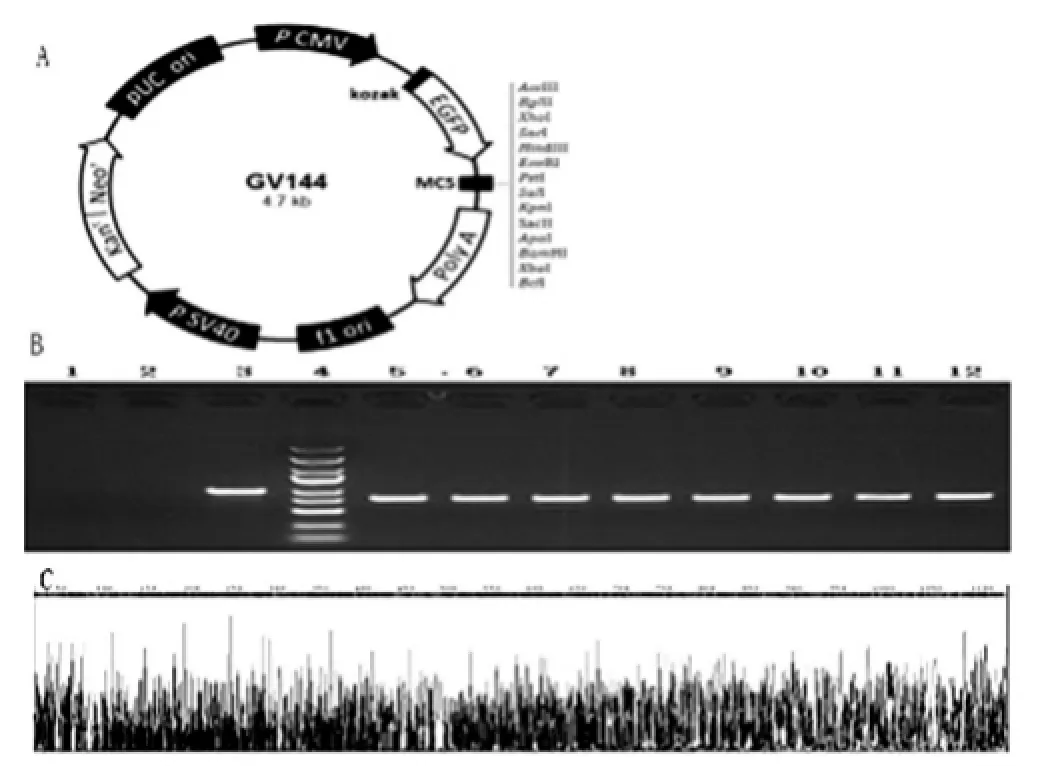
圖1 LncRNA-AK058003質粒的構建和鑒定
2.2瞬時轉染肝癌細胞系后lncRNA-AK058003表達
RT-PCR及qRT-PCR結果顯示:HepG2和SMMC-7721轉染lncRNA-AK058003組顯著高于Vector組,差異均有高度統計學意義(P<0.01),見圖2。結果顯示,瞬時轉染lncRNA-AK058003成功。
2.3lncRNA-AK058003促進肝癌細胞凋亡
流式細胞術檢測顯示:在HepG2中過表達lncRNA-AK058003后凋亡細胞數增多(圖3A~B),凋亡率明顯高于Vector組(P<0.01)(圖3E);同時也在SMMC-7721中進行檢測,過表達lncRNA-AK058003后凋亡細胞數和凋亡率均顯著高于Vector組(P<0.05)(圖3C~E)。為了證明lncRNA能誘導肝癌細胞凋亡,采用Western blot檢測了凋亡相關蛋白Bax、Bcl-2、Caspase-3的蛋白變化。如圖3F所示:過表達lncRNAAK058003后,促凋亡蛋白Bax、Caspase-3表達量較空質粒組增高,而抑制凋亡蛋白Bcl-2表達量降低。進一步證明lncRNA-AK058003能促進肝癌細胞凋亡。
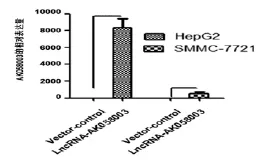
圖2 轉染肝癌細胞系AK058003的相對表達量
***
**
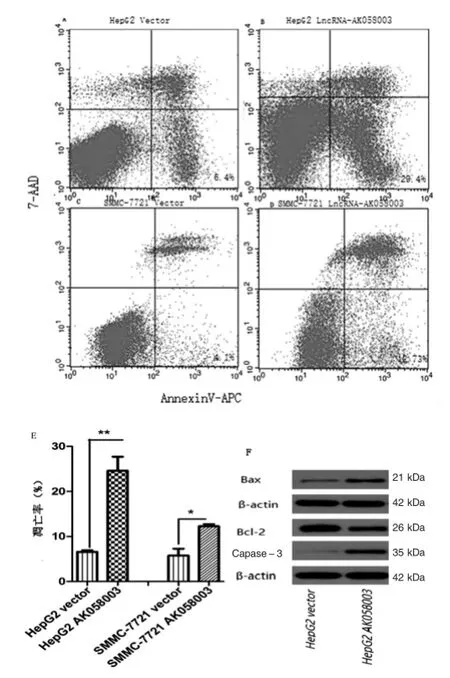
圖3 LncRNA-AK058003誘導肝癌細胞凋亡
2.4lncRNA-AK058003與MAPK信號通路的關系
過表達lncRNA-AK058003的HepG2中P-ERK,P-P38及P-JNK蛋白變化較Vector組顯著降低,然而ERK和P38蛋白的變化不顯著,說明lncRNAAK058003可能參與抑制MAPK信號通路的激活。見圖4。
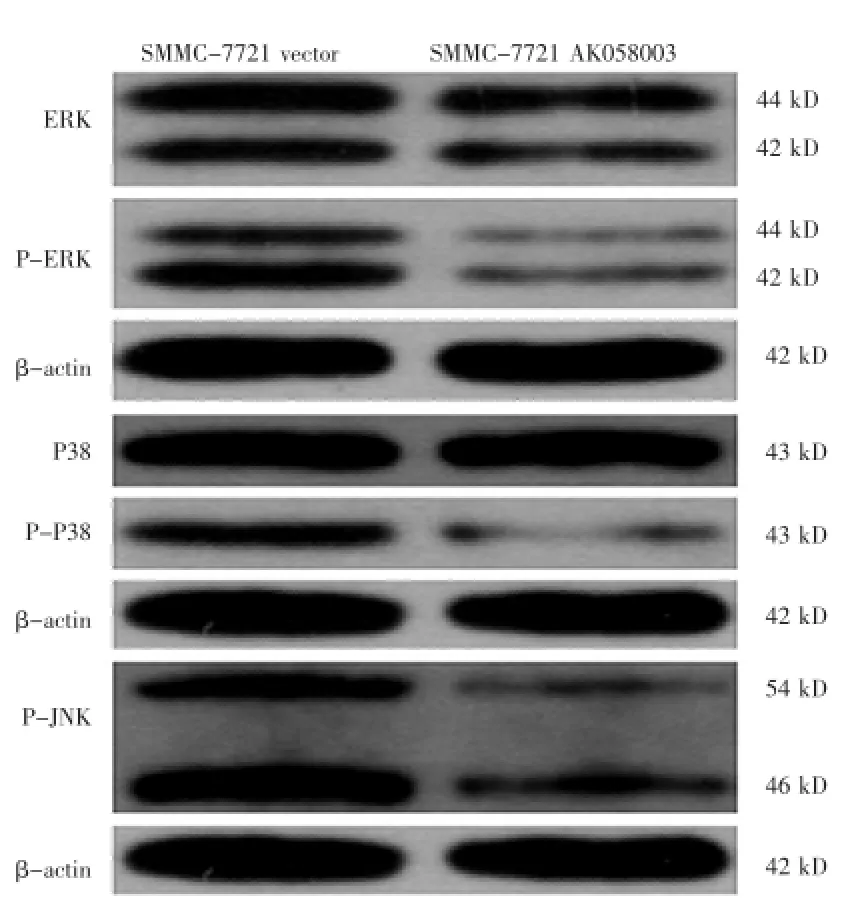
圖4 lncRNA-AK058003與MAPK信號通路的關系
3 討論
細胞凋亡是為調控機體的發育和維護內環境穩定,由基因控制的主動程序性死亡的過程[13]。有學者認為腫瘤的無限制增長是腫瘤細胞的凋亡機制失控所致[14]。最近的研究表明,凋亡誘導療法是一種安全有效的抗癌方法,從而可能成為癌癥治療方式之一[15]。因此,尋找誘導腫瘤細胞凋亡的基因有助于開辟腫瘤治療的新天地。本研究首次探討了lncRNA-AK058003與肝癌細胞凋亡的關系,通過上調lncRNA-AK058003的表達,進行流式細胞術和Western blot實驗,發現lncRNA-AK058003能夠誘導肝癌細胞凋亡,增加促進凋亡相關蛋白的表達,并且可以抑制MAPK信號通路的激活。
前期的研究中,Wang等[16]在胃癌中新發現缺氧lncRNA-AK058003通過正向調控SNCG的CpG島甲基化來促進腫瘤的侵襲轉移。同時He等[17]在乳腺癌中發現LncRNA-AK058003通過調控γ-synuclein的表達水平促進乳腺癌的增殖、侵襲和轉移。這兩項研究均表明lncRNA-AK058003在腫瘤中發揮著重要的作用,卻沒有討論該基因與腫瘤凋亡的關系。另外,Ma等[10]發現腫瘤壞死因子能夠誘導lncRNA-HULC調節miR-9的表達促進肝癌細胞凋亡;Huang等[11]研究表明,lncRNA-TUG1在核轉錄因子(SP1)誘導下抑制KLF2蛋白表達,促進肝癌細胞的增殖,抑制腫瘤細胞凋亡。前兩項研究均探討了lncRNA參與肝癌細胞的凋亡的分子機制,未對具體信號通路進行研究。近期的研究發現MAPK信號通路的異常與肝癌的進展和不良預后密切相關[18-20]。這些研究均表明,lncRNA和MAPK信號通路在肝癌的發生機制中扮演著重要的角色。
當然,本研究仍然存在不足:①沒有檢測臨床標本lncRNA的表達量;②檢測方式單一;③lncRNAAK058003調控MAPK信號通路的機制不明確。本研究組后期的研究將對lncRNA-AK058003在肝癌組織中的表達量進行檢測,并探討該基因在肝癌發生中的分子機制。
綜上所述,研究發現lncRNA-AK058003能夠調控MAPK信號通路誘導肝癌細胞凋亡。這將為肝癌的發生、發展、診斷和預后判斷、新治療靶點提供理論依據,有著重要的臨床意義。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA:A Cancer Journal for Clinicians,2015,65(2):87-108.
[2]Liu X,Li L,Li J,et al.Insulin resistance contributes to multidrug resistance in HepG2 cells via activation of the PERK signaling pathway and upregulation of Bcl-2 and P-gp[J].Oncology Reports,2016,35(5):3018-3124.
[3]Hung MH,Tai WT,Shiau CW,et al.Downregulation of signal transducer and activator of transcription 3 by sorafenib:a novel mechanism for hepatocellular carcinoma therapy[J]. World J Gastroenterology,2014,20(41):15269-15274.
[4]Luedde T,Kaplowitz N,Schwabe RF.Cell death and cell death responses in liver disease:mechanisms and clinical relevance[J].Gastroenterology,2014,147(4):765-783.
[5]Ponting CP,Oliver PL,Reik W.Evolution and functions of long noncoding RNAs[J].Cell,2009,136(4):629-641.
[6]Derrien T,Johnson R,Bussotti G,et al.The GENCODE v7 catalog of human long non-coding RNAs:analysis of their gene structure,evolution,and expression[J].Genome Research,2012,22(9):1775-1789.
[7]ENCODE Project Consortium.An integrated encyclopedia of DNA elements in the human genome[J].Nature,2012,489(7414):57-74.
[8]Mercer TR,Dinger ME,Mattick JS.Long non-coding RNAs:insights into functions[J].Nature Reviews Genetics,2009,10(3):155-159.
[9]George J,Patel T.Noncoding RNA as therapeutic targets for hepatocellular carcinoma[J].Seminars in Liver Disease,2015,35(1):63-74.
[10]Ma Y,Huang D,Yang F,et al.Long Noncoding RNA Highly Upregulated in Liver Cancer Regulates the Tumor Necrosis Factor-α-Induced Apoptosis in Human Vascular Endothelial Cells[J].DNA Cell Bio,2016.PMID:26981838.
[11]Huang MD,Chen WM,Qi FZ,et al.Long non-coding RNA TUG1 is up-regulated in hepatocellular carcinoma and promotes cell growth and apoptosis by epigenetically silencing of KLF2[J].Molecular Cancer,2015,14(9):165.
[12]Zhang MX,Xu XM,Zhang P,et al.Effect of silencing NEK2 on biological behaviors of HepG2 in human hepatoma cells and MAPK signal pathway[J].Tumor Biology,2016,37(2):2023-2035.
[13]Horvitz HR.Genetic control of programmed cell death in the nematode Caenorhabditis elegans[J].Cancer Research,1999,59(7)1701s-1706s.
[14]White E.Mechanisms of apoptosis regulation by viral oncogenes in infection and tumorigenesis[J].Cell Death And Differentiation,2006,13(8):1371-1377.
[15]Wang F,Wang H,Sun X,et al.Apoptosis-induction is a novel therapeutic strategy for gastrointestinal and liver cancers[J].Current Gene Therapy,2015,15(2):193-200.
[16]Wang Y,Liu X,Zhang H,et al.Hypoxia-inducible lncRNA-AK058003 promotes gastric cancer metastasis by targeting gamma-synuclein[J].Neoplasia,2014,16(12):1094-1106.
[17]He K,Wang P.Unregulated long non-coding RNA-AK 058003 promotes the proliferation,invasion and metastasis of breast cancer by regulating the expression levels of the γ-synuclein gene[J].Experimental and Therapeutic Medicine,2015,9(5):1727-1732.
[18]Zhong W,Shen WF,Ning BF,et al.Inhibition of extracellular signal-regulated kinase1 by adenovirus mediated small interfering RNA attenuates hepatic fibrosis in rats[J]. Hepatology,2009,50(5):1524-1536.
[19]Tsuboi Y,Ichida T,Sugitani S,et al.Overexpression of extracellular signal-regulated protein kinase and its correlation with proliferation in human hepatocellular carcinoma[J].Liver International,2004,24(5):432-436.
[20]Jia YL,Shi L,Zhou JN,et al.Epimorphin promotes human hepatocellular carcinoma invasion and metastasis through activation of focal adhesion kinase/extracellular signal regulated kinase/matrix metalloproteinase-9 axis[J].Hepatology,2011,54(5):1808-1818.
Mechanism of lncRNA-AK058003 in liver cancer cells apoptosis
HE Xiaoqin XU Ximing YU Jiajun GAN Yuanyuan HAN Nana ZHANG Meixia
Cancer Center,Renmin Hospital of Wuhan University,Hubei Province,Wuhan430060,China
R735.7
A
1673-7210(2016)09(c)-0023-04
2016-04-14本文編輯:任念)
湖北省自然科學基金項目(2012FKC14301)。
徐細明(1976-),男,博士,主任醫師,碩士生導師;研究方向:lncRNA在肝癌發生發展的機制研究。

