現場模擬添加磷、鐵及膠體對北部灣2007年春季生物固氮的影響
連忠廉,鄭愛榕,黃楚光
1 國家海洋局南海分局南海環境監測中心,廣州 510300 2 廈門大學海洋學系,廈門 361005
?
現場模擬添加磷、鐵及膠體對北部灣2007年春季生物固氮的影響
連忠廉1,2,*,鄭愛榕2,黃楚光1
1 國家海洋局南海分局南海環境監測中心,廣州5103002 廈門大學海洋學系,廈門361005
生物固氮是海洋氮循環的重要過程。固氮作用能夠促進海洋初級生產力的提高,增強海洋吸收CO2能力,對于降低大氣CO2濃度,減緩溫室效應具有重要意義。2007年春季對北部灣海區進行了現場模擬添加P,Fe和膠體實驗,并應用乙炔還原法(ARA,Acetylene Reducing Activity)分析其固氮速率,研究其主要影響因素。結果表明,溫鹽與固氮速率相關性不顯著(P>0.05)。對固氮速率來說,外加P其變化范圍為-97%—545%,外加Fe其變化范圍為-86%—146%,外加膠體其變化范圍為-96%—1456%。對葉綠素含量而言,外加P其變化范圍為-24%—50%,外加Fe其變化范圍為-32%—36%,外加膠體其變化范圍為-53%—41%。N可能是春季北部灣海區浮游植物生長的限制因子,固氮作用主要受到P限制,而外加膠體對固氮生物和固氮速率表現出較大的促進作用。
固氮速率;ARA法;磷;鐵;膠體
海洋生物固氮是海洋氮循環的重要過程[1],為海洋生物生長提供新的氮源[2],固氮作用能夠影響海洋對大氣二氧化碳的收支平衡,在一定程度上能夠緩解全球氣候變暖[3]。較早的研究認為束毛藻(Trichodesmium)是海洋中唯一光合自養型固氮生物[4]。近年來分子微生物技術的研究表明其它含有固氮基因(nifH)的微生物也具有固氮能力[5]。因此,固氮生物的固氮能力可能遠比此前研究所揭示的大得多[6]。
盡管海洋固氮生物有巨大的固氮潛力,其固氮速率卻受到各種物理和化學因子的限制,使得固氮生物的固氮總量不可能無限增加。其中,溫度與鹽度等環境因子可能會影響海洋中固氮生物的生長和固氮速率[7-8]。而長期以來,有關海洋環境中生物固氮影響因素的爭論主要集中在P、Fe等限制性營養鹽上[9-12]。Tyrrell[13]等的研究結果表明,海洋中貧營養的上層水體N被大量消耗,而海水中仍有少量的P存在,P被認為是在地質年代學上對固氮作用起限制作用的元素。而Walve[14]等研究表明在一定條件下P、N對生物固氮表現為共同限制作用。鐵是一種重要的微量營養元素,限制了高氮低生產力海區浮游植物的生長[9]。因其為固氮酶的重要組成成分,少量Fe也能夠對固氮作用起限制作用[11]。與N,P類似,Fe,P對固氮作用也會表現為共同限制作用[4]。此外,膠體廣泛存在于海洋中,其作為營養鹽,痕量金屬,營養性有機碳,痕量有機物等物質重要載體,對許多浮游植物生產具有促進作用,同樣膠體也會對固氮生物產生影響[15]。基于海洋環境的復雜性,目前國內對海洋生物固氮的環境影響因素和海洋生物固氮規律的了解甚少,僅見張燕英[16]等在實驗室培養條件下研究了鹽度、晝夜變化、溫度及阿特拉津對2 種海洋固氮藍藻固氮活性的影響。關于P、Fe對生物固氮的研究較多,但對于其影響的機制仍不清楚,而膠體對生物固氮的影響較少,亟待深入研究[15]。因此,探討P、Fe和膠體等物理化學因子對海洋生物固氮的影響,解釋海水營養環境變化對生物固氮的影響機制具有重要意義。
本研究選擇北部灣海域為研究對象。北部灣灣內的溫度、鹽度等要素受到陸地和河流因素的影響。此外,P和Fe等營養元素也受到各河流和大氣沉降的共同作用,還有灣中水體膠體含量豐富。因此,通過現場模擬添加實驗研究P、Fe和膠體對春季北部灣生物固氮速率的影響,來探究其固氮作用對各營養環境的響應,為評估物理化學因素對生物固氮的影響提供依據。
1 實驗材料與方法
1.1樣品采集

圖1 中國北部灣采樣站位Fig.1 Sampling sites in Beibu Gulf of China
2007年4—5月中國科學院南海海洋研究所春季航次(“實驗二號”考察船)期間,共采集9個表層水樣,由北到南依次為C01、C02、C03、C04、C05、C06、C07、C08、C09(采樣站位見圖1,經緯度見表1)。
1.2方法
1.2.1溫度鹽度的測定
采樣站位的溫度和鹽度由CTD(Conductance Temperature Depth,型號為Sea-Bird 911Plus) 現場測量獲得,溫度、電導率的測量精度分別為±0.004℃和±0.003s/m。
1.2.2營養鹽的測定
到達指定站位后,用CTD Niskin采水器采集一定體積的表層海水,0.45 μm醋酸濾膜過濾水樣,然后用船載723OG分光光度計分析各營養鹽濃度。營養鹽和葉綠素的測定方法嚴格按照《海洋監測規范第4部分:海水分析》(GB 17378.4—2007)進行。
1.2.3現場模擬添加實驗
設置P(磷酸二氫鈉)的濃度梯度為C,C+0.08,C+0.16,C+0.32,C+0.48 μmol/L,Fe(FeCl3)的濃度梯度為C,C+0.22,C+0.44,C+0.88,C+1.32 μmol/L,C為水樣中原有營養鹽的濃度,膠體(粒徑介于0.22 μm和10 kDa)的現場制備過程見陳丁等[17],并設0,2%,50%,100% 4個膠體百分比濃度。根據距離灣口的遠近,隨機選取C02、C05、C07、和C09站位進行模擬添加實驗。由于具有操作簡便、高靈敏度、較快的分析速度以及較低的耗資等優點,采用乙炔還原法(ARA,Acetylene Reducing Activity)測定固氮速率[18]。分別量取250 mL,1 L混合均勻的表層海水于300 mL鹽水瓶和1.5 L培養瓶中,在兩瓶中按照設定的營養鹽或膠體百分比濃度分別進行添加實驗,同時做平行樣。用含硅膠墊的橡皮塞密封鹽水瓶口,同時蓋上1.5 L的培養瓶,用氣體進樣針從氣袋里抽取5.00 mL純乙炔氣體,注入密閉鹽水瓶的上層空氣中(培養瓶中不添加乙炔),并上下搖晃使氣液混合達到平衡,將上述鹽水瓶和培養瓶放入已準備好的現場流動水培養箱進行培養,培養時間為12 h。經培養后的鹽水瓶,用5.00 mL氣體進樣針抽取瓶內的氣體,轉入到氣相色譜專用氣體頂空瓶內保存,用封口膜密封頂空瓶塞。
頂空瓶倒置放在陰涼避光處保存,帶回實驗室進行氣體分析。往培養后的1.5 L培養瓶內加入兩滴1%碳酸鎂溶液,水樣經47 mm Whatman GF/F玻璃纖維膜過濾后,將所得微孔濾膜用錫箔包好,并冷凍保存,帶回實驗室測定葉綠素含量。葉綠素含量作為浮游植物的生長指標。
1.2.4固氮速率的測定
用GC900型氣相色譜儀(上海科創儀器廠)對頂空氣體進行分析,并按下式計算樣品的固氮速率:
式中,V為固氮速率(μg N L-1h-1),C總為乙烯的總含量(μmol/mol),V氣為現場培養下氣相的體積(本實驗為50 mL),V液為現場培養下液相的體積(本實驗為250 mL),M為N2的摩爾質量(28 g/mol),n為C2H2∶N2的換算因子(設n=4)[7],t為現場培養時間(t=12 h)。
1.3數據處理
本研究采用相對固氮速率和相對葉綠素含量來說明加富對生物固氮速率以及葉綠素含量的影響。其中,相對固氮速率=(實驗組的乙烯含量-對照組乙烯含量)/對照組乙烯含量×100%,相對葉綠素含量=(實驗組的葉綠素含量-對照組葉綠素含量)/對照組葉綠素含量×100%。實驗所有數據都通過軟件SPSS 17.0處理。
2 結果與討論
2.1春季北部灣表層水體固氮速率的影響因素分析
9個調查站位的固氮速率見表1。由表1可知,不同站位有不同的固氮速率,溫度、鹽度與其相關性不顯著(R<0.3,P>0.05)。固氮速率平均值為2202.24 pmolN L-1h-1,最高值出現在C06站位,最低值出現在C04 站位,最高值是最低值的28.7倍。調查過程中觀察到C06站位海面風平浪靜,水體呈現微紅色,而該站位溶解態無機磷(DIP,Dissolved inorganic phosphorus)的濃度極低(表2),將表層水樣生物固定以后,帶回實驗室顯微觀察發現有大量的束毛藻存在。束毛藻是貧營養熱帶和亞熱帶海區最主要的固氮生物,是一種重要的赤潮生物[19]。可以推斷,C06站位發生“水華”,束毛藻大量繁殖,因而有極高的固氮速率。同時,由表1和表3可以看出,因北部灣營養鹽含量相對較高,其固氮速率小于北太洋等寡營養鹽海域,這與C06的觀測結果相一致。
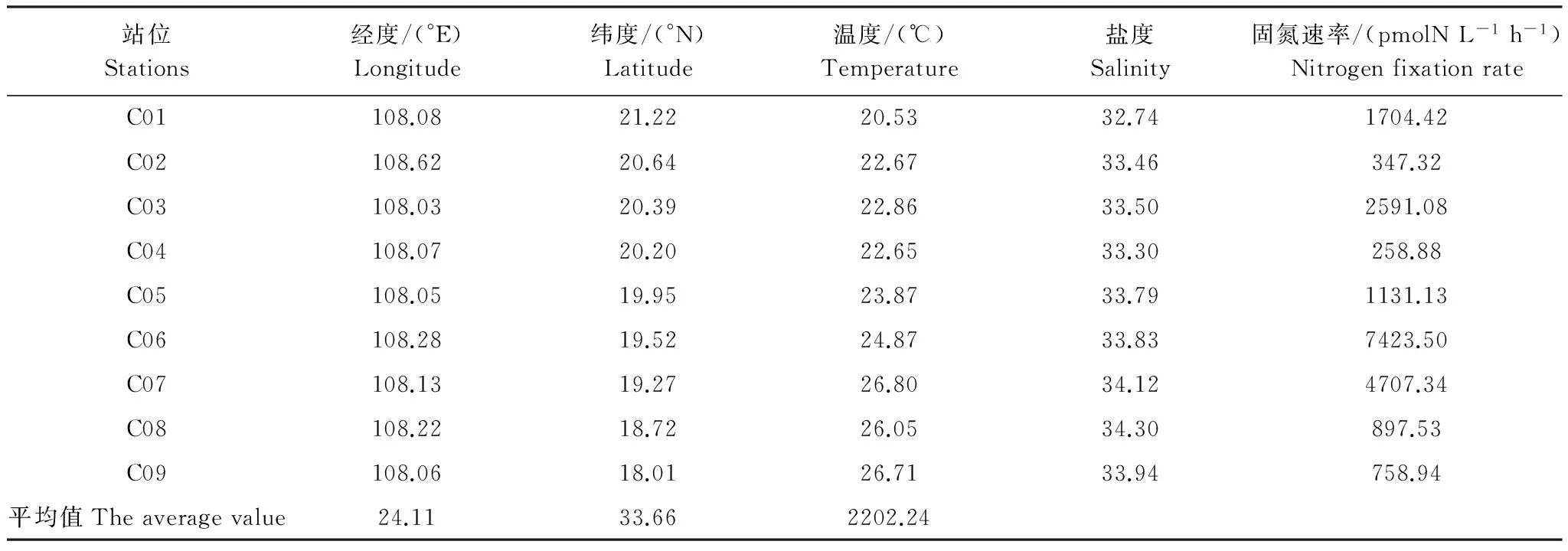
表1 春季北部灣表層水體固氮速率的積分值

表2 北部灣春季表層水體營養鹽相關數據
-:未檢出;/表示未測定;DIN:溶解態無機氮 Dissolved inorganic nitrogen;DN:溶解態氮 Dissolved nitrogen;TN:總氮Total nitrogen;DIP:溶解態無機磷 Dissolved inorganic phosphorus;DP:溶解態磷 Dissolved phosphorus;TP:總磷 Total phosphorus
此外,由表2觀測數據對固氮速率與營養鹽相關性進行統計分析,固氮速率與溶解態無機氮(DIN)與DIP比值的相關關系非常弱(R=0.219,P=0.677),與總氮(TN)與總磷(TP)比值表現出弱的負相關(R=-0.103,P=0.846),而與溶解態氮(DN)與溶解態磷(DP)的相關關系最強(R=0.950,P=0.013),且氮磷比越高,固氮速率越高。這與Karuk[20]等研究結果具有較高固氮速率的海域也具有較高氮磷比相一致,說明固氮生物可以利用溶解態氮磷(有機氮磷和無機氮磷)。同樣的,在C06和C07站檢測的固氮速率遠高于其他站位,相應的DIP含量為未檢出,而DP的含量也相對較低,由此可以推斷出生物固氮過程中需要消耗大量的DP,DP是其固氮速率的限制因子[1]。而已有現場測定束毛藻的溶解態有機磷(DOP)吸收值相當高,為(170—300)nmol Chl-a-1h-1,也說明DOP是束毛藻磷的主要供應者[21]。

表3 各海域固氮速率的概述
*ARA為乙炔還原法,除本研究的C2H2∶N2分配比為4∶1,其他C2H2∶N2分配比為3∶1;15N:15N同位素測定法
2.2對葉綠素含量和固氮速率的影響分析
2.2.1外加P對葉綠素含量和固氮速率的影響

圖2 春季外加P對生物固氮速率和葉綠素含量的影響 Fig.2 Effect of N2 fixation rates and chlorophyll by P addition in spring0.08-N,0.08-C分別表示添加濃度為0.08μmol/L條件下的相對固氮速率和相對葉綠素含量
由圖2可知,外加不同濃度的P對固氮速率的影響不同,表現為抑制或促進作用。外加0.08 μmol/L的磷酸二氫鈉,除了C09站位以外,其它3個站位都起到促進固氮速率的作用,相對固氮速率變化范圍為-92%—242%(P<0.05)。外加其它濃度的磷酸二氫鈉對固氮速率的影響則較為復雜。不同站位受到P添加的影響也不同:外加P對C02,C09站位表現為較明顯的促進作用(P<0.05),最大促進作用為545%。而C05站位除了低濃度促進固氮速率之外,較高濃度的P對固氮速率都表現為明顯的抑制作用(P<0.05),最大抑制作用為-97%。外加P對固氮速率的抑制作用不明顯(P>0.05),能夠較多地促進固氮生物的固氮作用,進一步證明了春季北部灣海區固氮作用受到P限制。
與外加P對固氮速率的影響不同,P添加對葉綠素含量的影響程度相對較低。高濃度的P對葉綠素含量表現為明顯的抑制作用,最大抑制作用為-12%。但在C05站位,外加P對葉綠素含量表現出較高的生長情況,尤其是添加高濃度的P,相對葉綠素含量上升了近50%,另外,在C05站位添加P對固氮速率更多地表現為抑制作用。可見,外加磷對葉綠素含量和固氮速率變化不存在一致性,這可能說明浮游植物的生長有時并不伴隨著固氮生物的增加,或者說其他浮游植物的增加大于固氮類生物的增加以及浮游動物的攝食等因素影響,從而降低了其固氮速率。
2.2.2外加Fe對葉綠素含量和固氮速率的影響
由見圖3可知,外加Fe對固氮速率的影響不明顯(P>0.05),且較多表現為抑制作用,這與外加P的影響相反,最大抑制作用為-86%,最大促進作用為146%。這可能與北部灣大氣沉降輸入較高的Fe有關,使外加Fe并不能較大地促進固氮生物生產,從而表現出部分抑制作用。
與外加P作用相比,外加Fe對葉綠素的含量有一定的促進作用,上升的相對葉綠素含量都在40%以下,變化范圍為-32%—36%。Fe是一種固氮微生物的速率限制性營養鹽,可能會限制貧營養海區固氮生物的固氮速率[26]。北部灣有高的大氣沉降作用,能夠向表層海水提供較多的Fe。因此,水體中的Fe并不是浮游植物生長限制因素,外添加的Fe導致水體中含量過高抑制了浮游植物的固氮能力,降低其固氮速率。
2.2.3外加膠體對葉綠素含量和固氮速率的影響
由圖4可知,外加膠體對固氮速率的促進作用明顯(P<0.05),除了C09站位,其余3個站位都顯示出較高的固氮速率上升,尤其是在C07站位,當添加膠體濃度百分比為2%時,相對固氮速率達1459.3%;C09站位的固氮速率僅表現出輕微的下降。膠體具有極強的絡和能力,是營養鹽,痕量金屬,營養性有機碳,痕量有機物等物質的重要載體[27]。固氮作用需要各種營養要素的綜合作用,適當的膠體濃度能夠極大地提高固氮速率。
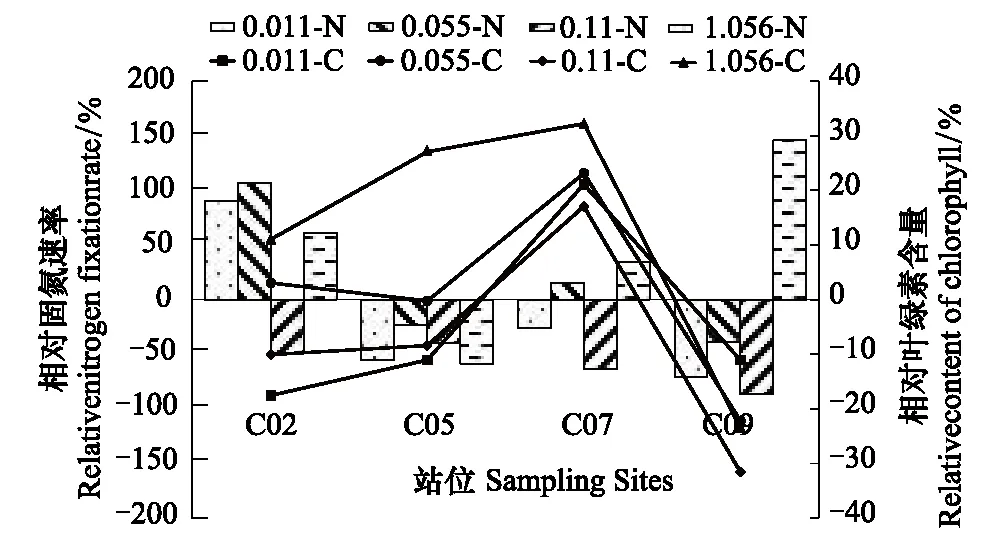
圖3 春季外加鐵對生物固氮速率的影響Fig.3 Effect of N2 fixation rates by iron addition in spring 0.08-N,0.08-C分別表示添加濃度為0.08μmol/L條件下的相對固氮速率和相對葉綠素含量
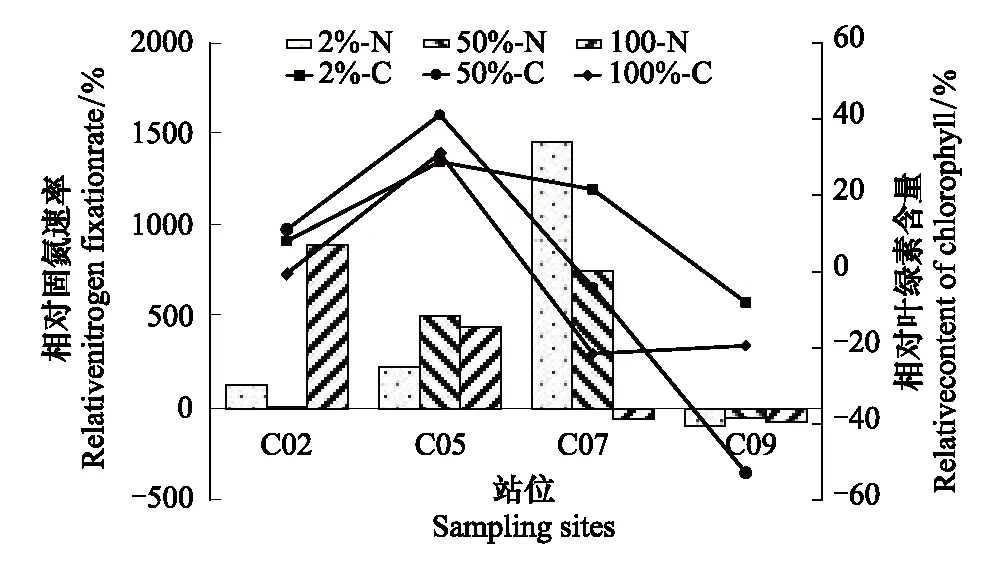
圖4 春季外加膠體對生物固氮速率的影響 Fig.4 Effect of N2 fixation rates by colloid addition in spring2%-N,2%-C分別表示在添加膠體比例為2%條件下的相對固氮速率和相對葉綠素含量
幾乎所有添加膠體的實驗組葉綠素含量都增加,僅C09站表現出抑制作用,葉綠素含量變化范圍為-53%—41%,而且不同濃度的膠體之間差異不顯著(P>0.05),可能是因為膠體在不同的濃度下所產生的效應是一致的,能為水體提供一種動態平衡作用。
2.3不同現場添加實驗對葉綠素含量和固氮速率的影響比較
本研究表明,外加P對固氮速率的促進作用高于外加Fe的促進作用,外加P的最大相對固氮速率是添加Fe的最大相對固氮速率的3.7倍。已有研究表明固氮生物對P的需求是Fe的30—300倍[4],而北部灣海區又處于較明顯的P限制狀態,因此,外加P能夠較明顯地促進固氮速率。MILLS[4]等對北大西洋東部海區的研究結果表明,P、Fe是固氮生物固氮作用了共同限制因子。而本研究得出P可能是北部灣海區固氮作用的限制因子,北部灣海區的生物固氮主要受P的限制作用。
此外,P、Fe對葉綠素的促進作用不明顯,相關性分析表明,浮游植物的生產力與固氮生物的固氮速率沒有顯著的相關關系。群落的初級生產力受到N限制,而固氮作用則受到Fe-P的共同限制[4]。Wu[10]等的研究結果也表明,N限制了浮游植物的生長,而固氮作用可能受到Fe的限制。 因此,北部灣海區浮游植物的生長可能受到N限制的作用,固氮作用主要受到P的限制作用。
膠體能夠將水體中營養物質和痕量金屬物質進行絡合,促進浮游植物的固氮作用。所以,外加膠體后固氮作用上升顯著。另外,Bauer[28]等對幾個大洋的C、N成分的進行研究表明,膠體有機部分的N比較缺乏,C/N比值為20—22,而低分子有機物的N含量較高,然而C/N比值為也只有2—5。在外加膠體后,浮游植物有一定的生長但生長不顯著,這也進一步證明了北部灣海水膠體中N可能是浮游植物生長的限制因素。對比最大促進作用是膠體,其次為P,Fe最小,在北部灣表層水體中對浮游植物,這可能和膠體本身含有大量的營養鹽和天然絡合物有關。
3 結論
北部灣春季表層海水不同站位因營養鹽含量不同其固氮速率而存在差異,溫鹽對固氮速率的影響較小。春季北部灣水體中高的固氮速率對應著較高的DN/DP,說明固氮生物在固氮過程中需要消耗大量溶解態磷。北部灣春季固氮速率較寡營養鹽海域低,可能同北部灣具有較高的營養鹽含量有關。
同時外加P、Fe和膠體現場模擬實驗結果表明,單獨進行的Fe或P的添加對固氮生物固氮速率的促進作用遠小于膠體的促進作用。此外,浮游植物生長與固氮速率之間沒有顯著的相關關系,北部灣春季浮游植物的生長可能受N限制,固氮作用則主要受P的限制。可以看出,受到營養鹽的限制的北部灣固氮作用,將影響到北部灣氮源以及氮的生物地球化學過程。
[1]Montoya J P, Holl C M, Zehr J P, Hansen A, Villareal T A, Capone D G. High rates of N2fixation by unicellular diazotrophs in the oligotrophic Pacific Ocean. Nature, 2004, 430(7003): 1027-1032.
[2]Steward G F, Zehr J P, Jellison R, Montoya J P, Hollibaugh J T. Vertical distribution of nitrogen-fixing phylotypes in a meromictic, hypersaline lake. Microbial Ecology, 2004, 47(1): 30-40.
[3]Hutchins D A, Fu F X, Zhang Y, Warner M E, Feng Y, Portune K, Bernhardt P W, Mulholland M R. CO2control ofTrichodesmiumN2fixation, photosynthesis, growth rates, and elemental ratios: implications for past, present, and future ocean biogeochemistry. Limnology and Oceanography, 2007, 52(4): 1293-1304.
[4]Mills M M, Ridame C, Davey M, La Roche J, Geider R J. Iron and phosphorus co-limit nitrogen fixation in the eastern tropical North Atlantic. Nature, 2005, 429(6989): 292-295.
[5]Zehr J P, Waterbury J B, Turner P J, Montoya J P, Omoregie E, Steward G F, Andrew Hansen A, Karl D M. Unicellular cyanobacteria fix N2in the subtropical North Pacific Ocean. Nature, 2001, 412(6847): 635-638.
[6]Lou Y W, Lima I D, Karl D M, Doney S C. Data-based assessment of environmental controls on global marine nitrogen fixation. Biogeosciences Discussions, 2013, 10(4): 7367-7412.
[7]Fu F X, Bell P R F. Factors affecting N2fixation by the cyanobacteriumTrichodesmiumsp. GBRTRLI101. FEMS Microbiology Ecology, 2003, 45(2): 203-209.
[8] Shiozaki T, Kodama T, Kitajima S, Sato M, Furuya K. Advective transport of diazotrophs and importance of their nitrogen fixation on new and primary production in the western Pacific warm pool. Limnology and Oceanography, 2013, 58(1): 49-60.
[9]Martin J H, Fitzwater S E. Iron deficiency limits phytoplankton growth in the north-east Pacific subarctic. Nature, 1988, 331(6154): 341-343.
[10]Wu J F, Sunda W, Boyle E A, Karl D M. Phosphate depletion in the western North Atlantic Ocean. Science, 2000, 289(5480): 759-762.
[11]Moore J K, Doney S C. Iron availability limits the ocean nitrogen inventory stabilizing feedbacks between marine denitrification and nitrogen fixation. Global Biogeochemical Cycles, 2007, 21(2): GB2001.
[12]Orchard E D, Ammerman J W, Lomas M W, Dyhrman S T. Dissolved inorganic and organic phosphorus uptake inTrichodesmiumand the microbial community: the importance of phosphorus ester in the Sargasso Sea. Limnology and Oceanography, 2010, 55(3): 1390-1399.
[13]Tyrrell T. The relative influences of nitrogen and phosphorus on oceanic primary production. Nature, 1999, 400(6744): 525-531.
[14]Walve J, Larsson U. Seasonal changes in Baltic Sea seston stoichiometry: the influence of diazotrophic cyanobacteria. Marine Ecology Progress Series, 2010, 407: 13-25.
[15]Zheng A R, Chen D, Lian Z L. Effects of colloids on the nitrogen fixation rates in surface water in Beibu Gulf of China. Advanced Materials Research, 2013, 610-613: 15-19.
[16]張燕英, 董俊德, 張偲, 王友紹, 王漢奎, 黃良民. 海洋固氮藍藻Calothrixsp.與Lyngbyasp.固氮生理的研究. 熱帶海洋學報, 2006, 25(4): 46-50.
[17]陳丁, 鄭愛榕, 劉春蘭, 陳敏. 天然膠體中磷的含量及分布. 海洋學報, 2006, 28(3): 144-150.
[18]Dilworth M J. Acetylene reduction by nitrogen-fixing preparations from clostridium pasteurianum. Biochimica et Biophysica Acta, 1966, 127(2): 285-294.
[19]Capone D G, Zehr J P, Paerl H W, Bergman B, Carpenter E J. Trichodesmium, a globally significant marine cyanobacterium. Science, 1997, 276(5316): 1221-1229.
[20]Krauk J M, Villareal T A, Sohm J A, Montoya J P, Capone D G. Plasticity of N: P ratios in laboratory and field populations ofTrichodesmiumspp. Aquatic Microbial Ecology, 2006, 42(3): 243-253.
[21]McCarthy J J, Carpenter E J.Oscillatoria(Trichodesmium)Thiebautii(Cyanophyta) in the central north Atlantic Ocean. Journal of Phycology, 1979, 15(1): 75-82.
[22]Hanson R B, Gundersen K R. Bacterial nitrogen-fixation in a polluted coral-reef flat ecosystem, Kaneohe Bay, Oahu, Hawaiian islands. Pacific Science, 1976, 30(4): 385-393.
[23]Carpenter E J, Price C C. Nitrogen fixation, distribution, and production ofOscillatoria(Trichodesmium) spp. in the western Sargasso and Caribbean Seas. Limnology and Oceanography, 1977, 22(1): 60-72.
[24]Saino T, Hattori A. Estimate of growth rate of phytoplankton in surface waters of Bering Sea and northern North Pacific. Marine Science Communication, 1977, 3(1): 1-19.
[25]Orcutt K M, Lipschultz F, Gundersen K, Arimoto R, Michaels A F, Knap A H, Gallon J R. A seasonal study of the significance of N2fixation byTrichodesmiumspp. at the Bermuda Atlantic Time-series Study (BATS) site. Deep Sea Research Part II: Topical Studies in Oceanography, 2001, 48(8-9): 1583-1608.
[26]Paerl H W, PrufertBebout L E, Guo C Z. Iron-stimulated N2fixation and growth in natural and cultured populations of the planktonic marine cyanobacteriaTrichodesmiumspp. Applied and Environmental Microbiology, 1994, 60(3): 1044-1047.
[27]鄭愛榕, 陳敏, 呂娥, 楊俊鴻, 程遠月. 海洋膠體中的氮、磷和鐵對微藻生長的效應. 自然科學進展, 2004, 14(3): 339-343.
[28] Bauer J E, Ruttenberg K C, Wolgast D M, Monaghan E, Schrope M K. Cross-flow filtration of dissolved and colloidal nitrogen and phosphorus in seawater: results from an intercomparison study. Marine Chemistry, 1996, 55(1/2): 33-52.
Factors that affected nitrogen fixation by the addition of phosphorus, iron, and colloids in the surface water of the Beibu Gulf in spring, 2007
LIAN Zhonglian1,2,*,ZHENG Airong2, HUANG Chuguang1
1SouthChinaSeaBranch,StateOceanicAdministration,Guangzhou510300,China2DepartmentofOceanography,CollegeofOceanandEarthSciences,XiamenUniversity,Xiamen361005,China
Nitrogen fixation is an important process in marine nitrogen recycling. It can enhance marine primary productivity and marine carbon fixation capacity and reduce CO2concentration in the atmosphere, thus mitigating the greenhouse effect. The Beibu Gulf is a semi-enclosed bay located northwest of the South China Sea. In the Beibu Gulf, P and Fe are influenced by river input and atmospheric deposition, and the water in Beibu Gulf is rich in colloids. In order to study the effects of P, Fe, and colloids on the nitrogen fixation rate and nitrogen fixation in response to the nutritional environment, we conducted a field addition experiment for P, Fe, and colloid simulation in the spring of 2007. Surface water samples were collected from nine study sites between April and May 2007. P, Fe, and colloids were separately added for a scene simulation in the study sites of C02, C05, C07, and C09. Concentration gradients of P (potassium dihydrogen phosphate) were set as C, C+0.08, C+0.16, C+0.32, and C+0.48 μmol/L. Concentration gradients of Fe were set as C, C+0.22, C+0.44, C+0.88, and C+1.32 μmol/L (C is the concentration of nutrients in in situ water samples). Concentration gradients of colloids (particle size, between 0.22 μm and 10 kDa) were set as 0%, 2%, 50%, and 100%. The acetylene-reducing activity method was used to study nitrogen fixation and factors that affect it. The results showed that the contributions of temperature and salinity to the nitrogen fixation rate were low, while P, Fe, and colloids increased the nitrogen fixation rate. The nitrogen fixation rate was greatly promoted by adding colloids, while the addition of P and Fe did not affect the nitrogen fixation rate to a great extent. However, variations in the nitrogen fixation rate due to the addition of P, Fe, and colloids were -97% to 545%, -86% to 146%, and -96% to 1456%, respectively, and variations in chlorophyll contents were -24% to 50%, -32% to 36%, -53% to 41%, respectively. Differences in the nitrogen fixation rate were due to different nutrient concentrations in the surface water of the study sites in the spring of the Beibu Gulf. The nitrogen fixation rate was strongly related to dissolved nitrogen/dissolved phosphorus (DP), which indicated that a large amount of DP was consumed by organisms that perform nitrogen fixation. The high nutrient content in the Beibu Gulf may be the reason why the nitrogen fixation rate in the Beibu Gulf was lower than that in the oligotrophic sea. Moreover, there was no significant correlation between the rate of phytoplankton growth and nitrogen fixation rate. Phytoplankton growth limited the amount of nitrogen, and nitrogen fixation limited the amount of phosphorus. Effects of nitrogen fixation, which was limited by nutrients in the Beibu Gulf, could have a great influence on nitrogen sources and nitrogen biogeochemical processes. The results suggest that nitrogen may be a limiting factor for marine primary productivity in the spring in the Beibu Gulf, phosphorus is a limiting factor for the nitrogen fixation rate, and the addition of colloids enhances the nitrogen fixation rate.
N2fixation; ARA method; phosphorus; iron; colloids
國家自然科學基金重大研究計劃重點項目 (90411016)
2014-11-24; 網絡出版日期:2015-10-30
Corresponding author.E-mail: lianzhonglian@aliyun.com
10.5846/stxb201411242327
連忠廉,鄭愛榕,黃楚光.現場模擬添加磷、鐵及膠體對北部灣2007年春季生物固氮的影響.生態學報,2016,36(14):4355-4362.
Lian Z L,Zheng A R, Huang C G.Factors that affected nitrogen fixation by the addition of phosphorus, iron, and colloids in the surface water of the Beibu Gulf in spring, 2007.Acta Ecologica Sinica,2016,36(14):4355-4362.

