空氣微生物群落解析方法:從培養到非培養
方治國,郝翠梅,姚文沖,歐陽志云
1 浙江工商大學環境科學與工程學院,杭州 310018 2 中國科學院生態環境研究中心城市與區域生態國家重點實驗室,北京 100085
?
空氣微生物群落解析方法:從培養到非培養
方治國1,*,郝翠梅1,姚文沖1,歐陽志云2
1 浙江工商大學環境科學與工程學院,杭州3100182 中國科學院生態環境研究中心城市與區域生態國家重點實驗室,北京100085
隨著世界范圍內流行性疾病以及我國空氣霧霾事件的不斷發生,空氣生物性污染的研究開始受到高度重視,其研究方法也隨著分子生物學技術的快速發展而不斷更新,由早期以生化技術為基礎的研究方法轉變為以現代分子生物學技術為基礎的研究方法。綜述了空氣微生物群落多樣性解析方法從培養到非培養的發展過程,包括培養技術法、BIOLOG技術、生物標記法、基因指紋圖譜技術、核酸雜交技術、實時熒光定量PCR、空氣微生物宏基因組學及基因芯片技術,闡述了這些技術的基本原理,比較了各種技術的優缺點并重點介紹了它們在空氣微生物群落多樣性研究中的應用概況,最后展望了空氣微生物學研究的發展方向。
空氣微生物多樣性;生化技術;分子生物學技術;宏基因組學
隨著世界范圍內流行性疾病以及我國空氣霧霾事件的頻繁發生,空氣生物性污染的研究開始受到高度重視。空氣中廣泛分布的細菌、真菌孢子、放線菌和病毒等微生物粒子與空氣環境質量以及人類健康等密切相關[1-2],小部分具有活性的生物粒子能夠導致各種微生物疾病的發生[3]。由生物粒子組成的氣溶膠,可間接作為云凝結核和冰核,導致云滴和冰晶的形成,在雨雪的形成過程中發揮著非常重要的功能,并且可通過直接散射或吸收太陽能輻射在全球氣候變化中起著至關重要的作用[4-5]。到目前為止,空氣微生物的研究工作已有約180年的歷史,其研究方法也由傳統微生物培養法逐步轉化到現代分子生物學法。傳統的微生物培養法只能檢測空氣中可培養微生物,約占空氣中微生物總數的0.1%—10%,在營養貧瘠的空氣中比例可能更少,因此以可培養微生物的種類和濃度檢測空氣微生物的種群和數量會嚴重低估空氣中微生物的存在[6]。然而,以PCR為基礎的現代分子生物學法能夠檢測到空氣中微生物的全部信息,真實反映空氣中微生物的存在情況。文章綜述了空氣微生物多樣性解析方法的發展過程及應用概況,并闡述了各種研究方法的優缺點及發展方向。
1 以生化技術為基礎的空氣微生物研究方法
以生化技術為基礎的方法是空氣微生物學研究早期發展起來的,主要包括傳統的微生物平板計數與形態學分析方法,以微生物碳源利用能力為基礎的解析方法,基于生物標記的解析方法等,這些方法在空氣微生物的研究歷程中發揮著巨大的作用(表1)。
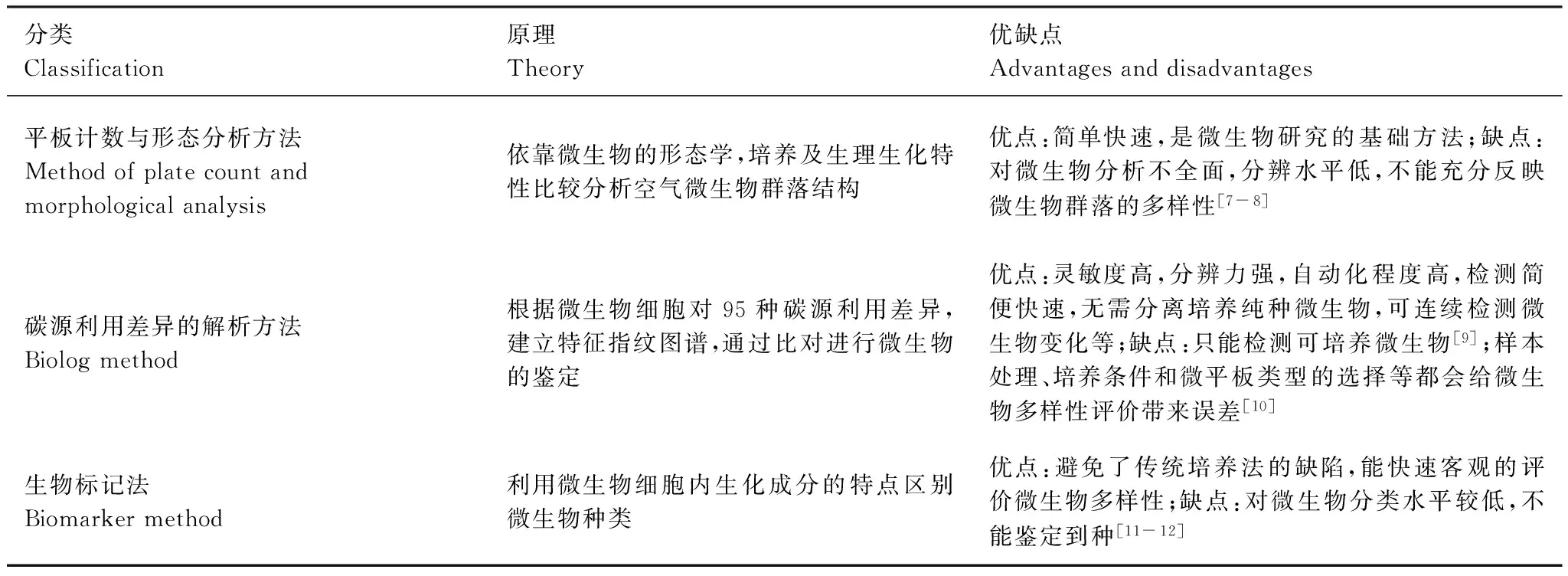
表1 以生化技術為基礎的空氣微生物研究方法
1.1基于傳統的平板計數與形態學分析技術
平板計數與形態學分析是傳統的空氣微生物研究方法,一般用自然沉降或采樣器把空氣中的微生物采集到液體、固體或半固體的采樣介質上,再經過培養繁殖生長成菌落后計數、然后進行分離和純化,利用顯微鏡對其進行形態學觀察,并結合其生理生化特征鑒定種屬分類特性[13]。早期空氣中微生物的發現也是基于以培養為基礎的傳統的平板計數與形態學研究方法,并且其在空氣微生物學發展過程中起了非常重要的作用。早期Lindemann、Lighthart和Shaffer等利用傳統的培養方法做了大量的空氣微生物學研究,取得了豐碩的成果[14-23]。Shelton等研究了美國境內室內外空氣真菌的群落結構特征,為美國工業衛生學者、變態反應癥專科醫師和其他公共衛生從業人員提供了可培養空氣真菌的比較信息[24]。進入20世紀90年代,我國空氣微生物的研究逐漸興起,軍事醫學科學院微生物流行病研究所的胡慶軒先生是我國較早研究空氣微生物的學者,他所采用的研究方法都是以培養為基礎的,為我國學者空氣微生物的研究奠定了基礎[25-26]。之后,方治國、凌琪等分別研究了我國不同城市室內外空氣微生物的污染特征,為空氣微生物污染的控制及城市管理部門制定環境政策法規提供了理論指導[27-33]。以上研究表明,傳統的平板計數與形態學分析方法對于空氣微生物來說是一種較好的研究方法,為世界范圍內空氣微生物基礎數據的儲備提供了基礎。
1.2基于空氣微生物碳源利用差異的解析方法
基于空氣微生物碳源利用差異的分析方法主要是根據微生物代謝類型和對不同碳源的利用能力來評價微生物種類多樣性,其典型代表方法有BIOLOG技術。BIOLOG微生物鑒定系統是由美國的BIOLOG公司于1989年成功研發的,最初主要應用于純種微生物鑒定[34]。1991年,Garland 和Mills首次將BIOLOG技術用來描述微生物群落功能多樣性特征,并在當時引起了微生物生態學者的廣泛關注[34],之后較長時間BIOLOG技術在環境微生物功能多樣性評價研究中得到了廣泛的應用,并在土壤、沉積物和水體等環境中微生物群落多樣性研究中發揮了至關重要的作用[35-37]。將BIOLOG技術用來研究微生物群落功能多樣性的理論依據是BIOLOG代謝多樣性類型的變化與微生物群落組成變化密切相關[38],其原理是利用以微生物群落水平碳源利用類型為基礎的BIOLOG氧化還原技術來表述環境樣品微生物群落特征,運用主成分分析或相似類型的多變量統計分析方法展示不同微生物群落產生的不同代謝多樣性類型[39]。近年來,BIOLOG技術逐漸應用到空氣中微生物碳代謝能力的評價中,并且取得了較好的研究效果。凌琪、龔嬋娟和段魏魏等利用BIOLOG技術分別研究了黃山風景區、杭州不同樣點及塔克拉瑪干沙漠空氣中微生物的碳代謝特征[40-42]。BIOLOG技術為空氣微生物的研究提供了一種全新的思路,能在空氣微生物功能多樣性研究方面發揮重要的作用。
1.3基于生物標記的空氣微生物解析方法
基于生物標記的空氣微生物分析方法主要根據部分生物組分可以作為某些種類微生物的指示標記,以該組分濃度和種類等的變化來指示相關微生物的變化,其主要分為醌指紋法和脂肪酸譜圖法。目前,應用在生物氣溶膠領域以脂肪酸譜圖法為主。該方法主要步驟是通過提取生物氣溶膠中某種生化成分作為生物量標記物,利用氣相、液相、氣質聯用等技術手段對該生化成分進行分類鑒定,其組成模式可作為種群組成的標記。在空氣微生物研究中,3-羥基脂肪酸(10—18碳)可以指示標記內毒素(脂多糖)和革蘭氏陰性菌生物量負荷,支鏈脂肪酸(15—17碳)可以指示標記革蘭氏陽性菌生物量負荷,麥角甾醇可以指示標記真菌生物量負荷,胞壁酸可以指示標記肽聚糖[43]。在基于生物標記的空氣微生物解析方法方面,香港理工大學Lau課題組等做了大量的研究工作,開創了利用生物標志法來確定生物氣溶膠中特定微生物群落的先河[44-48],他們的研究確定了生物標記法能夠為氣溶膠中微生物群落提供定量信息。此外,Bauer等通過測定阿拉伯糖醇和甘露醇的含量對空氣中真菌孢子進行定量示蹤[49];Poole等利用生物標記法的研究結果解釋了人體單核細胞和上皮細胞對農業灰塵的炎癥反應[50];Filippo等利用麥角甾醇,阿拉伯糖醇和甘露醇等作為示蹤劑分析了城市氣溶膠的真菌孢子濃度[51]。綜上所述,生物標記法是空氣中微生物定量研究的又一選擇,正逐步用于生物氣溶膠群落結構的分型和動態監測,并且研究方法日趨成熟,比傳統培養法在取樣和物種鑒定方面更簡單更快。
2 以現代分子生物學技術為基礎的空氣微生物研究方法
由于空氣環境要素的復雜多變,微生物純種分離富集培養的方法不但費時費力,而且存在方法學上的缺陷。一是空氣中大量微生物的不可培養性,使人類無法培養空氣中所有的微生物[6],二是分離富集培養方法具有較強的選擇性,使培養得到的空氣微生物在種類、數量和功能上都無法反映其微生物群落的真實情況[52]。因此,非常有必要研究不依賴微生物培養來進行空氣微生物群落分析的方法,它們主要包括:聚合酶鏈式反應(PCR)、變性梯度凝膠電泳(Denaturing gradient gel electrophoresis, DGGE)和溫度梯度凝膠電泳(Temperature gradient gel electrophoresis, TGGE)、末端限制性酶切片段長度多態性分析(Terminal restriction fragment length polymorphism, T-RFLP)、基因克隆文庫分析(Gene cloning library)、實時熒光定量PCR(RT-PCR)、宏基因組學(Metagenomics)、基因芯片(DNA microarray)等[53](表2)。
2.1基于PCR為基礎的基因指紋圖譜技術
2.1.1DNA 成分多態性圖譜分析(DGGE/TGGE)
DGGE是由Fischer 等于1979 年首先提出的用于檢測DNA 突變的一種電泳技術,其分辨力高于瓊脂糖電泳和聚丙烯酰胺凝膠電泳[64],Muzyer 等首次將DGGE技術應用于分子微生物學研究領域,其在揭示自然界微生物群落遺傳多樣性和種群差異方面具有明顯優越性[65],而TGGE是在DGGE 基礎上衍生出的微生物多樣性研究的重要手段[66]。DGGE技術是對PCR 擴增微生物 rDNA 產生的DNA 片段混合物的分析,自從DGGE技術首次應用于微生物分子生物學研究以來,該技術迅速被廣泛用于土壤[67]、活性污泥[68]、海洋[69]、底泥[54]等樣品中微生物多樣性分析、微生物鑒定及變異等方面的研究。近年來,DGGE/TGGE已越來越多用于空氣中微生物多樣性分析的研究。Nehmé 等利用DGGE方法研究了高分娩期豬圈內空氣中生物氣溶膠粒子的季節分布特征[70],然后利用DGGE和克隆的方法證明了豬圈里存在著高濃度來源于豬糞的產甲烷古生菌,這是首次對生物氣溶膠中古生菌的研究[71];Li 等利用DGGE方法比較研究了4種空氣微生物取樣器的取樣效率[72];Hervàs 等利用DGGE方法研究了空氣細菌從非洲遷移到歐洲高山湖泊的活力和潛力[73];Lecours 等利用DGGE方法研究了乳牛舍生物氣溶膠的特征,結果顯示乳牛舍生物氣溶膠組分復雜,并且在職業性呼吸系統疾病方面起著非常重要的作用[74]。DGGE/TGGE對于空氣中微生物多樣性及其群落結構的研究技術已逐步成熟,與其他方法相結合能對空氣微生物的結構特征及其物化成分有著更好的闡述。

表2 以現代分子生物學技術為基礎的空氣微生物研究方法
2.1.2DNA長度多態性圖譜分析(T-RFLP)
T-RFLP技術是以分子系統學的原理為基礎, 綜合運用了PCR技術、DNA限制性酶切技術、熒光標記技術和DNA 序列自動分析技術,在DNA水平上通過對特定核酸片段長度多態性的測定來分析比較微生物群落結構和功能[75]。該方法依據微生物的比較基因組學信息,選取一段具有系統進化標記特征的DNA序列為目的分析序列,并據此設計出理想引物,用熒光物質標記出1個或2個引物的5′端(2個引物同時標記時,要用不同的熒光物質標記)。擴增后的PCR 產物用四堿基限制性內切酶進行消化, 熒光標記末端片段可被測序儀識別, 得到不同的末端片段峰, 每一個峰就可至少代表一種類型的微生物, 通常用系統分類操作單元(OTU)來表示。故根據片段峰的大小和數量可以檢測和分析空氣樣品中微生物的末端限制性片段圖譜,進而可分析出微生物群體的組成和動態變化等生態信息[76-77]。Lee等利用T-RFLP技術研究了韓國首爾市細菌和真菌的群落結構,并發現其細菌和真菌包括致病菌和過敏原多樣性豐富,且不同季節空氣細菌和真菌群落結構的多樣性和豐富度變化顯著[78];Woo等利用T-RFLP技術研究了香港空氣微生物群落及與微生物相關過敏原的時間變化特征[79]。Maron等通過基因片段之間的PCR擴增獲得長度多態性,其在空氣微生物群落研究中起著非常重要的作用[80]。
2.2核酸雜交技術
目前應用最廣泛的是近年來發展起來的熒光原位雜交技術(Fluorescence in situ hybridization, FISH),其結合了分子生物學的精確性和顯微鏡的可視性信息,可以在自然或人工的微生境中監測和鑒定不同的微生物個體,同時對微生物群落進行評價[81-82]。FISH的應用原理是,微生物細胞脫水后,根據DNA堿基配對原則,在不改變其結構和分布格局的情況下與滲透到細胞結構內具有熒光標記的寡核苷酸探針在一定溫度下進行定位雜交,只有與探針堿基對完全互補的RNA序列才能與探針發生雜交,經熒光素(FITC)標記的特異性抗體在熒光顯微鏡下,可清晰地描繪出與DNA靶結合部位,從而使該菌體在熒光顯微鏡下發出熒光。Lange等運用了FISH技術對暴露在空氣中的細菌進行評估,定量識別出生物氣溶膠中的綠膿桿菌和大腸桿菌,為生物氣溶膠的評估提供了有效的手段[83];Hung等運用核酸雜交技術分析了從空氣樣品中分離的72個目標菌株和66個非目標參照菌株,其靈敏度和特異度都達到100%[84];Kristiansen等應用熒光標記一般細菌探針和處于分娩期豬圈內氣溶膠細胞進行原位雜交,發現厚壁菌門和鏈球菌為主要的細菌屬種,還發現了多樣性豐富的真菌群落[85]。FISH技術已被用來研究空氣細菌的多樣性信息,為空氣微生物種類及其分布特征的研究提供了全新的方法。
2.3實時熒光定量PCR(RT-PCR)
RT-PCR技術作為一種核酸定量的手段,能夠準確量化環境中微生物群落的組成[86],確定群落的優勢類群或具有某種生物學功能的微生物類群的豐度[87],能夠檢測低濃度空氣細菌濃度,其在空氣微生物學研究方面具有非常重要的作用。Lee等利用熒光標記的特異性引物對空氣中細菌和真菌進行PCR擴增,確定了空氣中總懸浮顆粒物中的細菌和真菌的濃度[78];Makino等把炭疽直接加入到空氣微生物采樣液中,然后用RT-PCR進行了定量分析,結果發現1個炭疽細胞在1 h內就可檢出[88];Yamamoto等優化RT-PCR反應條件來定量收集在凝膠過濾器上的空氣真菌濃度[89];Rinsoz等對家禽廠和污水處理廠空氣中全部數量細菌進行評估,通過將RT-PCR與熒光顯微技術及培養方法相比較,證明RT-PCR技術是一種可行有效,精確且簡單的方法,能夠在復雜多變的環境中評估空氣細菌負荷[90-91]。隨著RT-PCR技術不斷發展和其使用成本的逐漸下降,其在空氣微生物學研究中應能得到更廣泛的應用。
2.4空氣微生物宏基因組學
環境基因組學通過直接從環境樣品中提取全部微生物的DNA,構建宏基因組文庫,利用基因組學信息研究環境樣品所包含的全部微生物的遺傳組成及其群落結構,避免了傳統微生物學基于純培養研究的限制,為充分認識和開發利用不可培養微生物,并從完整的群落水平上認識微生物的活性提供了可能[92-93]。Tringe等對城市室內環境的空氣樣本進行宏基因組研究,發現空氣中隱藏著一個獨特的社區,可能源于多種生態位,并通過空氣環境中的選擇性壓力發展形成[94];Cao等在霧霾天氣利用宏基因組學研究了北京建筑物頂樓頂的空氣樣品,發現大部分的可吸入性空氣微生物宏基因組和土壤宏基因組密切相關,且幾種與呼吸道疾病相關的致病菌豐富度隨著懸浮性顆粒污染物的濃度增加而增加[95];Oh等運用宏基因組學研究發現漢城的春季空氣真菌具有較高多樣性,且含有高濃度的真菌過敏原[96];Whon等運用宏基因組學第一次報道了空氣中病毒的季節性和其遺傳多樣性,從而提高在溫帶地區對病毒生態學的理解[97]。由于空氣中微生物的極低的濃度,對16S或18S核糖體基因組的直接分析無法實現,可通過改進采樣和擴增的方法來獲得足夠的DNA,能夠運用宏基因組學來分析,從這些樣品中產生的宏基因組數據的分析揭示空氣微生物群落中的多樣性和不同豐度的種屬,還可以對細菌的可能來源進行識別[98]。
2.5基因芯片技術
基因芯片又稱DNA微陣列,芯片上固定的探針有DNA片段、寡核苷酸、cDNA或來自基因組的基因片段,它們固化于芯片上形成基因探針陣列。經過標記的核苷酸序列與基因芯片特定位點上的探針進行雜交, 然后通過檢測雜交信號定性和定量地判斷樣品中的靶序列分子[99]。目前基因芯片技術已應用于糞便、臨床、環境和食品樣本等的微生物群落結構研究,主要包括功能基因、特定細菌和病毒的檢測及其菌群分析等[100]。近年來,基因芯片技術在空氣微生物的研究中得到充分發展,它不僅可以分析和鑒別空氣中微生物群落的微生物分布、種類及功能,還能分析空氣中環境因素改變對其微生物生態的影響。Hung等使用微陣列技術同時對空氣中幾種過敏原進行檢測和定量測定,鑒定出21個空氣真菌物種,且這些真菌都能夠導致人們過敏[84];Brodie等使用高密度DNA微陣列監測了美國兩個城市的細菌種群,發現這些城市氣溶膠中包含至少有1800不同的細菌種類,可能比某些土壤細菌群落更豐富[101]。隨著我國空氣污染的不斷加劇,空氣中的過敏原的種類和數量也在發生較大的變化,隨著基因芯片技術不斷發展,可以同步定量多個過敏原,可為空氣質量的控制做出較大貢獻[102]。
3 空氣微生物學研究的挑戰和趨勢
(1)不斷擴大研究范圍以獲取更加全面系統的空氣微生物研究第一手資料。我國空氣中微生物的研究主要集中在城市空氣微生物多樣性特征的研究,然而從生態學角度對自然風景區和風景旅游區等生態系統以及從公共衛生學角度對地鐵和超市等室內公共場所空氣微生物的研究報道較少。因此,有必要研究與人類活動密切相關的各類環境空氣微生物群落及多樣性特征。
(2)不斷完善空氣微生物多樣性的解析技術和方法以獲取更多的微生物信息。我國空氣微生物學的研究起步較晚,分子生物學技術在空氣微生物研究中應用較少。因此,應該利用傳統的微生物學與現代分子生物學相結合的方法對不同環境空氣微生物多樣性信息進行深入的研究。
(3)不斷優化空氣微生物取樣技術和研發新型高流量取樣器以保證有足夠DNA樣本進行分子生物學研究。空氣中微生物的種類較少濃度較低,空氣微生物基因組DNA的提取比其它樣品更加困難。因此,有必要研發高流量取樣技術為空氣微生物的分子生物學研究提供樣品保障。
(4)不斷擴大研究尺度以從生物地理學的角度獲取空氣微生物圖譜。目前空氣微生物學的研究尺度較小,取樣覆蓋面較窄。因此,隨著高通量和大數據時代的到來,空氣微生物的研究有必要擴大至區域尺度甚至全國范圍,從生物地理學角度制作全國范圍的空氣微生物圖譜。
(5)不斷研究空氣微生物與環境因素及污染因子之間的關系以獲取空氣微生物污染的形成機制。目前城市空氣微生物污染的形成機制研究較少。因此,有必要系統研究空氣微生物污染與環境因素及污染因子之間的關系,掌握城市空氣微生物污染的形成機制,為城市空氣中生物性污染的治理提供理論依據。
(6)不斷統一空氣微生物研究體系完善其綜合評價系統以能夠對不同環境條件下空氣微生物研究指標進行綜合評價。采樣條件和采樣基質對空氣微生物檢測有重要的影響,需對空氣微生物研究的培養基和取樣方法制定統一標準,同時加強空氣微生物污染與人體健康之間的關系研究,且對空氣微生物作為人體健康狀況的指標進行綜合評價。
[1]Alan M Jones, Roy M Harrison. The effects of meteorological factors on atmospheric bioaerosol concentrations-a review. Science of the Total Environment, 2004, 326(1/3): 151-180.
[2]Li C S, Hsu L Y. Airborne fungus allergen in association with residential characteristics in atopic and control children in a subtropical region. Archives of Environmental Health: An International Journal, 1997, 52(1): 72-79.
[3]Kalogerakis N, Paschali D, Lekaditis V, Pantidou A, Eleftheriadis K, Lazaridis M. Indoor air quality: bioaerosol measurements in domestic and office premises. Journal of Aerosol Science, 2005, 36(5/6): 751-761.
[4]Brent C Christner, Cindy E Morris, Christine M Foreman, Cai R M, David C Sands. Ubiquity of biological ice nucleators in snowfall. Science, 2008, 319(5867): 1214-1214.
[5]Brent C Christner, Cai R M, Cindy E Morris, Kevin S McCarter, Christine M Foreman, Mark L Skidmore, Scott N Montross, David C Sandsg. Geographic, seasonal, and precipitation chemistry influence on the abundance and activity of biological ice nucleators in rain and snow. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(48): 18854-18859.
[6]Amann RI, Ludwig W, Schleifer KH. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiological Reviews, 1995, 59(1): 143-169.
[7]Fang Z G, Ouyang Z Y, Hu L F, Wang X K, Zheng H, Lin X Q. Culturable airborne fungi in outdoor environments in Beijing, China. Science of the Total Environment, 2005, 350: 47-58.
[8]Fang Z G, Ouyang Z Y, Zheng H, Wang X K, Hu L F. Culturable airborne bacteria in outdoor environments in Beijing, China. Microbial Ecology, 2007, 54(3): 487-496.
[9]鄭華, 歐陽志云, 方治國, 趙同謙. BIOLOG在土壤微生物群落功能多樣性研究中的應用. 土壤學報, 2004, 41(3): 456-461.
[10]Juliet Preston-Mafham, Lynne Boddy, Peter F Randerson. Analysis of microbial community functional diversity using sole-carbon-source utilisation profiles-a critique. FEMS Microbiology Ecology, 2002, 42(1): 1-14.
[11]車玉伶, 王慧, 胡洪營, 梁威, 郭玉鳳. 微生物群落結構和多樣性解析技術研究進展. 生態環境, 2005, 14(1): 127-133.
[12]Hill G T, Mitkowski N A, Aldrich-Wolfe L, Emele L R, Jurkonie D D, Ficke A, Maldonado-Ramirez S, Lynch S T, Nelson E B. Methods for assessing the composition and diversity of soil microbial communities. Applied Soil Ecology, 2000, 15(1): 25-36.
[13]Fabian M P, Reponen T, Miller S L, Hernandez M T. Total and culturable airborne bacteria and fungi in Arid region flood-damaged residences. Journal of Aerosol Science, 2000, 31: 35-36.
[14]Julianne Lindemann, Helen A Constantinidou, William R Barchet, Christen D Upper. Plants as sources of airborne bacteria, including ice nucleation-active bacteria. Applied and Environmental Microbiology, 1982, 44(5): 1059-1063.
[15]Lindermann J, Upper C D. Aerial dispersal of epiphytic bacteria over bean plants. Applied and Environmental Microbiology, 1985, 50(5): 1229-1232.
[16]Bruce Lighthart. Survival of airborne bacteria in a high urban concentration of carbon monoxide. Applied and Environmental Microbiology, 1973, 25(1): 86-91.
[17]Bruce Lighthart. Microbial aerosols: estimated contribution of combine harvesting to an airshed. Applied and Environmental Microbiology, 1984, 47(2): 430-432.
[18]Lightart B, Kin J. Simulation of airborne microbial droplet transport. Applied and Environmental Microbiology, 1989, 55(9): 2349-2355.
[19]Bruce Lighthart, Brenda T Shaffer, Balkumar Marthi, Lisa M Ganio. Artificial wind-gust liberation of microbial bioaerosol previously deposited on plants. Aerobiologia, 1993, 9(2/3): 189-196.
[20]Lighthart B, Shaffer B T. Bacterial flux from chaparral into the atmosphere in mid-summer at a high desert location. Atmospheric Environment, 1994, 28(7): 1267-1274.
[21]Lightart B, Shaffer B T. Airborne bacteria in the atmospheric surface layer: Temporal distribution above a grass seed field. Applied and Environmental Microbiology, 1995, 61(4): 1492-1496.
[22]Bruce Lighthart, Brenda T Shaffer. Viable bacterial aerosol particle size distributions in the midsummer atmosphere at an isolated location in the high desert chaparral. Aerobiologia, 1995, 11(1): 19-25.
[23]Shaffer B T, Lighthart B. Survey of culturable airborne bacteria at four diverse locations in Oregon: urban, rural, forest, and coastal. Microbial Ecology, 1997, 34(3): 167-177.
[24]Brian G Shelton, Kimberly H Kirkland, W Dana Flanders, George K Morris. Profiles of airborne fungi in buildings and outdoor environments in the United States. Applied and Environmental Microbiology, 2002, 68(4): 1743-1753.
[25]Hu Q X, Cai Z L, Lu Z X. Preliminary approach on the status of indoor and outdoor airborne fungi particles. Shanghai Environmental Sciences, 1999, 18(10): 454-456.
[26]胡慶軒, 車鳳翔, 徐秀芝, 姜黎, 鹿建春, 劉敏霞. 微孔濾膜空氣微生物采樣器的研制. 衛生研究, 1999, 28 (4): 255-256.
[27]Fang Z G, Ouyang Z Y, Zheng H, Wang X K. Concentration and size distribution of culturable airborne microorganisms in outdoor environments in Beijing, China. Aerosol Science and Technology, 2008, 42(5): 325-334.
[28]凌琪, 王晏平, 王莉, 舒瑩, 陶勇, 鮑立寧. 合肥城區空氣真菌濃度的時空分布特征. 生物多樣性, 2008, 16(2): 175-180.
[29]凌琪, 王晏平, 陶勇, 王莉, 舒瑩. 合肥市2004~2006 年空氣細菌污染狀況調查. 中國公共衛生管理, 2007, 23(1): 67-69.
[30]Fang Z G, Gong C J, Ouyang Z Y, Liu P, Sun L, Wang X Y. Characteristic and concentration distribution of culturable airborne bacteria in residential environments in Beijing, China. Aerosol and Air Quality Research, 2014, 14(3): 943-953.
[31]方治國, 歐陽志云, 劉芃, 孫力, 王小勇. 城市居家環境空氣真菌群落結構特征研究. 環境科學, 2013, 34(5): 2031-2037.
[32]方治國, 孫平, 歐陽志云, 劉芃, 孫力, 王小勇. 北京市居家空氣微生物粒徑及分布特征研究. 環境科學, 2013, 34(7): 2526-2532.
[33]方治國, 歐陽志云, 劉芃, 孫力, 王小勇. 北京市居家空氣微生物污染特征. 環境科學學報, 2013, 33(4): 1166-1172.
[34]Jay L Garland, Aaron L Mills. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization. Applied and Environmental Microbiology, 1991, 57(8): 2351-2359.
[35]Krista L De Fede, Daniel G Panaccione, Alan J Sexstone. Characterization of dilution enrichment cultures obtained from size-fractionated soil bacteria by BIOLOG?community-level physiological profiles and restriction analysis of 16s rRNA genes Soil Biology and Biochemistry, 2001, 33(11): 1555-1562.
[36]Krista L De Fede, Alan J Sexstone. Differential response of size-fractionated soil-fractionated soil bacteria in BIOLOG?microtitre plates. Soil Biology and Biochemistry, 2001, 33(11): 1547-1554.
[37]Kaiser S K, Guckert J B, Gledhill D W. Comparison of activated sludge microbial communities using biologTMmicroplates. Water Science and Technology, 1998, 37(4/5): 57-63.
[38]Haack S K, Garchow H, Klug M J, Forney L J. Analysis of factors affecting the accuracy, reproducibility, and interpretation of microbial community carbon source utilization patterns. Applied and Environmental Microbiology, 1995, 61(4): 1458-1468.
[39]Christine A Hackett, Bryan S Griffiths. Statistical analysis of the time-course of biolog substrate utilization. Journal of Microbiological Methods, 1997, 30(1): 63-69.
[40]凌琪, 包金梅, 李瑞, 陶勇, 鮑立寧, 毛欽焱. Biolog-Eco解析黃山風景區空氣微生物碳代謝多樣性特征. 應用基礎與工程科學學報, 2012, 20(1): 56-63.
[41]龔嬋娟, 許晶, 方治國, 樓秀芹, 歐陽志云. 杭州市空氣微生物群落碳代謝特征研究. 環境科學, 2014, 35(2): 753-758.
[42]段魏魏, 婁愷, 曾軍, 胡蓉, 史應武, 何清, 劉新春, 孫建, 晁群芳. 塔克拉瑪干沙塵暴源區空氣微生物群落的代謝特征. 環境科學, 2012, 33(1): 26-31.
[43]Aleksandra Sebastian, Lennart Larsson. Characterization of the microbial community in indoor environments: a chemical-analytical approach. Applied and Environmental Microbiology, 2003, 69(6): 3103-3109.
[44]Alex K Y Lee, Chak K Chan, Fang M, Arthur P S Lau. The 3-hydroxy fatty acids as biomarkers for quantification and characterization of endotoxins and Gram-negative bacteria in atmospheric aerosols in Hong Kong. Atmospheric Environment, 2004, 38(37): 6307-6317.
[45]Arthur P S Laua, Alex K Y Lee, Chak K Chan, Fang M. Ergosterol as a biomarker for the quantification of the fungal biomass in atmospheric aerosols. Atmospheric Environment, 2006, 40(2): 249-259.
[46]Alex K Y Lee, Arthur P S Lau, Jessica Y W Cheng, Fang M, Chak K Chan. Source identification analysis for the airborne bacteria and fungi using a biomarker approach. Atmospheric Environment, 2007, 41(13): 2831-2843.
[47]Jessica Y W Cheng, Arhur P S Lau, Fang M. Assessment of the atmospheric fungal prevalence through field ergosterol measurement I—Determination of the specific ergosterol content in common ambient fungal spores and yeast cells. Atmospheric Environment, 2008, 42(22): 5526-5533.
[48]Jessica Y W Cheng, Arthur P S Lau, Fang M. Assessment of the atmospheric fungal prevalence through field ergosterol measurement II: Establishing the conversion factor. Atmospheric Environment, 2008, 42(22): 5534-5541.
[49]Heidi Bauer, Magda Claeys, Reinhilde Vermeylen, Elisabeth Schueller, Gert Weinke, Anna Berger, Hans Puxbaum. Arabitol and mannitol as tracers for the quantification of airborne fungal spores. Atmospheric Environment, 2008, 42(3): 588-593.
[50]Jill A Poole, Gregory P Dooley, Rena Saito, Angela M Burrell, Kristina L Bailey, Debra J Romberger, John Mehaffy, Stephen J Reynolds. Muramicacid, endotoxin, 3-hydroxy fatty acids, and ergosterol content explain monocyte and epithelial cell inflammatory responses to agricultural dusts. Journal of Toxicology and Environment Health, 2010, 73(10): 684-700.
[51]Patrizia Di Filippo, Donatella Pomata, Carmela Riccardi, Francesca Buiarelli, Cinzia Perrino. Fungal contribution to size-segregated aerosol measured through biomarkers. Atmospheric Environment, 2013, 64: 132-140.
[52]Ramon Rosselló-Mora, Rudolf Amann. The species concept for prokaryotes. FEMS Microbiology Reviews, 2001, 25(1): 39-67.
[53]Jordan Peccia, Mark Hernandez. Incorporating polymerase chain reaction-based identification, population characterization, and quantification of microorganisms into aerosol science: a review. Atmospheric Environment, 2006, 40(21): 3941-3961.
[54]Ferris M J, Muyzer G, Ward D M. Denaturing gradient gel electrophoresis profiles of 16S rRNA-defined populations inhabiting a hot spring microbial mat community. Applied and Environmental Microbiology, 1996, 62(2): 340-346.
[55]Fromin N, Hamelin J, Tarnawski S, Roesti D, Jourdain-Miserez K, Forestier N, Teyssier-Cuvelle S, Gillet F, Aragno M, Rossi P. Statistical analysis of denaturing gel electrophoresis (DGE) fingerprinting patterns. Environmental Microbiology, 2002, 4(11): 634-643.
[56]王洪媛, 管華詩, 江曉路. 微生物生態學中分子生物學方法及T-RFLP技術研究. 中國生物工程雜志, 2004, 24(8): 42-47.
[57]胡穩奇, 張志光. 核酸雜交技術在環境微生物檢測中的應用. 微生物學通報, 1995, 22(6): 371-374.
[58]Hey Reoun An, Gediminas Mainelis, Lori White. Development and calibration of real-time PCR for quantification of airborne microorganisms in air samples. Atmospheric Environment, 2006, 40(40): 7924-7939.
[59]王曙光, 林先貴, 刁曉君. 環境微生物研究方法與應用. 北京: 化學工業出版社, 2008: 77-80.
[60]Qin J J, Li Y R, Cai Z M, Li S H, Zhu J F, Zhang F, Liang S S, Zhang W W, Guan Y L, Shen D Q, Peng Y Q, Zhang D Y, Jie Z Y, Wu W X, Qin Y W, Xue W B, Li J H, Han L C, Lu D H, Wu P X, Dai Y L, Sun X J, Li Z S, Tang A F, Zhong S L, Li X P, Chen W N, Xu R, Wang M B, Feng Q, Gong M H, Yu J, Zhang Y Y, Zhang M, Torben Hansen, Gaston Sanchez, Jeroen Raes, Gwen Falony, Shujiro Okuda, Mathieu Almeida, Emmanuelle LeChatelier, Pierre Renault, Nicolas Pons, Jean-Michel M Batto, Zhang Z X, Chen H, Yang R F, Zheng W M, Li S G, Yang H M, Wang J, S Dusko Ehrlich, Rasmus Nielsen, Oluf Pedersen, Karsten Kristiansen, Wang J. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 2012, 490(7418): 55-60.
[61]Willy Valdivia-Granda. The next meta-challenge for Bioinformatics. Bioinformation, 2008, 2(8): 358-362.
[62]Shalon D, Smith S J, Brown P O. A DNA microarray system for analyzing complex DNA samples using two-color fluorescent probe hybridization. Genome Research, 1996, 6(4): 639-645.
[63]Zhou J Z, Dorothea K Thompson. Challenges in applying microarrays to environmental studies. Current Opinion in Biotechnology, 2002, 13(3): 204-207.
[64]Fischer S G, Lerman L S. DNA fragments differing by single base-pair substitutions are separated in denaturing gradient gels: correspondence with melting theory. Proceedings of the National Academy of Sciences of the United States of America, 1983, 80(6): 1579-1583.
[65]Muyzer G, de Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Applied and Environmental Microbiology, 1993, 59(3): 695-700.
[66]Gerard Muyzer. DGGE/TGGE a method for identifying genes from natural ecosystems. Current Opinion in Microbiology, 1999, 2(3): 317-322.
[67]Smalla K, Wieland G, Buchner A, Zock A, Parzy J, Kaiser S, Roskot N, Heuer H, Berg G. Bulk and rhizosphere soil bacterial communities studied by denaturing gradient gel electrophoresis: plant-dependent enrichment and seasonal shifts revealed. Applied and Environmental Microbiology, 2001, 67(10): 4742-4751.
[68]Wen-Tso Liua, On-Chim Chan, Herbert H P Fang. Microbial community dynamics during start-up of acidogenic anaerobic reactors. Water Research, 2002, 36(13): 3203-3210.
[69]Andreas Teske, Wawer C, Muyzer G, Ramsing N B. Distribution of sulfate-reducing bacteria in a stratified fjord (Mariager Fjord, Denmark) as evaluated by most-probable-number counts and denaturing gradient gel electrophoresis of PCR-amplified ribosomal DNA fragment. Applied and Environmental Microbiology, 1996, 62(4): 1405-1415.
[70]Benjamin Nehme, Valérie Létourneau, Robert J Forster, Marc Veillette, Caroline Duchaine. Culture-independent approach of the bacterial bioaerosol diversity in the standard swine confinement buildings, and assessment of the seasonal effect. Environmental Microbiology, 2008, 10(3): 665-675.
[71]Benjamin Nehmé, Yan Gilbert, Valérie Létourneau, Robert J Forster, Marc Veillette, Richard Villemur, Caroline Duchaine. Culture-independent characterization of archaeal biodiversity in swine confinement building bioaerosols. Applied and Environmental Microbiology, 2009, 75(17): 5445-5450.
[72]Li K J. Molecular comparison of the sampling efficiency of four types of airborne bacterial samplers. Science of the Total Environment, 2011, 409(24): 5439-5498.
[73]Anna Hervàs, Lluís Camarero, Isabel Reche, Emilio O Casamayor. Viability and potential for immigration of airborne bacteria from Africa that reach high mountain lakes in Europe. Environmental Microbiology, 2009, 11(6): 1612-1623.
[74]Pascale Blais Lecours, Marc Veillette, David Marsolais, Caroline Duchaine. Characterization of bioaerosols from dairy barns: reconstructing the puzzle of occupational respiratory diseases by using molecular approaches. Applied and Environmental Microbiology, 2012, 78(9): 3242-3248.
[75]Liu W T, Marsh T L, Cheng H, Forney L J. Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA. Applied and Environment Microbiology, 1997, 63(11): 4516-4522.
[76]Terence L Marsh. Terminal restriction fragment length polymorphism (T-RFLP): An emerging method for characterizing diversity among homologous populations of amplification products. Current Opinion in Microbiology, 1999, 2(3): 323-327.
[77]Christopher L Kitts. Terminal restriction fragment patterns: a tool for comparing microbial communities and assessing community dynamics. Current Issues in Intestinal Microbiology, 2001, 2(1): 17-25.
[78]Seung-Hoon Lee, Hyo-Jeong Lee, Se-Jin Kim, Hyung Min Lee, Hojeong Kang, Yong Pyo Kim. Identification of airborne bacterial and fungal community structures in an urban area by T-RFLP analysis and quantitative real-time PCR. Science of the Total Environment, 2010, 408(6): 1349-1357.
[79]Anthony C Woo, Manreetpal S Brar, Yuki Chan, Maggie C Y Lau, Frederick C C Leung, James A Scott, Lilian L P Vrijmoed, Peyman Zawar-Reza, Stephen B Pointing. Temporal variation in airborne microbial populations and microbially-derived allergens in a tropical urban landscape. Atmospheric Environment, 2013, 74: 291-300.
[80]Pierre-Alain Maron, David P H Lejon, Esmeralda Carvalho, Karine Bizet, Philippe Lemanceau, Lionel Ranjard, Christophe Mougela. Assessing genetic structure and diversity of airborne bacterial communities by DNA fingerprinting and 16S rDNA clone library. Atmospheric Environment, 2005, 39(20): 3687-3695.
[81]Ewa Korzeniewska, Monika Harnisz. Culture-dependent and culture-independent methods in evaluation of emission ofEnterobacteriaceaefrom sewage to the air and surface water. Water, Air, & Soil Pollution, 2012, 223(7): 4039-4046.
[82]Weerasekara M L M A W, Noriko Ryuda, Hiroshi Miyamoto, Toru Okumura, Daisuke Ueno, Koichi Inoue, Takashi Someya. Double-color fluorescenceinsituhybridization (FISH) for the detection ofBacillusanthracisspores in environmental samples with a novel permeabilization protocol. Journal of Microbiological Methods, 2013, 93(3): 177-184.
[83]Lange J L, Thorne P S, Lynch N. Application of flow cytometry and fluorescent in situ hybridization for assessment of exposures to airborne bacteria. Applied and Environmental Microbiology, 1997, 63(4): 1557-1563.
[84]Hung W T. Su S L, Shiu L Y, Chang T C. Rapid identification of allergenic and pathogenic molds in environmental air by an oligonucleotide array. BMC Infectious Diseases, 2011, 11(1): 91-91.
[85]Anja Kristiansen, Aaron M Saunders, Aviaja A Hansen, Per H Nielsen, Jeppe L Nielsen. Community structure of bacteria and fungi in aerosols of a pig confinement building. FEMS Microbiology Ecology, 2012, 80(2): 390-401.
[86]Yongju Heo, Jiyeon Park, Sung-il Lim, Hor-gil Hur, Daesung Kim, Kihong Park. Size-resolved culturable airborne bacteria sampled in rice field, sanitary landfill, and waste incineration sites. Journal of Environmental Monitoring, 2010, 12(8): 1619-1624.
[87]Yuan W, Chai T J, Miao Z M. ERIC-PCR identification of the spread of airborneEscherichiacoliin pig houses. Science of the Total Environment, 2010, 408(6): 1446-1450.
[88]Sou-ichi Makino, Hyeng-il Cheun. Application of the real-time PCR for the detection of airborne microbial pathogens in reference to the anthrax spores. Journal of Microbiological Methods, 2003, 53(2): 141-147.
[89]Naomichi Yamamoto, Minoru Kimura, Hideaki Matsuki, Yukio Yanagisawa. Optimization of a real-time PCR assay to quantitate airborne fungi collected on a gelatin filter. Journal of Bioscience and Bioengineering, 2010, 109(1): 83-88.
[90]Thomas Rinsoz, Philippe Duquenne, Guylaine Greff-Mirguet, Anne Oppligera. Application of real-time PCR for total airborne bacterial assessment: comparison with epifluorescence microscopy and culture-dependent methods. Atmospheric Environment, 2008, 42(28): 6767-6774.
[91]Alvarez A J, Buttner M P, Stetzenbach L D. PCR for bioaerosol monitoring: sensitivity and environmental interference. Applied and Environmental Microbiology, 1995, 61(10): 3639-3644.
[92]沈菊培, 張麗梅, 鄭袁明, 朱永官, 賀紀正. 土壤宏基因組學技術及其應用. 應用生態學報, 2007, 18(1): 212-218.
[93]賀紀正, 張麗梅, 沈菊培, 朱永官. 宏基因組學(Metagenomics)的研究現狀和發展趨勢. 環境科學學報, 2008, 28(2): 209-218.
[94]Susannah G Tringe, Zhang T, Liu X G, Yu Y T, Wah Heng Lee, Jennifer Yap, Yao F, Sim Tiow Suan, Seah Keng Ing, Matthew Haynes, Forest Rohwer, Chia Lin Wei, Patrick Tan, James Bristow, Edward M Rubin, Ruan Y J. The Airborne Metagenome in an Indoor Urban Environment. PLoS One, 2008, 3(4): e1862.
[95]Chen C, Jiang W J, Wang B Y, Fang J H, Lang J D, Tian G, Jiang J K, Zhu T F. Inhalable Microorganisms in Beijing′s PM2. 5and PM10Pollutants during a Severe Smog Event. Environmental Science and Technology, 2014, 48(3): 1499-1507.
[96]Seung-Yoon Oh, Jonathan J Fong, Myung Soo Park, Limseok Chang, Young Woon Lim. Identifying airborne fungi in Seoul, Korea using metagenomics. Journal of Microbiology, 2014, 52(6): 465-472.
[97]Tae Woong Whon, Min-Soo Kim, Seong Woon Roh, Na-Ri Shin, Hae-Won Lee, Jin-Woo Bae. Metagenomic characterization of airborne viral DNA diversity in the near-surface atmosphere. Journal of Virology, 2012, 86(15): 8221-8231.
[98]Shibu Yooseph, Cynthia Andrews-Pfannkoch, Aaron Tenney, Jeff McQuaid, Shannon Williamson, Mathangi Thiagarajan, Daniel Brami, Lisa Zeigler Allen, Jeff Hoffman, Johannes B Goll, Douglas Fadrosh, John Glass, Mark D Adams, Robert Friedman, J C Venter. A metagenomic framework for the study of airborne microbial communities. PLoS One, 2013, 8(12): e81862.
[99]Rick W Ye, Wang T, Laura Bedzyk, Kevin M Croker. Applications of DNA microarrays in microbial systems. Journal of Microbiological Methods, 2001, 47(3): 257-272.
[100]Wu Z H, Yoshihiko Tsumura, G?ran Blomquist, Wang X R. 18S rRNA gene variation among common airborne fungi, and development of specific oligonucleotide probes for the detection of fungal isolates. Applied and Environmental Microbiology, 2003, 69(9): 5389-5397.
[101]Eoin L Brodie, Todd Z DeSantis, Jordan P Moberg Parker, Ingrid X Zubietta, Yvette M Piceno, Gary L Andersen. Urban aerosols harbor diverse and dynamic bacterial populations. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(1): 299-304.
[102]Concepción De Linares, Idoia Postigo, Jordina Belmonte, Miguel Canela, Jorge Martínez. Optimization of the measurement of outdoor airborne allergens using a protein microarrays platform. Aerobiologia, 2014, 30(3): 217-227.
Culture-dependent and culture-independent approaches for studying airborne microbial diversity
FANG Zhiguo1,*, HAO Cuimei1, YAO Wenchong1, OUYANG Zhiyun2
1SchoolofEnvironmentalScienceandEngineering,ZhejiangGongshangUniversity,Hangzhou310018,China2StateKeyLaboratoryofUrbanandRegionalEcology,ResearchCenterforEco-EnvironmentalSciences,Chinese,Beijing100085,China
With the occurrence of epidemics worldwide and serious haze events in China, studies on airborne biological pollution have attracted considerable attention. The research approach for airborne microorganisms is constantly updated because of the rapid development of molecular biology techniques, and researchers are switching from biochemistry-based technologies to modern molecular biology-based technologies. In this paper, we reviewed the development processes of airborne microbial communities and analyzed their diversity on the basis of culture-dependent and culture-independent approaches, which mainly include culture-dependent technology, BIOLOG technology, biomarkers, gene fingerprinting techniques, nucleic acid hybridization, real-time quantitative polymerase chain reaction, metagenomics of airborne microorganisms, and gene chip technology. In addition, the basic principles of these technologies have been presented in detail in this paper, and the advantages and disadvantages of various technologies have been compared to highlight their applications in the study of airborne microbial communities and their diversity. Finally, the prospects of airborne microbiology have been emphasized.
airborne microbial diversity; biochemical technology; molecular biology techniques; metagenomics
城市與區域生態國家重點實驗室開放基金項目(SKLURE2015-2-1);國家自然科學青年基金資助項目(41005085)
2014-11-27; 網絡出版日期:2015-10-30
Corresponding author.E-mail: zhgfang77@zjgsu.edu.cn
10.5846/stxb201411272355
方治國,郝翠梅,姚文沖,歐陽志云.空氣微生物群落解析方法:從培養到非培養.生態學報,2016,36(14):4244-4253.
Fang Z G, Hao C M, Yao W C, Ouyang Z Y.Culture-dependent and culture-independent approaches for studying airborne microbial diversity.Acta Ecologica Sinica,2016,36(14):4244-4253.

