高效液相色譜測定櫻桃酚類物質
姜 楠,王 蒙,韋迪哲,馮曉元
(北京農業質量標準與檢測技術研究中心、農業部農產品質量安全風險評估實驗室(北京)、農產品產地環境監測北京市重點實驗室,北京 100097)
?
高效液相色譜測定櫻桃酚類物質
姜楠,王蒙,韋迪哲,馮曉元*
(北京農業質量標準與檢測技術研究中心、農業部農產品質量安全風險評估實驗室(北京)、農產品產地環境監測北京市重點實驗室,北京 100097)
本文建立了櫻桃多酚物質的高效液相色譜分析方法。將固相萃取技術用于櫻桃多酚物質提取過程,優化了前處理提取條件、Waters Oasis HLB固相萃取柱萃取條件以及色譜條件,在此基礎上使用高效液相色譜測定了櫻桃酚類物質成分及含量。最終確定櫻桃多酚提取溶劑為60%甲醇-2%甲酸;HLB固相萃取小柱的淋洗液為10%甲醇-0.1%甲酸、洗脫液為乙腈-5%甲酸,此條件下多酚回收率在70%以上;確定在40℃柱溫、2%甲酸水溶液和乙腈為流動相的條件下進行梯度洗脫,結果表明櫻桃中含有香草酸、兒茶素、咖啡酸、蘆丁、對香豆酸等多種多酚成分,含量在0.37~240.62(mg/kg DW)之間。該方法快速、靈敏、雜質干擾少,櫻桃多酚類物質峰分離度較好。
高效液相色譜,固相萃取,多酚,櫻桃
櫻桃為多年生木本落葉果樹,屬薔薇科(Rosaceae),李屬(Prunus),櫻亞屬(Subgenus cerasus)。櫻桃果實色澤鮮艷、香味濃郁、營養豐富,因富含多種有效成分而具有一定的醫療保健價值,其中尤以酚類較為突出。已有研究表明櫻桃包含多種酚類成分,包括黃酮類(兒茶素、表兒茶素、花青素、原花青素等)和酚酸類(肉桂酸、綠原酸、咖啡酸等)[1]。多酚物質是具有苯環并結合多個羥基化學結構的物質總稱,一般作為植物的次生代謝產物,對植物的生長發育和調節、基因的誘導表達、信號傳導等都有一定的影響[2-3]。且多酚成分不僅顯著影響果實的抗氧化作用[4-5],還具有降低癌癥風險[6]以及抵抗神經性疾病[7]等多種功效。
近年來天然來源的多酚類物質常被作為抗氧化劑、抑菌劑、防腐劑,因此不同植物組織中多酚成分的分離鑒定已成為研究熱點。目前國內外多采用分光光度計[8]對櫻桃酚類物質進行分析與檢測,分光光度計主要用于同類結構的總酚測定,不能區分結構類似的單一酚類物質含量。而HPLC不僅具有快速方便、準確度高的優點,而且可以定性定量檢測單一酚類物質,雖然采用HPLC測定櫻桃多酚已有報道[9-10],但并未見對前處理過程、流動相、柱溫等條件進行優化的研究。此外,傳統的液相色譜法中樣品前處理過程費時費力、純化效果不理想,而且處理過程易造成酚類物質損失。固相萃取技術具有萃取速度快、實驗成本低、環境污染小、能有效的將分析物與干擾組分分離等優點,且操作簡單。本文將固相萃取技術與前處理相結合,對櫻桃多酚提取液進行純化,篩選了固相萃取的淋洗和洗脫條件,實現對目標組分與雜質之間的高選擇性分離。在此基礎上,分析了常見的櫻桃品種中的多酚物質的組成及含量,以期為櫻桃多酚的開發利用及櫻桃制品的質量控制提供基礎數據。
1 材料與方法
1.1材料與儀器
拉賓斯(Lapins)、先鋒(Van)、紅燈(Hongdeng)、薩米脫(Summit)鮮櫻桃于市場購買,酸櫻桃采于北京農林科學院果樹研究所。選取大小均勻、成熟度均一、無機械損傷、無病蟲害的果實,切塊去核,隨后真空冷凍干燥48 h,凍干條件為-50℃、30 Pa。櫻桃凍干樣研磨成粉,過40目篩,置于密封袋內,于-20℃保存備用。
14種標準物質:沒食子酸(Gallic acid)、香豆酸(Coumalic acid)、兒茶素(Catechin)、綠原酸(Chlorogenicacid)、咖啡酸(Caffeic acid)、香草酸(Vanillic acid)、表兒茶素(Epicatechin)、丁香酸(Syringic acid)、對香豆酸(p-Coumaric acid)、蘆丁(Rutin)、芥子酸(Sinapic acid)、槲皮素(Quercetin)、肉桂酸(trans-Cinnamic acid)、山奈酚(Kaempherol)北京索萊寶生物科技有限公司,純度>98%。
乙腈、甲醇、乙酸乙酯、甲酸均為色譜純,乙酸、磷酸為分析純。
Waters 2690高效液相色譜儀、Waters 2487紫外檢測器、Waters Symmetry C18column(5 μm,4.6×250 mm)色譜柱Waters公司;3K-15高速冷凍離心機sigma公司;KQ-300VDV超聲清洗器昆山市超聲儀器有限公司;RE-5205旋轉蒸發儀上海亞榮生化儀器廠;FD-1A-50冷凍干燥機北京華圣科儀實驗設備有限公司;CM24氮吹儀北京成萌偉業科技有限公司;TV-1901紫外分光光度計北京普析通用儀器有限公司。
1.2實驗方法
1.2.1櫻桃酚類物質提取以拉賓斯櫻桃品種進行前期檢測方法的開發實驗,之后選用其他櫻桃品種進行實際樣品測定。具體過程如下:取1.0 g拉賓斯櫻桃凍干粉于50 mL離心管,加入體積分數60%甲醇-2%甲酸水溶液20 mL,渦旋,于室溫下超聲提取20 min,隨后低溫離心(10000 r/min,10 min,-10℃),將上清液倒出,重復提取兩次,合并提取液,待測樣品總酚含量。
1.2.1.1不同體積分數的甲醇溶液對多酚含量的影響按照上述提取過程,考察體積分數分別為50%、60%、70%甲醇-2%甲酸水溶液對總酚含量的影響,以純水作為空白對照,其他提取條件不變。
1.2.1.2不同類型酸溶液對多酚含量的影響按照上述提取過程,考察不同類型的酸對總酚含量的影響,提取溶劑為60%甲醇,分別添加2%甲酸、2%乙酸、2%檸檬酸,以60%甲醇作為空白對照,其他提取條件不變。
1.2.2總酚含量測定總酚含量的測定參照Singleton和Rossi的方法并略做改動[11]。準確稱取20 mg沒食子酸標準品,加水溶解并定容至50 mL,得到400 μg/mL的沒食子酸標準溶液。分別精確吸取0、0.25、0.50、0.75、1.00、1.25 mL于10 mL容量瓶中,用蒸餾水稀釋至刻度線,得到溶液濃度分別為 0、10、20、30、40、50 μg/mL。分別吸取上述沒食子酸溶液1.0 mL,加入十倍稀釋的福林酚試劑0.5 mL,搖勻,靜置8 min,加入10%碳酸鈉溶液4 mL,搖勻,再加水至總體積為10 mL,充分混勻后,在室溫下避光靜置40 min,于765 nm處測定樣品吸光度,以沒食子酸標準溶液質量濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線。
1.2.3HPLC分析條件色譜柱:Waters Symmetry C18column(5 μm,4.6 mm×250 mm),流速:0.8 mL/min,柱溫:40℃,二極管陣列檢測器(PDA)檢測波長:280、320 nm,進樣量:10 μL,流動相洗脫條件見表1。

表1 流動相系統配比及梯度洗脫程序
1.2.3.1不同種類酸的選擇在流動相A中分別加入體積分數2%甲酸、1%乙酸、0.5%磷酸,流動相B為乙腈,柱溫為40℃其他條件不變,重復進樣三次,選擇最佳的酸作為流動相A中的添加成分。
1.2.3.2柱溫對酚類分離效果的影響考察不同柱溫對酚類物質分離效果的影響,分別設置柱溫25、30、35、40℃,流動相A為2%甲酸-水,流動相B為乙腈,其他條件不變,重復進樣三次,選擇最佳的洗脫柱溫。
1.2.4HLB小柱萃取方法優化選用Waters Oasis HLB(60 mg,3 mL)小柱對櫻桃提取液進一步純化,去除雜質以便用于下一步酚類樣品組分分析。將櫻桃提取液于40℃條件下旋轉蒸發濃縮至一定體積,定容至20 mL,待上固相萃取小柱。先用3 mL甲醇、3 mL水活化,5 mL樣品過柱,3 mL淋洗液過柱以去除雜質,5 mL洗脫液將目標物洗脫出來,收集洗脫液。固定洗脫液為乙腈-5%甲酸,分別考察淋洗液為水-0.1%甲酸、5%甲醇-0.1%甲酸、10%甲醇-0.1%甲酸對多酚回收率的影響;固定淋洗液為10%甲醇-0.1%甲酸,分別考察洗脫液為甲醇-5%氨水、甲醇-2%甲酸、甲醇-5%甲酸、乙腈-2%甲酸、乙腈-5%甲酸對多酚回收率的影響。將洗脫液于氮吹儀中35℃條件下吹干,而后用體積分數50%甲醇定容,過0.22 μm濾膜,上HPLC測定。
2 結果與分析
2.1前處理對櫻桃總酚含量的影響
多酚的化學性質、存在形式、提取方法以及提取過程中存在的干擾物質等因素都會影響多酚類物質的有效提取。生產中多用于多酚類物質的提取方法是溶劑浸提法,該方法也最為經濟、便捷且易操作,通常采用甲醇、乙醇、丙酮或醇水混合溶劑作為提取劑,常根據溶劑的極性作為選擇依據。在提取過程中,為了防止多酚類物質的損失,常添加酸性溶劑如甲酸、鹽酸等,充入氮氣并與避光條件下提取。本文考察了甲醇濃度和向其添加不同類型的酸對多酚類物質含量的影響,發現甲醇濃度和酸種類可顯著影響總酚含量。
2.1.1甲醇濃度對總酚含量的影響按照1.2.2所述方法繪制總酚含量的標準曲線為Y=0.0082X+0.0415(R2=0.9931)。
一定濃度的甲醇溶劑常被用作多酚類、黃酮類物質的提取,主要是因為水分使植物細胞溶脹,促使提取溶劑有效地詳細胞內滲透,從而增大提取率。圖1所示為溶劑濃度對櫻桃總酚含量的影響,從圖中可以看出與純水相比50%~70%的甲醇均能有效地提取酚類物質,60%的甲醇略高于其他兩個濃度,此時總酚含量為(4.28±0.02)mg/g DW,故選擇60%甲醇作為提取溶劑。

圖1 甲醇濃度對總酚含量的影響Fig.1 Effects of methanol concentration on total phenolic content
2.1.2酸種類對總酚含量的影響在提取過程中加酸可破壞多酚與蛋白質、脂質、多糖之間的氫鍵及疏水作用力,從而使酚類被更多的釋放出來。此外,多酚類物質在酸性環境下較穩定,且酸可在一定程度上沉淀雜質[12],因此本文考察了不同種類的酸對多酚含量的影響,結果如圖2所示。從圖中可以看出,不同酸均在一定程度上增大了總酚含量,其對總酚含量影響順序依次為甲酸>檸檬酸>乙酸。其中,添加甲酸時總酚含量為(4.26±0.03)mg/g,故選擇甲酸來提供酸性環境。
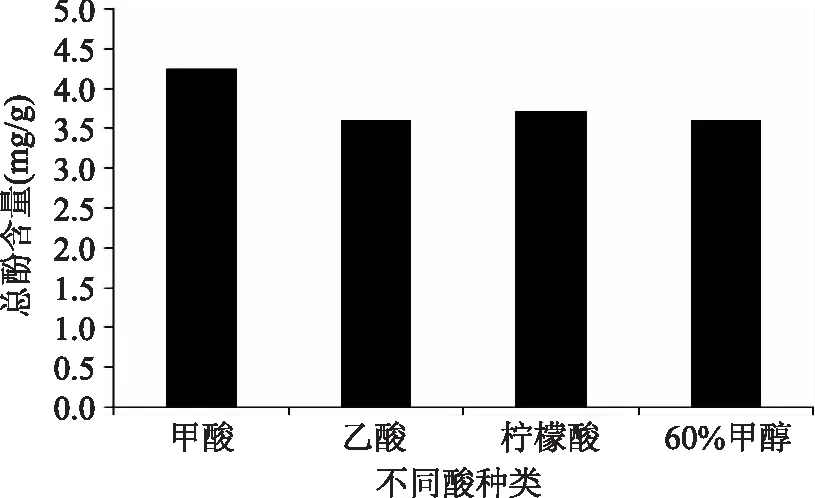
圖2 酸種類對總酚含量的影響Fig.2 Effects of acid on total phenolic content
2.2色譜條件優化
本實驗選用通用性較強的C18色譜柱對多酚類物質進行分離。由于多酚物質特別是酚酸類易分解,因而常出現色譜峰拖尾、變寬和不對稱等現象,在流動相中加入適量的酸性抑制劑可抑制此類化合物的電離,改善峰形。本文考察了在液相分析中常用的甲酸、乙酸、磷酸三種酸對多酚分離效果的影響。咖啡酸、香草酸、表兒茶素和丁香酸四種物質出峰時間非常接近,選用乙酸和磷酸時色譜峰的分離效果不佳,四種物質保留不完全,而且可能由于磷酸較強的緩沖作用,出現較多雜峰。添加甲酸時,14種標準物質分離效果較好,故選用2%甲酸作為抑制劑。
根據色譜分離原理,柱溫對色譜峰分離影響較為明顯。根據目標物自身結構性質,有些物質在高柱溫下易分離,有些物質在低柱溫下易分離。本文考察了在25、30、35、40℃四個溫度下的多酚分離效果。結果表明隨著色譜柱溫度的逐步升高,色譜峰的出峰時間逐步提前,這與文獻研究結果一致。當色譜柱溫度較低時,香草酸、表兒茶素沒有保留,且出現很多雜峰。溫度升到35℃時香草酸、表兒茶素已經出峰,但分離效果不理想。當柱溫升到40℃時,咖啡酸、香草酸、表兒茶素和丁香酸四種物質可完全分開,沒有其他雜峰,故柱溫選擇40℃。
按照優化后的色譜條件將14種標準物質混合溶液上機測定,圖3為標準品的色譜圖,表2列出了14種標準物質的名稱、保留時間、最大吸收波長。

圖3 多酚標準品HPLC圖譜Fig.3 Chromatogram of mixed polyphenols standards
2.3HLB柱萃取條件優化
固相萃取技術常作為化學分離和純化的手段應用于生物醫學、食品分析、農獸藥殘留前處理過程、有機合成等眾多領域,該技術主要是目標物與吸附劑之間通過疏水作用力、離子交換作用以及物理吸附等方式達到分離或純化的目的[13]。固相萃取的主要過程是保留和洗脫,首先目標物被保留在吸附劑上,而后通過極性較強的溶劑將目標物與吸附劑分離從而被洗脫下來。吸附劑本身是完全離子化的狀態,目標物必須完全離子化才可以保證其被吸附劑完全吸附保留,因此常在萃取過程中加入不同濃度的酸調節pH以改變目標物、吸附劑的離子化或質子化程度。此外,洗脫劑的極性大小及種類也尤為重要[14]。
2.3.1HLB柱淋洗液的選擇樣品上樣后,目標物和雜質同時被吸附在吸附劑上,應選擇適當濃度的有機溶劑或水將雜質洗去。通過調節有機溶劑的強度及體積盡可能多的去除雜質,本文考察了純水、低濃度甲醇對酚類的淋洗效果,結果如表3所示。使用純水、5%甲醇淋洗時部分多酚回收率較低,10%甲醇作為淋洗液時,酚類物質的回收率均在70%以上。

表2 14種酚類標準物質
2.3.2HLB柱洗脫液的選擇一般根據目標物的化學結構和性質以及洗脫溶劑的極性來選擇適當的洗脫液。在固相萃取時,常用作多酚物質的洗脫溶劑有甲醇、乙腈、乙酸乙酯、丙酮以及兩種以上混合溶劑,但甲醇、乙腈最為常見,本文重點考察了甲醇和乙腈在添加不同濃度的甲酸和氨水時對多酚回收率的影響,結果見表4。當添加氨水時,可能與酚酸發生不可逆反應,導致幾種多酚未能回收。無論是甲醇還是乙腈,添加5%甲酸的多酚回收率整體高于2%的甲酸,且乙腈-5%甲酸整體上回收率要高于甲醇-5%甲酸。因此選擇乙腈-5%甲酸作為洗脫液。
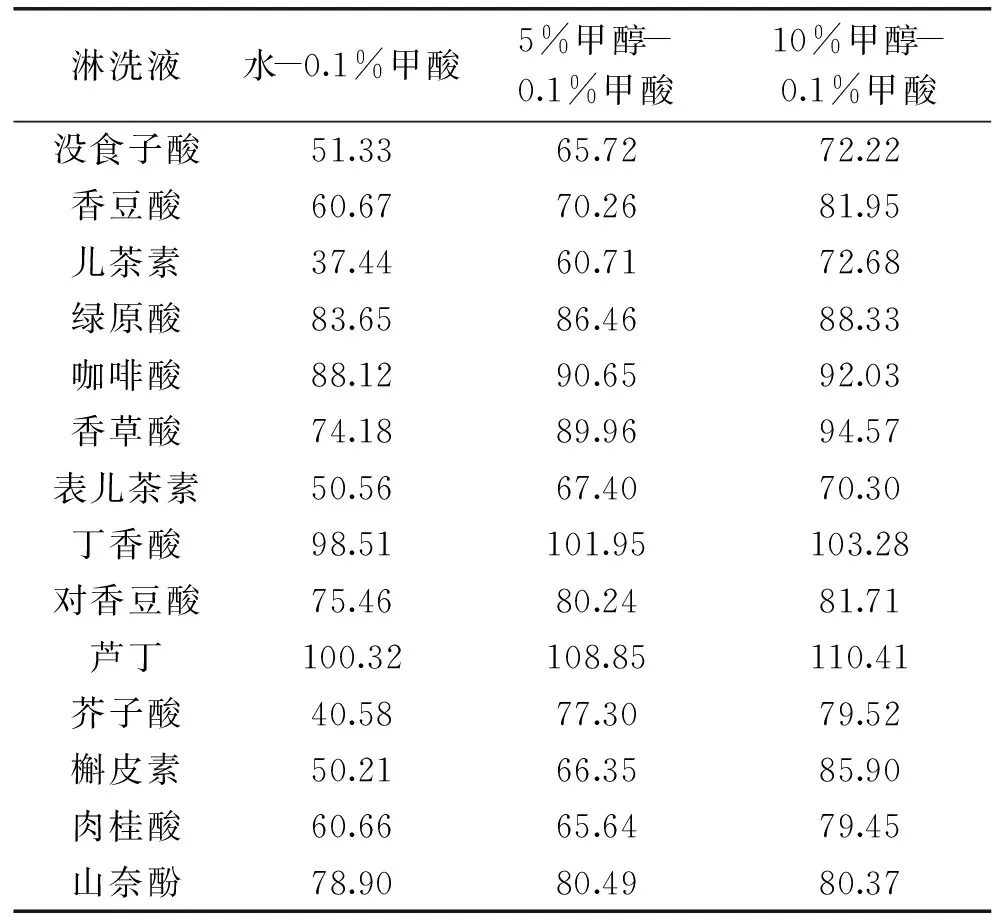
表3 多酚回收率(%)
2.4方法驗證
配制質量濃度為10 mg/L的14種多酚混合標準溶液,并逐次稀釋成系列混合標準溶液,按照優化后的色譜條件進行測定,以標準溶液的質量濃度(X)為橫坐標,色譜峰面積(Y)為縱坐標繪制標準曲線,所得回歸方程、線性范圍及相關系數見表5。各標準物質線性關系良好,相關系數均大于0.9990。將混合標準溶液稀釋后進樣,以3倍信噪比計算得多酚物質的檢出限(見表5)。取14種多酚的標準溶液,連續進樣6次進行測定,標準溶液中14種多酚峰面積的RSD均小于6.6%,表明儀器的精密度良好,滿足測定要求。
向櫻桃樣品中添加一定體積的已知濃度的混合標準品溶液,按照優化的前處理方法及色譜條件進行加標回收率實驗,根據標準曲線計算各酚類物質的含量,平行測定3份,取平均值。多酚樣品加標回收率均在70%以上,RSD均小于10.0%。方法學考察結果表明本HPLC方法具有很好的準確性和重現性,可以用于實際樣品分析。

表4 多酚回收率(%)

表5 檢測方法線性、精密度及回收率實驗結果

表6 不同櫻桃品種多酚類物質的含量(mg/kg干重)
偏低,酸櫻桃以綠原酸、芥子酸、表兒茶素、咖啡酸、對香豆酸為主。
3 結論
本文以拉賓斯(Lapins)鮮櫻桃凍干粉為原料,經過對樣品前處理方法、固相萃取條件以及色譜條件的優化,使用高效液相色譜建立了櫻桃多酚物質的檢測方法,同時對市場流通中常見的櫻桃品種進行了定性定量分析。經過對前處理條件的優化,確定提取溶劑為60%甲醇-2%甲酸,HLB固相萃取小柱的淋洗液為10%甲醇-0.1%甲酸、洗脫液為乙腈-5%甲酸,此條件下多酚回收率在70%以上。當柱溫為40℃、流動相為2%甲酸水溶液和乙腈時多酚物質峰分離度較好。不同櫻桃品種所含酚類物質大致相同,共檢出6~8種多酚,包括香草酸、香豆酸、兒茶素、表兒茶素、蘆丁、對香豆酸等,但在含量上有所差異,在0.37~240.62(mg/kg 干重)之間。
[1]Ballistreri G,Continella A,Gentile A,et al.Fruit quality and bioactive compounds relevant to human health of sweet cherry(Prunus avium L.)cultivars grown in Italy[J].Food Chemistry,2013,140:630-638.
[2]Usenik V,Fajt N,Mikulic-Petkovse M,et al.Sweet cherry pomological and biochemical characteristics influenced by rootstock[J].Journal of Agricultural and Food Chemistry,2010,58:4928-4933.
[3]Naczk M.,Shahidi F.Phenolics in cereals,fruits and vegetables:Occurrence,extraction and analysis[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(5):1523-1542.
[4]Serra AT,Duarte RO,Bronze MR,et al.Identification of bioactive response in traditional cherries from Portugal[J].Food Chemistry,2011,125:318-325.
[5]Usenik V,FabcicJ,Stampar F.Sugars,organic acids,phenolic composition and antioxidant activity of sweet cherry(Prunus avium L.)[J].Food Chemistry,2008,107:185-192.
[6]Kang SY,Seeram NP,Nair MG,et al.Tart cherry anthocyanins inhibit tumor development in ApcMin mice and reduce proliferation of human colon cancer cells[J].Cancer Letters,2003,194:13-19.
[7]Kim DO,Heo HJ,Kim YJ,et al.Sweet and sour cherry phenolics and their protective effects on neuronal cells[J].Journal of Agricultural and Food Chemistry,2005,53:9921-9927.
[8]王賢萍,段澤敏,戴桂林,等.甜櫻桃主要栽培品種多酚含量的測定與品質分析[J].中國農學通報,2011,13:173-176.
WANG Xian-ping,DUAN Ze-min,DAI Gui-lin.Polyphenol Quantitative Analysis and Quality Evaluated in Fruit of Sweet Cherry Cultivars[J].Chinese Agricultural Science Bulletin,2011,13:173-176.
[9]Liu Y,Liu X,Zhong F,et al.Comparative study of phenolic compounds and antioxidant activity in different species of cherries[J].Journal of Food Science,2011,76:633-638.
[10]Usenik V,Fabcic J,Stampar F.Sugars,organic acids,phenolic composition and antioxidant activity of sweet cherry(Prunus avium L.)[J].Food Chemistry,2008,107:185-192.
[11]Singleton VL,Rossi JA.Colorimetry of total phenolics with phosphonolybdic-phosphotungsic acid reagents[J].American Journal of Enology and Viticulture,1965,16:144-158.
[13]劉紅,曾建勇,溫賢有,等.固相萃取技術及其影響因素[J].現代農業科技,2010,11:351-354.
[14]Mülek M.,H?gger P.Highly sensitive analysis of polyphenols and their metabolites in human blood cells using dispersive SPE extraction and LC-MS/MS[J].Anal Bioanal Chemistry,2015,407:1885-1899.
2.5櫻桃樣品分析
本文方法研究時所用櫻桃品種為拉賓斯(Lapins),增加先鋒(Van)、紅燈(Hongdeng)、薩米脫(Summit)以及酸櫻桃四種櫻桃品種的檢測。五個櫻桃品種共檢出6~8種多酚,由表6可以看出,五種櫻桃均未檢出沒食子酸和肉桂酸。只有酸櫻桃檢出含有一定量的槲皮素、山奈酚,其他四種櫻桃未檢出。五個櫻桃品種所含多酚種類大致相近,但在含量上存在一定差異,其中拉賓斯主要含有表兒茶素、蘆丁、香豆酸、兒茶素及香草酸等,先鋒主要含有兒茶素、表兒茶素、香豆酸、蘆丁,紅燈中的表兒茶素及蘆丁含量較高,薩米脫中檢出的多酚種類的含量普遍
Determination of polyphenols in cherry by high-performance liquid chromatography
JIANG Nan,WANG Meng,WEI Di-zhe,FENG Xiao-yuan*
(Beijing Research Center for Agricultural Standards and Testing(BRCAST),Risk Assessment Lab for Agro-products(Beijing),Ministry of Agriculture.P.R.China, Beijing Municipal Key Laboratory of Agriculture Environment Monitoring,Beijing 100097,China)
HPLC was applied to separate and determine polyphenols in cherry.The conditions of pretreatment,solid-phase extraction and chromatography were investigated.The optimal pretreatment and chromatographic separating conditions were established:extraction solvent was 60% methanol(2% formic acid),the column leacheate was 10% methanol(0.1% formic acid),column eluent was acetonitrile(5% formic acid).Under this condition,the recovery of the polyphenols was higher than 70%.Meanwhile,mobile phase was water(2% formic acid)and acetonitrile,column temperature was 40℃.Through comparison with standar sample,vanillic acid,catechin,caffeic acid,ruitin,p-coumaric acid was detected in cherry.The content of the polyphenols was in the range of 0.365~240.617(mg/kg DW).This method was rapid,sensitive,simple,accurate and less impurity interference,and rhe polyphenols peaks were separated well.
high performance liquid chromatography(HPLC);solid-phase extraction;polyphenols;cherry
2015-11-05
姜楠(1988-),女,碩士,實習研究員,研究方向:農產品質量安全與標準,E-mail:jiangnan_fx@163.com。
馮曉元(1965-),女,博士,研究員,研究方向:果品質量與安全,E-mail:fengxiaoyuan2014@126.com。
公益性行業(農業)科研專項(201303075);北京市自然科學基金(6154023);北京農業質量標準與檢測技術研究中心開放課題(zbzxkfkt201504)。
TS201.1
B
1002-0306(2016)07-0288-06
10.13386/j.issn1002-0306.2016.07.047

