乳酸桿菌的表面特性及其黏附能力的研究
向鑫玲,張英春,,*,馬 放,張蘭威,李少慧
(1.哈爾濱工業大學 化工學院食品科學與工程系,黑龍江哈爾濱 150090;2.哈爾濱工業大學 市政環境工程學院,黑龍江哈爾濱 150090)
?
乳酸桿菌的表面特性及其黏附能力的研究
向鑫玲1,張英春1,2,*,馬放2,張蘭威1,李少慧1
(1.哈爾濱工業大學 化工學院食品科學與工程系,黑龍江哈爾濱 150090;2.哈爾濱工業大學 市政環境工程學院,黑龍江哈爾濱 150090)
乳酸桿菌是腸道益生菌,主要通過其表面的黏附因子定殖于腸道而發揮益生作用。為了研究乳酸桿菌表面性質與黏附能力之間的關系,選擇五種乳酸桿菌,分別進行自聚集能力、表面疏水性及與致病菌大腸桿菌ATCC25922和枯草芽孢桿菌K的共聚能力測定。同時,利用氯化鋰和高碘酸鈉分別處理乳酸桿菌后再與致病菌進行共聚作用,研究乳酸桿菌表面參與黏附的活性物質。結果表明,約氏乳酸桿菌F0421和副干酪乳酸桿菌M5-L具有良好的表面性質和黏附特性。乳酸桿菌與枯草芽孢桿菌K的共聚作用較好。同時,氯化鋰和高碘酸鈉處理前后,乳酸桿菌對致病菌的聚集能力有所下降,表明菌株表面蛋白及多糖參與了黏附過程。
乳酸桿菌,自動聚集,共聚作用,疏水性,表面特性
乳酸桿菌是人和動物胃腸道中的正常菌群,其在腸道中存活的數量越多、定殖的時間越長,對人及動物的健康就會越有利[1]。乳酸桿菌對腸道表面的黏附能力能夠為其提供競爭優勢,是其在消化道中長期存在的必要條件。而乳酸桿菌的表面特性是決定其黏附能力的重要影響因素,因此研究乳酸桿菌的表面性質對了解其益生能力具有重要的作用[2-4]。益生菌的黏附分為非特異性黏附和特異性黏附[5]。非特異性黏附通過疏水相互作用、靜電作用等進行,而特異性黏附則為菌體表面的黏附素與特定受體間的結合[6]。乳酸桿菌的凝集作用與表面性質密切相關,也賦予了乳酸桿菌許多益生功能。自聚集作用使益生菌形成阻礙致病菌在腸道定殖的屏障,從而抑制致病菌對人體腸道的侵襲,有助于促進人體健康。而與腸道致病菌的凝集可使致病菌更容易從腸道環境中排出,同時,產生抑菌物質的乳酸桿菌與致病菌的凝集對于宿主抵抗致病菌感染具有重要的意義[7-10]。
本文綜合研究了乳酸桿菌的非特異性黏附和特異性黏附,為全面了解乳酸桿菌的黏附特性及進一步研究乳酸桿菌的黏附機制奠定了基礎。實驗同時綜合了兩種常見的致病菌如大腸桿菌和枯草芽孢桿菌,進一步分析了不同乳酸桿菌作用不同致病菌能力的差異,為特異性的應用乳酸桿菌抑制致病菌提供了可能。本實驗的目的在于,通過對益生菌的表面特性、黏附能力的測定,分析研究影響益生菌黏附作用的因素,對制定功能性食品、認識微生態學的基本規律有著重要意義。
1 材料與方法
1.1材料與儀器
副干酪乳酸桿菌M5-L(L.paracasei subp.paracasei M5-L,M5-L)源于新疆哈薩克牧民自制的馬奶酒;鼠李糖乳酸桿菌J10-L(L.rhamnosus J10-L,J10-L)分離于甘肅蘭州傳統的發酵蔬菜汁;干酪乳酸桿菌Q8-L(L.casei Q8-L,Q8-L)分離于青海牧區自制的牦牛奶;約氏乳酸桿菌F0421(L.johnsonii F0421,F0421)分離于健康人的糞便;鼠李糖乳酸桿菌GG(L.rhamnosus GG,LGG)標準參照菌株,哈爾濱工業大學食品系保存;大腸桿菌ATCC25922(Escherichia coli ATCC25922,Ec)、枯草芽孢桿菌K(Bacillus subtilis K,K)由黑龍江省臨床檢測中心提供。
乳酸細菌培養基(De Man,Rogosa,Sharpe,MRS)用于培養乳酸桿菌,廣東環凱微生物科技有限公司;胰酪胨大豆肉湯培養基(Trypticase Soy Broth,TSB)用于培養致病菌,廣東環凱微生物科技有限公司;高碘酸鈉、氯化鋰、甲醇天津市科密歐化學試劑有限公司,分析純。
UV-5100型紫外可見分光光度計上海廣譜儀器有限公司;XK96-A型漩渦震蕩儀姜堰市新康醫療器械有限公司;LDZX-40CI型立式自動電熱壓力滅菌鍋上海申安醫療器械廠;SW-CJ-1F型單人雙面凈化工作臺上海藍豹實驗儀器有限公司;TGL-16G型臺式離心機上海安亭科學儀器廠。
1.2細菌培養及菌數的調整
乳酸桿菌M5-L、J10-L、Q8-L、F0421、LGG活化2代后接種于MRS 培養液,37℃厭氧培養18 h。致病菌大腸桿菌Ec和枯草芽孢桿菌K接種于TSB培養液中37℃培養16~18 h備用。
使用平板計數法得出五種乳酸桿菌菌落數均為1×109cfu/mL,兩種致病菌菌落數均為2×109cfu/mL。實驗中將乳酸桿菌菌落數調整為108cfu/mL,即取100 μL于MRS液體培養基中培養的菌液,離心收集菌體,使用PBS(pH7.2)洗滌2次后于1 mL PBS中重懸,將菌數調整為108cfu/mL。將致病菌菌落數調整為108cfu/mL,即取50 μL于TSB液體培養基中培養的菌液,離心收集菌體,使用PBS(pH7.2)洗滌2次后于1 mL PBS中重懸,將菌數調整為108cfu/mL。
1.3乳酸桿菌的自凝能力測定
乳酸桿菌在MRS培養基中培養24 h,離心收集菌體(4500×g,15 min),使用PBS(pH7.2)洗滌2次后于PBS中重懸,將菌數調整為108cfu/mL,4 mL等量的細胞菌懸液裝入5 mL的離心管中,混勻后靜置于室溫下。自聚測定的時間為0、2、4、6、8 h,每次取0.5 mL的上部菌懸液,加入到1.5 mL的PBS中,混勻,測定600 nm下的吸光值,以PBS作為空白對照。凝集率(A%)計算公式[11]:
式中:A0-為初始時間時600 nm下的吸光度; At-為不同時間的吸光光度值。
1.4乳酸桿菌的表面疏水能力測定
采用微生物黏附碳氫化合物法(Bacteria Adhesion To Hydrocarbons,BATH)對菌株表面疏水特性進行測定[12]。細菌培養物經4500×g 15 min離心,然后用PBS(pH7.2)洗脫2次,重新懸浮于PBS中,調整菌數為108cfu/mL。此時從其中吸取3mL與0.5mL二甲苯渦旋混合60 s,停頓10 s后振蕩60 s,室溫下靜置60 min分層。取下層水相,以緩沖液為空白對照,在波長600 nm處測量吸光光度值并記錄。表面疏水率計算公式:
式中:A0-為與二甲苯混合前600 nm的吸光度;A-為與二甲苯混合后600 nm的吸光度。
1.5乳酸桿菌與致病菌的共聚能力測定
乳酸桿菌在MRS培養基中培養24 h,離心收集菌體(4500×g,15 min),使用PBS(pH7.2)洗滌2次后于PBS中重懸,將菌數調整為108cfu/mL。同時,致病菌采用同樣的方法,重懸于PBS中,并且調整菌數為108cfu/mL。分別吸取2mL待測菌菌懸液和致病菌菌懸液于試管中,漩渦震蕩10 s混勻,分別在0、2、4、6、8 h測定其在波長為600 nm下的吸光值[13]。對致病菌的凝集率通過下列公式計算:
式中:Amix-為致病菌與待測菌混合液在各個時間點的吸光值;A0-為初始時間時混合液的吸光值。
1.6乳酸桿菌表面活性分子的研究
1.6.15 mol/L氯化鋰法參考文獻[14]的方法,乳酸桿菌連續活化3代后,接入10 mL的MRS培養基中,培養18 h后,離心(4500×g,10 min,4℃),沉淀物用滅菌的PBS(4℃,pH7.2)洗兩次,將全部沉淀物懸浮于2 mL的5 mol/L LiCl中,在37℃的搖床培養箱(200 r/min)培養60 min。然后離心收集菌體(4500×g,15 min),后于PBS中重懸,將菌數調整為108cfu/mL。同時,將致病菌采用相同的方法,調整菌數為108cfu/mL。分別吸取2 mL待測菌菌懸液和致病菌菌懸液于試管中,漩渦震蕩10 s混勻,分別在0、2、4、6、8 h測定其在波長為600 nm下的吸光值。對致病菌的凝集率通過下列公式計算:
式中:Amix-為致病菌與待測菌混合液在各個時間點的吸光值;A0-為初始時間時混合液的吸光值。
1.6.2高碘酸鈉法參考文獻[15]的方法,乳酸桿菌連續活化3代后,接入10 mL的MRS培養基中,培養18 h后,離心(4500×g,10 min,4℃),沉淀物用滅菌的PBS(4℃,pH7.2)洗兩次,將所有菌體沉淀懸浮于2 mL的0.05 mol/L的高碘酸鈉溶液中(溶解于0.1 mol/L檸檬酸-磷酸緩沖液,pH4.5),在37℃的搖床培養箱(200 r/min)培養60 min。然后離心收集菌體(4500×g,15 min),后于PBS中重懸,將菌數調整為108cfu/mL。測定方法同1.6.1氯化鋰處理后測定方法。
1.7數據統計
實驗結果以平均值±標準偏差表示,所有實驗均重復三次。采用Origin 8.6對數據進行計算并繪圖。運用SPSS 18.0軟件,采用獨立樣本t檢驗進行數據分析(p<0.05)。
2 結果與分析
2.1乳酸桿菌的自凝能力測定結果
菌株的自凝集是指同一種菌間相互凝集形成多細胞簇的現象。乳酸桿菌的自凝集結果見圖1。五株乳酸桿菌均具有自凝能力,并且在靜置凝集的8 h過程中,凝集率隨著時間的延長均有所上升。其中M5-L菌株的自凝能力最強,在8 h時達到85.58%,自凝能力最差的是J10-L,8 h后的凝集率為37.46%。而在實驗測定的8 h內,F0421菌株也表現出了高于標準菌株LGG的自凝能力,其凝集率僅次于M5-L菌株。
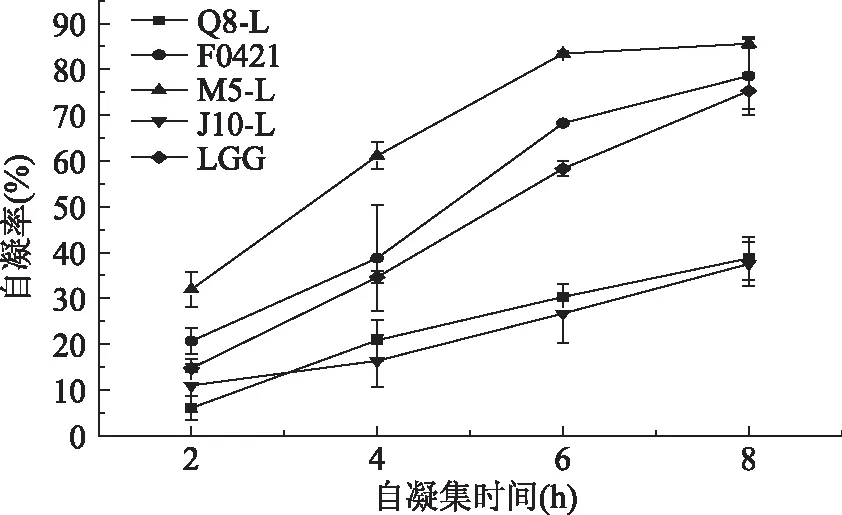
圖1 五株乳酸桿菌自凝集實驗結果比較Fig.1 The autoaggregation ability result of five strains of Lactobacillus
2.2乳酸桿菌的表面疏水能力測定結果
在衡量乳酸桿菌的表面疏水性能力時,通常將菌株對碳氫化合物的黏附能力作為重要的衡量指標。在本實驗中將各個菌株對二甲苯的黏附能力作為評價菌體表面疏水能力的指標,菌株的疏水性如圖2所示,M5-L的疏水能力最大為64.48%(p<0.05),Q8-L的疏水能力最小為3.73%,而另外三株乳酸桿菌F0421、J10-L、LGG的疏水率分別為11.87%(p<0.05)、4.80%、5.03%。其中Q8-L、J10-L和LGG三種菌株的疏水能力相差不大。
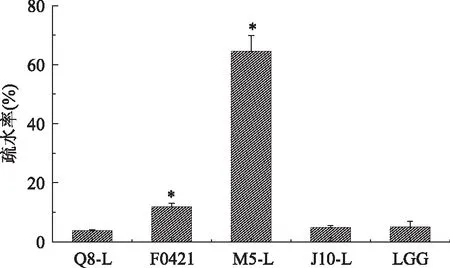
圖2 五株乳酸桿菌的疏水能力測定結果Fig.2 Cell surface hydrophobicity of five strains of Lactobacillus注:*代表與標準菌株相比差異顯著(p<0.05),圖3~圖8同。
2.3乳酸桿菌與致病菌的共聚能力測定結果
根據乳酸桿菌的自凝能力、表面疏水能力測定結果,選擇自凝性和疏水性較好的菌株M5-L、F0421,并用LGG菌株作為標準菌株進行后續實驗測定。測試的三株乳酸桿菌和兩種致病菌的共聚實驗結果見圖3和圖4。在室溫下靜置共聚8 h后,受試的3株乳酸桿菌對人體腸道致病菌均顯示出凝集能力。并且對致病菌的凝集率隨益生菌、致病菌的不同和共聚時間的變化而有所不同。結果表明,三種乳酸桿菌對兩種致病菌的共聚能力具有時間依賴性,即隨著時間的增加,凝集率也發生增加。由圖3可以看出,在4 h內,標準菌株LGG對大腸桿菌的共聚作用強于M5-L和F0421,但在6~8 h內,M5-L對大腸桿菌的凝集率發生顯著的增加,強于其他兩種乳酸桿菌菌株,但相比于LGG沒有顯著性差異。而圖4可以看出,在6 h內,M5-L相比其他兩種菌株對枯草芽孢桿菌的共聚作用具有顯著的優勢,而在8 h時,F0421的共聚能力發生顯著的提高,在三種乳酸桿菌中對枯草芽孢桿菌具有最好的共聚能力,且共聚效果顯著高于LGG。同時,對比圖3和圖4可知,在各個時間內,三種乳酸桿菌均表現出與枯草芽孢桿菌(K)的共聚能力強于大腸桿菌(Ec)的情況。
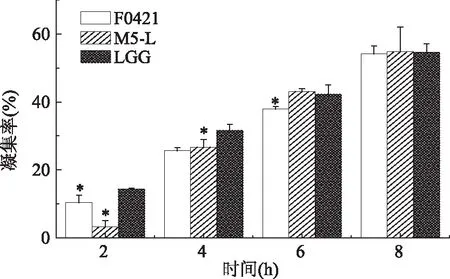
圖3 三株乳酸桿菌對大腸桿菌(Ec)的凝集率Fig.3 Aggregation rate of three strains of Lactobacillus with Ec

圖4 三株乳酸桿菌對枯草芽孢桿菌(K)的凝集率Fig.4 Aggregation rate of three strains of Lactobacillus with K
2.4乳酸桿菌表面活性分子的研究
研究表明,乳酸桿菌的黏附作用與其細菌的表面蛋白、多糖等存在一定關系。采用氯化鋰處理菌體能夠破壞乳酸桿菌表面的S-層蛋白,而采用高碘酸鈉處理菌體則破壞乳酸桿菌表面的多糖。將經處理后的乳酸桿菌與致病菌進行共聚能力測定,來判斷三種乳酸桿菌黏附作用的主要位點是S-層蛋白還是多糖。氯化鋰處理后三株乳酸桿菌對致病菌的凝集率見圖5和圖6。結果表明,氯化鋰處理后,靜置凝聚8 h,三株乳酸桿菌對大腸桿菌(Ec)、枯草芽孢桿菌(K)仍能表現出一定的共聚能力,并且隨著時間的延長,三種乳酸桿菌對兩種致病菌的凝集率均不斷增加。其中,M5-L菌株對Ec和K的共聚能力均為最高。通過與2.3的結果比較可知,F0421菌株經氯化鋰處理后,其與兩種致病菌的凝集率均發生顯著降低,而氯化鋰處理對于M5-L菌株及LGG菌株對兩種致病菌的共聚作用沒有顯著影響,反而使其與致病菌的共聚能力發生了一定程度的提高。

圖5 氯化鋰處理后三株乳酸桿菌對大腸桿菌(Ec)的凝集率Fig.5 Copolymerization rate of three strains of Lactobacillus with Ec after LiCl treatment

圖6 氯化鋰處理后三株乳酸桿菌對枯草芽孢桿菌(K)的凝集率Fig.6 Copolymerization rate of three strains of Lactobacillus with K after LiCl treatment
高碘酸鈉處理后三株乳酸桿菌分別對兩種致病菌的凝集率見圖7和圖8。高碘酸鈉處理后,靜置凝集8 h,三株乳酸桿菌對大腸桿菌(Ec)、枯草芽孢桿菌(K)仍能表現出一定的共聚能力,并且隨著時間的延長,三種乳酸桿菌對兩種致病菌的凝集率均不斷增加。其中,F0421菌株對Ec和K的共聚能力均為最高。通過與2.3的結果比較可知,高碘酸鈉的處理使得M5-L和LGG菌株與兩種致病菌的凝集率均發生顯著降低,而高碘酸鈉的處理相對于F0421菌株卻未發生顯著影響。

圖7 高碘酸鈉處理后三株乳酸桿菌對大腸桿菌(Ec)的凝集率Fig.7 Copolymerization rate of three strains of Lactobacillus with Ec after sodium periodate treatment

圖8 高碘酸鈉處理后三株乳酸桿菌對枯草芽孢桿菌(K)的凝集率Fig.8 Copolymerization rate of three strains of Lactobacillus with K after sodium periodate treatment
3 討論
菌株的凝集包括同一菌株之間的凝集現象(如自凝集)及不同菌間的凝集現象(共凝集)。菌株凝集作用與益生菌對致病菌的抑制能力相關。很多研究結果已證明,乳酸菌的凝集能力與其黏附宿主細胞的能力和與病原菌共凝集的能力具有相關性,具有較強凝集能力的菌株可能定殖能力更好,也能更有效借助共凝集作用清除病原菌[16-17]。同時,乳酸菌與致病菌的共聚作用能夠掩蓋致病菌的表面物質,使致病菌不能夠與宿主細胞表面的分子受體結合,進而干擾致病菌對宿主細胞的入侵作用[18]。Golowczyc等[19]分別研究了能發生共聚作用的菌株L.kefir CIDCA8321和不能發生共聚作用的菌株L.kefir CIDCA83113對Salmonella的作用,結果表明,CIDCA8321在抑制Salmonella入侵Caco-2細胞及TC-7細胞方面具有顯著的效果,而在CIDCA83113卻未發現這種作用。本實驗通過對乳酸桿菌自凝能力及與致病菌共聚能力的測定,結果表明M5-L和F0421都具有很好的自凝能力以及與致病菌的共聚能力,且兩種乳酸菌對枯草芽孢桿菌K的共聚性強于大腸桿菌(Ec),這可能與兩種致病菌不同的表面結構有關。
細菌的黏附與菌體表面性質存在很大的相關性。研究菌體的表面性質不僅可以快速篩選具有黏附性質的益生菌,還可以用于判斷菌體的黏附機制。研究表明,細菌表面疏水性的強弱與細胞表面蛋白、菌毛、脂磷壁酸、多糖等有關,其被認為與細菌的特異性黏附相關[20-21]。為了進一步研究乳酸桿菌表面疏水性與黏附性的關系,利用BATH法測定了乳酸桿菌的表面疏水能力。M5-L顯示出了很好的表面疏水性,F0421的表面疏水能力僅次于M5-L。通過進一步的研究分析,對兩種菌株分別使用氯化鋰和高碘酸鈉處理,分別破壞其表面的S-層蛋白和多糖,而后再與兩種致病菌進行共聚作用,結果表明氯化鋰處理能夠顯著降低F0421菌株的共聚能力,而高碘酸鈉處理則顯著降低M5-L菌株的共聚能力,說明F0421表面的S-層蛋白是其發揮黏附作用的活位點,而M5-L的粘附活位點則是多糖。而實驗中經氯化鋰處理后的M5-L的共聚能力相比于未處理的菌株有所上升,推測可能是其表面覆蓋的S-層蛋白對多糖的黏附位點有一定的掩蓋作用,經氯化鋰去除后,將多糖位點暴露,使得M5-L的共聚能力有所上升,我們推測位于F0421表面黏附位點的S-層蛋白是參與乳酸桿菌黏附的主要物質。陳臣等[22]利用熒光標記法來檢測植物乳桿菌ST-Ⅲ對Caco-2細胞的黏附機理,利用化學法或酶法去除菌體的S-層蛋白,進行黏附性實驗。結果表明,去除S-層蛋白的L.plantarum ST-Ⅲ對Caco-2細胞的黏附能力顯著降低,而將除去S-層蛋白的菌體與提取的表面蛋白進行孵育后,再進行黏附性實驗,其黏附率從4.82%提高至8.46%,結論也證明了表面蛋白參與黏附過程。
乳酸桿菌的S-層蛋白是其細菌表面的一種蛋白成分,以非共價鍵與細胞壁結合的包被結構。研究證實,用提取劑去除S-層蛋白后,菌體能夠重新組裝其結構[23]。在本實驗中,經氯化鋰處理后的乳酸菌體對致病菌的共聚能力隨著時間的延長而增加,也再次證實了其表面的S-層蛋白的再生能力。而經高碘酸鈉處理的菌體,其與致病菌的共聚能力也隨時間延長而增強,可能也是由于乳酸桿菌表面的多糖發生了再生。
4 結論
本研究表明,五株乳酸桿菌中,自聚能力、疏水性較好的均為M5-L和F0421,同時,M5-L及F0421與K的共聚效果強于其與Ec的共聚作用,并且乳酸桿菌與致病菌的共聚能力與共聚時間成正相關。研究證實,F0421菌株表面的主要活性物質為S-層蛋白,而M5-L菌株表面的主要活性物質則為多糖。實驗結果表明不同的乳酸菌菌株具有不同的表面性質,這對于開發具有潛力的益生菌,并應用于功能性食品、發酵等行業具有重要意義。
[1]張英春,韓雪,張蘭威,等.益生菌抑制致病菌作用的機制研究進展[J].微生物學通報,2012,39(9):1306-1313.
[2]Kleerebezem M,Bernard E.The extracellular biology of the lactobacilli[J].Fems Microbiology Reviews,2010,34(2):199-230.
[3]汪海鋒,章文明,汪以真,等.乳酸桿菌與腸道黏附相關表面因子及其機制研究進展[J].動物營養學報,2011,23(2):179-186.
[4]肖榮,王遠亮,李宗軍.益生性乳酸菌黏附性研究進展[J].食品與發酵工業,2008,34(5):134-137.
[5]佟盼盼,劉莉,楊桂連,等.乳酸桿菌表面結構和粘附特性的研究進展[J].中國微生態學雜志,2012,24(10):941-947.
[6]李清,劉小莉,王英,等.植物乳桿菌表面性質及對Caco-2細胞的黏附[J].食品科學,2015,36(09):97-101.
[7]García-cayuela T,Korany A M,Bustos I,et al.Adhesion abilities of dairy Lactobacillus plantarum strains showing an aggregation phenotype[J].Food Research International,2014,57:44-50.
[8]Tuo Y F,Yu H L,Ai L Z,et al.Aggregation and adhesion properties of 22 Lactobacillus strains[J].Journal of Dairy Science,2013,96(7):4252-4257.
[9]白潔,李衛芬,黃琴,等.幾株益生乳酸菌對Caco-2細胞的黏附及其對致病菌黏附的影響[J].動物營養學報,2012,24(10):1992-1998.
[10]Liu X M,Liu W Y,Zhang Q X,et al.Screening of lactobacilli with antagonistic activity against enteroinvasive Escherichia coli[J].Food Control,2013,30(2):563-568.
[11]Del R B,Sgorbati B,Miglioli M,et al.Adhesion,autoaggregation and hydrophobicity of 13 strains of Bifidobacterium longum[J].Letters in Applied Microbiology,2000,31:438-442.
[12]Bernet M F,Brassar T D,Neeser J R,er al.Adhesion of Human Bifidobacterial Strains to Cultured Human Intestinal Epithelial Cells and Inhibition of Enteropathogen-Cell Interactions[J].Applied Environmental Microbiology,1993,59(12):4121-4128.
[13]Collado M C,Meriluoto J,Salminen S.Adhesion and aggregation properties of probiotic and pathogen strains[J].European Food Research and Technology,2008,226:1065-1073.
[14]Lortal S V,Heijenoort J,Gruber K,et al.S-layer of Lactobacillus helveticus ATCC 12046:isolation,chemical characterization and re-formation after extraction with lithium chloride[J].Journal of General Microbiology,1992,139:611-618.
[15]Greene J D,Klaenhammer T R.Factors involved in adherence of lactobacilli to human Caco-2 cells[J].Applied and Environmental Microbiology,1994,60:4487-4494.
[16]Boris S,Suarez J E,Barbes C,et al.Characterization of the aggregation promoting factor from Lactobacillus gasseri,a vaginal isolate[J].Journal of Applied Microbiology,1997,83(4):413-420.
[17]Mastromarino P,Brigidi P,Macchia S,et al.Characterization and selection of vaginal Lactobacillus strains for the preparation of vaginal tablets[J].Journal of Applied Microbiology,2002,93(5):884-893.
[18]Kos B,Suskovic J,Vukovic S,et al.Adhesion and aggregation ability of probiotic strain Lactobacillus acidophilus M92[J].Applied Microbiology and Biotechnology,2003,94:981-987.
[19]Golowczyc M A,Mobili P,Garrote G L,et al.Protective action of Lactobacillus kefir carrying S-layer protein against Salmonella enterica serovar Enteritidis[J].International Journal of Food Microbiology,2007,118:264-273.
[20]Remus D M,Kleerebezem M,Bron P A.How probiotic lactobacilli communicate with the host[J].European Journal of Pharmacology,2011,668:s33-s42.
[21]Ren D Y,LI C,Qin Y Q,et al.Inhibition of Staphylococcus aureus adherence to Caco-2 cells by lactobacilli ang cell surface properties that influence attachment[J].Anaerobe,2012,18:508-515.
[22]陳臣,周方方.熒光標記法初探植物乳桿菌ST-Ⅲ對 Caco-2 細胞的黏附機理[J].微生物學通報,2010,37(3):355-361.
[23]李宗軍,楊秀華,劉元元,等.乳桿菌S-層蛋白的多樣性及其研究方法[J].食品與生物技術學報,2009,28(6):721-725.
Surface properties and adhesion ability of Lactobacilus
XIANG Xin-ling1,ZHANG Ying-chun1,2,*,MA Fang2,ZHANG Lan-wei1,LI Shao-hui1
(1.Department of Food Science and Engineering in School of Chemical Engineering and Technology,Harbin Institute of Technology,Harbin150090,China; 2.School of Municipal and Environmental Engineering,Harbin Institute of Technology,Harbin 150090,China)
Lactobacillus are the intestinal probiotics and they usually play an important role in intestinal through the ability of adhesion and colonization.In order to realize the relationship between surface properties and adhesion,the autoaggregation ability,copolymerization ability with Escherichia coli ATCC25922 or Bacillus subtilis K and cell surface hydrophobicity of five Lactobacillus strains from different sources were assessed.At the same time,the compounds associated with the adhesion process were investigated by using LiCl-treated and sodium periodate-treated.The results showed that L.paracasei subp.paracasei M5-L and L.johnsonii F0421 showed better surface properties and adhesion ability.When Lactobacillus coaggregated with Bacillus subtilis K had much better copolymerization.Meanwhile,when treated with LiCl or sodium periodate,the autoaggregation and adhesion of Lactobacillus were decreased,indicating that the surface layer protein and polysaccharide play an important role in the process of adhesion.
Lactobacilus;autoaggregation;hydrophobicity;copolymerization;surface property
2015-08-07
向鑫玲(1992-),女,在讀碩士,研究方向:乳酸桿菌及其活性產物研究,E-mail:xiangxinling1992@163.com。
張英春(1975-),女,博士,副教授,研究方向:乳酸桿菌及其活性產物研究,E-mail:zyc229@163.com。
國家自然科學基金項目(31301515);中國博士后基金特別資助項目(2013T60382);中國博士后基金項目(2012M510093);黑龍江省自然科學基金項目(C201433)。
TS201.3
A
1002-0306(2016)07-0126-06
10.13386/j.issn1002-0306.2016.07.017

