右美托咪定對大鼠腦缺血再灌注后神經細胞凋亡的影響
蘭琛
(中國人民解放軍總醫院,北京100853)
?
右美托咪定對大鼠腦缺血再灌注后神經細胞凋亡的影響
蘭琛
(中國人民解放軍總醫院,北京100853)
目的探討右美托咪定對大鼠腦缺血再灌注后神經細胞凋亡的影響。方法將24只雄性SD大鼠隨機分成假手術組(Sham組)、缺血再灌注組(IR組)、右美托咪定組(DEX組)各8只。Sham組僅分離血管,不留置線栓;其余組均采用大腦中動脈阻閉2 h、再灌注24 h的方法建立局灶性腦缺血再灌注模型。DEX組于再灌注即刻腹腔注射鹽酸右美托咪定注射液100 μg/kg,IR組給予等量生理鹽水。再灌注24 h時處死大鼠取腦組織,TUNEL染色檢測細胞凋亡情況,免疫組化法檢測凋亡調節基因相關蛋白Bcl-2、Bax、Caspase-3、Cytochrome C表達。結果與Sham組相比,IR組和DEX組細胞凋亡率升高,腦組織Bcl-2、Bax、Caspase-3、Cytochrome C表達增加(P均<0.01);與IR組相比,DEX組細胞凋亡率降低,Bcl-2表達減少,Bax、Caspase-3、Cytochrome C表達減少(P均<0.05)。結論右美托咪定可減輕大鼠腦缺血再灌注損傷,其機制與上調Bcl-2蛋白表達,下調Bax蛋白表達,減少線粒體釋放Cytochrome C,降低Caspase-3活化,從而抑制神經細胞凋亡有關。
右美托咪定;再灌注損傷;腦缺血;細胞調亡調節基因;大鼠
右美托咪定是一種新型高選擇性α2腎上腺素受體激動劑,具有鎮靜、鎮痛、抑制交感神經活性等作用,作為麻醉輔助用藥廣泛用于臨床。目前,關于右美托咪定的神經保護作用已有較多報道[1~5]。2014年10月~2015年3月,我們觀察了右美托咪定對大鼠局灶性腦缺血再灌注后神經細胞凋亡情況,以及腦組織中凋亡調節基因相關蛋白Bcl-2、Bax、Caspase-3、Cytochrome C的表達情況,探討右美托咪定的神經保護作用機制。
1 材料與方法
1.1材料健康雄性SD大鼠24只,體質量250~280 g,由解放軍總醫院實驗動物中心提供。注射用鹽酸右美托咪定(江蘇恒瑞醫藥股份有限公司);TUNEL原位細胞凋亡檢測試劑盒,兔抗Bcl-2、Bax、Caspase-3、Cytochrome C多克隆抗體及免疫組化二抗染色試劑盒(正常山羊血清,SABC,生物素化山羊抗兔IgG,抗原修復液)及DAB顯色試劑盒(中杉生物技術開發公司)。
1.2動物分組與處理將大鼠隨機分為假手術組(Sham組)、缺血再灌注組(IR組)、右美托咪定組(DEX組)各8只。IR組和DEX組均采用線栓法制作局灶性腦缺血再灌注損傷模型,大腦中動脈阻閉2 h、再灌注24 h。Sham組僅分離血管,不留置線栓。DEX組于再灌注即刻給予4 μg/mL的鹽酸右美托咪定注射液100 μg/kg腹腔注射,IR組腹腔注射等量生理鹽水。
1.3標本制備再灌注24 h時將大鼠麻醉,迅速開胸暴露心臟,經升主動脈插管后灌注生理鹽水快速沖洗,再用4%冷多聚甲醛磷酸緩沖液沖洗灌注,至肝臟褪色變硬,四肢、尾變硬。斷頭取腦,取視交叉前后2~3 mm范圍的冠狀切片腦組織,置于4%多聚甲醛中,4 ℃固定24 h,常規石蠟包埋,連續冠狀切片,片厚約4 μm,置溫箱烤干。
1.4神經細胞凋亡檢測取腦組織切片,行TUNEL染色,高倍鏡下觀察,細胞核呈棕黃色或棕褐色為凋亡細胞。取每張切片中梗死灶邊緣區域相互不重疊的4個視野,采用Image ProPlus 6.0圖像分析系統計算細胞凋亡率(凋亡細胞數/總細胞數×100%)。
1.5腦組織Bcl-2、Bax、Caspase-3、Cytochrome C表達檢測取腦組織切片,常規脫臘、水化后,分別滴加兔抗Bcl-2、Bax、Caspase-3、Cytochrome C多克隆抗體,按免疫組化ABC法染色,DAB顯色,蘇木素復染,二甲苯透明,中性樹膠封片。于高倍鏡下觀察,細胞質呈棕黃色為陽性。每張切片取梗死灶邊緣區域相互不重疊的4個視野,采用Image ProPlus 6.0圖像分析系統計算Bcl-2、Bax、Caspase-3、CytochromeC積分光密度值(IOD)。
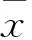
2 結果
2.1各組神經細胞凋亡率比較Sham組神經細胞凋亡率為4.7%±0.8%,IR組、DEX組分別為58.7%±6.5%、42.3%±4.0%,均較Sham組明顯增加(P均<0.01)。與IR組比較,DEX組神經細胞凋亡率明顯降低(P<0.05)。
2.2各組腦組織中Bcl-2、Bax、Caspase-3、Cytochrome C蛋白表達比較見表1。

表1 各組腦組織中Bcl-2、Bax、Caspase-3、Cytochrome C蛋白表達比較
注:與Sham組比較,#P<0.01;與IR組比較,*P<0.05。
3 討論
有研究發現,缺血性腦中風發生早期,缺血中心區腦血流急劇下降,神經細胞死亡以壞死為主,而缺血中心區周圍(缺血半暗帶)的神經細胞仍具有代謝活力,其后續的死亡以凋亡為主,細胞程序性死亡即凋亡在缺血再灌注損傷中起了重要作用[7,8]。因此,對缺血半暗帶神經細胞的“搶救”是抗腦缺血治療的重要手段。右美托咪定是高選擇性α2腎上腺素受體激動劑,具有鎮靜、鎮痛、抑制交感神經活性等作用。右美托咪定的神經保護作用機制與抑制兒茶酚胺釋放、降低谷氨酸興奮性毒性、影響一些信號通路等有關[1~5]。但是,其對腦缺血再灌注后神經細胞凋亡的影響尚未明確。研究表明,腦缺血再灌注損傷中大量氧自由基的形成、NO的作用、興奮性氨基酸的釋放及鈣離子穩態失調都可產生與凋亡相關的信號。目前已知有3條主要的信號轉導通路來調控細胞凋亡:①死亡受體途徑:Fas膜受體系統激活Caspase-8,Caspase-8直接激活Caspase-3而引起凋亡[9];②線粒體途徑:多種促凋亡因素引起線粒體膜通透性轉運孔道開放,Cytochrome C從線粒體釋放到胞質后與凋亡蛋白酶激活因子(Apaf-1)結合成復合物,激活Caspase-9,進而激活Caspase-3誘導凋亡[10,11];③Caspase非依賴性途徑:由凋亡誘導因子(AIF)觸發神經細胞發生的凋亡[12]。Bcl-2基因家族在線粒體途徑中起重要調控作用,Bcl-2基因家族包括兩大類,抑制凋亡的基因如Bcl-2、Bcl-xl、Bcl-w等,促進凋亡的基因如Bax、Bad、Bak等。Bax可以從胞質轉移至線粒體,與線粒體膜結合并改變構型,形成活性復合物,引起線粒體通透性增高,釋放Cytochrome C,啟動Caspase相關的凋亡級聯反應。Bcl-2蛋白可與Bax形成異源二聚體,阻斷Cytochrome C的釋放,從而中和Bax誘導的細胞凋亡作用[13]。本研究結果表明,與Sham組相比,IR組和DEX組神經細胞凋亡率升高,腦組織Bcl-2、Bax、Caspase-3、Cytochrome C表達上調;與IR組相比,DEX組神經細胞凋亡率降低,Bcl-2表達上調,Bax、Caspase-3、Cytochrome C表達下調。表明右美托咪定可上調Bcl-2表達,下調Bax表達,減少線粒體Cytochrome C釋放和Caspase-3活化,抑制神經元凋亡,從而發揮腦保護作用。
[1] Dahmani S, Rouelle D, Gressens P, et al. Characterization of the postconditioning effect of dexmedetomidine in mouse organotypic hippocampal slice cultures exposed to oxygen and glucose deprivation[J]. Anesthesiology, 2010,112(2):373-383.
[2] Dahmani S, Rouelle D, Gressens P, et al. Effects of dexmedetomidine on hippocampal focal adhesion kinase tyrosine phosphorylation in physiologic and ischemic conditions[J]. Anesthesiology, 2005,103(5):969-977.
[3] Engelhard K, Werner C, Eberspcher E, et al. The effect of the alpha-agonist dexmedetomidine and the N-methyl-D-aspartate antagonist S(+)- ketamine on the expression of apoptosis-regulating proteins after incomplete cerebral ischemia and reperfusion in rats[J]. Anesth Analg, 2003,96(2):524-531.
[4] 陳曉梅,陳廣福.右美托咪定對顱內腫瘤手術患者血流動力學的影響及腦保護作用[J].臨床麻醉學雜志,2015,31(1):15-17.
[5] 袁峰,付紅光,孫凱,等.線粒體ATP敏感性鉀通道在右美托咪定減輕大鼠腦缺血再灌注損傷中的作用[J].中華麻醉學雜志,2014,34(4):500-502.
[6] Zea Longa E, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20:84-91.
[7] Mehta SL, Manhas N, Raghubir R. Molecular targets in cerebral ischemia for developing novel therapeutics[J]. Brain Res Rev, 2007,54(1):34-66.
[8] 叢明,羅俊生,霍小川.原花青素對創傷性腦損傷大鼠大腦皮質Bcl-2、Bax蛋白表達的影響[J].山東醫藥,2011,51(22):32-33.
[9] Broughton BR, Reutens DC, Sobey CG. Apoptotic mechanisms after cerebral ischemia[J]. Stroke, 2009,40(5):e331-339.
[10] Nicholson DW, Thornberry NA. Apoptosis life and death decisions[J]. Science, 2003,299(5604):214-215.
[11] Sims NR, Muyderman H. Mitochondria, oxidative metabolism and cell death in stroke[J]. Biochim Biophys Acta, 2010,1802(1):80-91.
[12] Hong SJ, Dawson TM, Dawson VL. Nuclear and mitochondrial conversations in cell death: PARP-1 and AIF signaling[J]. Trends Pharmacol Sci, 2004,25(5):259-264.
[13] Roset R, Ortet L, Gil-Gomez G. Role of Bcl-2 family members on apoptosis: what we have learned from knock-out mice[J]. Front Biosci, 2007,12(12):4722-4730.
10.3969/j.issn.1002-266X.2016.22.013
R743.3
A
1002-266X(2016)22-0039-02
2015-08-16)

