雷米普利對心力衰竭大鼠腎組織細胞凋亡及Bcl-2、Bax表達的影響
徐婧,貝雪艷,張夢云,楊曉歐,周靜,李秀華
(承德醫學院附屬醫院,河北承德067000)
?
雷米普利對心力衰竭大鼠腎組織細胞凋亡及Bcl-2、Bax表達的影響
徐婧,貝雪艷,張夢云,楊曉歐,周靜,李秀華
(承德醫學院附屬醫院,河北承德067000)
目的觀察雷米普利對心力衰竭大鼠腎組織細胞凋亡及Bcl-2、Bax表達的影響,探討雷米普利對心力衰竭大鼠腎臟的保護機制。方法將40只大鼠隨機分為模型組30只和假手術組10只,采用腎上腹主動脈縮窄法制作心力衰竭模型,假手術組僅穿線不結扎。將造模成功的20只大鼠隨機分為模型對照組和雷米普利組各10只,分別給予等量生理鹽水和雷米普利注射,采取HE染色法觀察腎組織細胞形態結構,TUNEL法測定腎組織細胞凋亡指數(AI),免疫組化染色SP法檢測腎組織細胞中Bcl-2及Bax蛋白,RT-PCR方法檢測腎組織中Bcl-2及Bax mRNA。結果與假手術組相比,模型對照組腎小管細胞結構紊亂,管腔擴張,腎組織細胞AI顯著增高,Bcl-2蛋白及mRNA表達降低,Bax蛋白及mRNA表達升高(P均<0.01)。與模型對照組相比,雷米普利組腎小管細胞結構亦出現紊亂,但未見管腔擴張,腎組織細胞AI降低,Bcl-2蛋白及mRNA表達升高,Bax蛋白及mRNA表達降低(P均<0.01)。結論雷米普利能夠抑制心力衰竭大鼠腎組織細胞凋亡,其機制可能與調控Bcl-2、Bax表達有關。
心力衰竭;腎功能損傷;雷米普利;細胞凋亡;Bcl-2;Bax
慢性心力衰竭是大多數心臟疾病的終末期表現,其病死率接近于惡性腫瘤[1]。心力衰竭末期各器官衰竭現象愈來愈嚴重,尤其是心力衰竭引起的腎功能不良,在心力衰竭患者的發生率可達25%~50%,是心力衰竭進展和不良預后的獨立危險因素[2]。雷米普利是一種高效血管緊張素轉化酶抑制劑,是治療心力衰竭的一線用藥。有研究顯示,雷米普利具有非降壓依賴性腎臟保護作用,可減輕不同疾病動物模型的腎損傷[3],但具體機制不明。2014年9月,我們通過觀察雷米普利對心力衰竭大鼠腎組織細胞凋亡及Bcl-2、Bax表達的影響,探討雷米普利對心力衰竭大鼠腎臟的保護機制。
1 材料與方法
1.1材料雄性Wistar大鼠40只,購于北京華阜康生物科技股份有限公司,體質量210~240 g,自由飲水,正常飲食。雷米普利(昆山龍燈瑞迪制藥有限公司),TUNEL檢測試劑盒(美國羅氏公司),免疫組化試劑盒(北京四正柏生物技術有限公司),逆轉錄聚合酶鏈反應試劑盒(大連寶生物工程有限公司),BCA蛋白定量試劑盒(北京索萊寶科技有限公司)。
1.2動物分組及處理采取腎上動脈縮窄術建立心力衰竭模型。隨機取30只大鼠(模型組),于左腎動脈下方0.5 cm處游離腹主動脈,將去尖7號針頭與游離的腹主動脈并行后,用粗絲線結扎阻斷血流,迅速抽出針頭見遠端動脈充盈后縫合腹腔,術后連續3 d腹腔注射青霉素20萬U。其余10只大鼠(假手術組)僅穿線不結扎。以左心室舒張末壓(LVEDP)≥15 mmHg為模型制作成功。造模成功的20只大鼠隨機分為模型對照組和雷米普利組各10只。雷米普利組給予雷米普利1 mg/(kg·d)灌胃,模型對照組及假手術組給予等量生理鹽水灌胃,連續4周。
1.3標本采集于末次給藥12 h后取大鼠腎臟,冰鹽水沖洗,分為兩份,一份置于4%甲醛固定,乙醇脫水,二甲苯透明,石蠟包埋,用于光鏡、免疫組化、TUNEL熒光化學染色;另一份于低溫冷凍冰箱保存用于PCR實驗。
1.4腎組織病理檢查采用HE染色。石蠟切片常規脫蠟、水化,蘇木素染色,0.5%氨水返藍,加入伊紅染色,梯度乙醇脫水,二甲苯透明,中性樹膠封片。于光鏡下觀察,隨機選擇3個視野進行拍照。
1.5腎組織細胞凋亡檢測采用TUNEL法。石蠟切片常規脫蠟至水,加入過氧化氫甲醇液浸泡30 min,PBS清洗,加復合酶,37 ℃孵育20 min,加綠色熒光標記液,37 ℃靜置1 h,PBS清洗,加入轉化劑POD,37 ℃孵育30 min。DAB顯色,蘇木素復染,脫水透明封片,熒光顯微鏡觀察細胞凋亡情況。以細胞核呈綠色為陽性,每個標本取10張切片觀察,各切片隨機取鏡下5個視野,計算凋亡指數(AI),AI=(凋亡細胞數/總細胞數)×100%。
1.6腎組織Bcl-2、Bax蛋白檢測采用免疫組化SP法。制備5 μm左腎組織切片,常規脫蠟至水,PBS沖洗,3% H2O2室溫孵育30 min,微波加熱進行抗原修復,滴加封閉血清,20 min后棄血清,加入一抗4 ℃過夜,PBS沖洗,依次加入生物素化二抗、辣根過氧化物酶標記的鏈霉卵白素復合物,DAB顯色,蘇木素復染,梯度乙醇和二甲苯脫水透明,中性樹膠封片。使用免疫組化染色分析軟件(HPIAS-1000)進行半定量分析,計算平均陽性表達率。
1.7腎組織Bcl-2、Bax mRNA檢測采用RT-PCR法。取腎組織標本,用TRIzol試劑提取總RNA。逆轉錄合成cDNA。Bcl-2上游引物5′-GACGAGAAGT-GCTATTGGT -3′,下游引物5′- TCAGGCTGGAAGGAGAAGAT-3′,擴增片段205 bp;Bax,上游引物5′-ATGTCTGGTTTGGAGAGAGCA-3′,下游引物5′-CAAAGTAGAAGAGGGCAACCAC-3′,擴增片段263 bp;β-actin上游引物5′-GAGAGGGAAATCGTGCGTGAC-3′;下游引物5′-CATCTGCTGGAAGGTGGACA-3′,擴增片段452 bp。退火溫度依次為57、55、57 ℃。RT-PCR產物于溴化己錠2%瓊脂糖凝膠電泳,凝膠成像系統分析。目的基因的相對表達量以目的基因與β-actin的RT-PCR產物電泳帶的灰度比值表示。
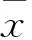
2 結果
2.1各組一般情況假手術組、雷米普利組術后4周均存活,一般情況尚可;模型對照組術后4周出現不同程度呼吸困難、進食和活動量減少。
2.2各組腎組織病理變化假手術組腎臟無明顯病理改變;模型對照組腎小管結構紊亂,上皮細胞排列疏松、模糊,管腔擴張;雷米普利組腎小管結構亦出現紊亂,上皮細胞排列疏松、模糊,但未見管腔擴張。
2.3各組腎組織細胞AI比較凋亡細胞主要見于腎小管。假手術組、模型對照組、雷米普利組細胞AI分別為2.51%±0.97%、40.79%±1.31%、19.89%±1.24%,模型對照組和雷米普利組均高于假手術組,雷米普利組較模型對照組減少(P均<0.01)。
2.4各組腎組織Bcl-2、Bax蛋白及mRNA表達比較見表1。

表1 各組腎組織Bcl-2、Bax蛋白及mRNA表達比較
注:與假手術組比較,*P<0.01;與模型對照組比較,#P<0.01。
3 討論
細胞凋亡是指由體內外因素觸發細胞內預存的死亡程序而導致的細胞死亡過程[4],其發生不僅與神經內分泌因子和凋亡途徑有關,還與凋亡相關基因和蛋白的表達有關[5]。細胞凋亡的主要途徑是由線粒體介導的[6],這一途徑的調控依賴于Bcl-2家族成員。Bcl-2和Bax同屬Bcl-2蛋白家族,是最具代表性的抑制凋亡和促進凋亡的基因。當各種凋亡因子作用于線粒體時,Bcl-2表達減少,Bax表達增多,二者比例發生改變,使線粒體膜通透性增強,促進細胞Cyt-C的釋放,進而激活Caspase級聯反應,導致細胞凋亡[7~9]。
既往實驗證實,血管緊張素(Ang)Ⅱ是導致心、腎、肺及其他器官細胞凋亡的一個誘導劑[10,11]。AngⅡ與其受體結合后,通過Gqa調節蛋白激活磷脂酶C,加速細胞膜中的三磷酸肌醇(Ip3)和甘油二酯(DAG)合成;Ip3刺激Ca2+從肌漿網釋放;DAG使蛋白激酶C同功異構體ε從細胞質轉位至細胞膜上L型Ca2+通道,導致Ca2+內流,從而引起胞質線粒體內Ca2+增多,影響線粒體通透性轉換孔的開閉,破壞線粒體膜的穩定性,同時激活Ca2+依賴的DNA酶系,使DNA斷裂,影響能量代謝,進而影響線粒體結構與功能,促發凋亡[12,13]。雷米普利是第三代長效血管緊張素轉化酶(ACE)抑制劑,具有對腎臟和血管ACE的親和力高、半衰期長和同時通過肝臟和腎臟代謝排泄等優點[14]。雷米普利具有獨特的戊烷結構,脂溶性高,能與心、腎、血管組織中的ACE的兩個活性位點同時結合,抑制血管緊張素轉換酶,從而抑制AngⅠ向AngⅡ轉化,發揮拮抗AngⅡ的作用并穩定線粒體膜電位,阻斷線粒體凋亡途徑,抑制細胞凋亡的進展[15]。
本研究顯示,與假手術組相比,模型對照組腎小管細胞結構紊亂,管腔擴張,腎組織細胞AI顯著增高,Bcl-2表達明顯降低而Bax表達顯著升高;與模型對照組相比,雷米普利組腎小管細胞結構亦出現紊亂,但未見管腔擴張,AI顯著減少,Bcl-2表達有所提高,Bax表達則顯著減少。提示雷米普利可以改善心力衰竭大鼠的腎功能,抑制腎組織細胞凋亡,提高心力衰竭大鼠腎組織細胞Bcl-2蛋白及mRNA表達,同時下調Bax蛋白及mRNA表達。表明雷米普利具有抑制心力衰竭大鼠腎組織細胞凋亡的作用,其機制可能與減少AngⅡ生成,促進Bcl-2釋放,下調Bax表達有關。
[1] 張迪,李斌,馬淑梅.慢性心功能不全患者合并腎功能不全的高危因素分析[J].中國醫科大學學報,2015,44(8):725-729.
[2] 陳康玉,嚴激,徐健,等.腎功能對心臟再同步治療的影響[J].中華心律失常學雜志,2014,18(4):280-282.
[3] Mercier K, Smith H, Biederman J. Renin-angiotensin-aldosterone system inhibition:overview of the therapeutic use of angiotensin converting enzyme inhibitors, angiotensin receptor blockers, mineralocorticoid receptor antagonists, and direct renin inhibitors[J]. Prim Care, 2014,41(4):765-778.
[4] 熊周怡,張樺,楊力,等.高級氧化蛋白產物對大鼠胰島微血管內皮細胞凋亡的影響及機制研究[J].中國糖尿病雜志,2015,23(8):751-755.
[5] Re RN. A possible mechanism for the progression of chronic renal disease and congestive heart failure[J]. J Am Soc Hypertens, 2015,9(1):54-63.
[6] 管麗娜,巴茂文,冀永強,等.垂體腺苷酸環化酶激活肽拮抗lactacystin細胞毒性作用的機制研究[J].中華老年心腦血管病雜志,2015,17(4):421-424.
[7] 呂帥國,董鐵立,張清勇,等.帕瑞昔布鈉預先給藥對大鼠肺缺血再灌注損傷時細胞凋亡的影響[J].中華實驗外科雜志,2015,32(6):1368-1370.
[8] Katsetos CD, Anni H, Drber P. Mitochondrial dysfunction in gliomas[J].Semin Pediatr Neurol, 2013,20(3):216-227.
[9] Hetschko H, Voss V, Horn S, et al. Pharmacological inhibition of bcl-2 family members reactivates TRAIL-induced apoptosis in malignant gliomaf[J]. J Neurooncol, 2008,86(3):265-272.
[10] Bosman FT, Stamenkovic I. Functional structure and composition of the extracellular matrix[J]. J Pathol, 2003,200(4):423-431.
[11] Mori J, Zhang L, Oudit GY, et al. Impact of the renin-angiotensin system on cardiac energy metabolism in heart failure[J]. J Mol Cell Cardiol, 2013,63(10):98-106.
[12] 王詩才,陳太軍,黃美松,等.丹參酮ⅡA對自發性高血壓大鼠左心室心肌肥厚及心肌細胞凋亡的影響[J].中國循環雜志,2015,30(7):694-698.
[13] 劉以鵬,梁偉,陳星華,等.IQGAPl在血管緊張素Ⅱ誘導足細胞凋亡中的作用及其機制探討[J].中華腎臟病雜志,2014,30(3):210-216.
[14] 王茵,張燕林.雷米普利治療老年2型糖尿病腎病患者尿蛋白的療效觀察[J].中華老年醫學雜志,2015,34(11):1204-1206.
[15] Liu Z, Vogel HJ. Structural basis for the regulation of L-type voltage-gated calcium channels;interactions between the N-terminal cytoplasmic domain and Ca2+calmodulin[J]. Front Mol Neurosci, 2012,5:38.
Effects of ramipril on renal cell apoptosis and Bcl-2, Bax expression in rats with heart failure
XUJing,BEIXueyan,ZHANGMengyun,YANGXiaoou,ZHOUJing,LIXiuhua
(AffiliatedHospitalofChengdeMedicalCollege,Chengde067000,China)
ObjectiveTo observe the effects of ramipril on renal cell apoptosis and Bcl-2, Bax expression in experimental rats with heart failure (HF), and to explore the protective mechanism of ramipril. MethodsForty Wistar rats were randomly divided into two groups: the model group (n=30) and sham operation group (n=10). HF rat models were established with suprarenal aortic constriction and the successful 20 models were divided into the HF model group (n=10) and ramipril intervention group (n=10) which were respectively injected with the same amount of normal saline and ramipril. In each group, the morphology of myocardium was observed by HE staining, the renal tubular cell apoptotic index (AI) was examined by TUNEL method, the protein and mRNA expression levels of Bcl-2 and Bax were detected by immunohistochemistry and RT-PCR, respectively.ResultsCompared with the sham operation group, the renal tubular cell structure was in disorder and the tube cavity expanded, AI of kidney tissues was increased significantly, the expression of Bcl-2 was down-regulated and the expression of Bax was up-regulated in the HF model group (allP<0.01). Compared with the HF model group, the renal tubular cell structure was also in disorder but the tube cavity did not expand, AI of kidney tissues was decreased significantly, the expression of Bcl-2 was up-regulated and the expression of Bax was down-regulated in the ramipril intervention group (allP<0.01). ConclusionRamipril can inhibit the apoptosis of kidney tissues in HF rats, which might be related to the regulation of Bcl-2 and Bax expression.
heart failure; kidney injury; ramipril; apoptosis; Bcl-2; Bax
河北省衛生計生委資助項目(20110180)。
徐婧(1991-),女,碩士研究生,主要研究方向為慢性心力衰竭的病理生理。E-mail: 18231490403@163.com
簡介:李秀華(1967-),女,博士,副主任醫師,碩士生導師,主要研究方向為老年心血管病、老年心力衰竭的診治及病理生理。E-mail: lixiuhua76@126.com
10.3969/j.issn.1002-266X.2016.22.002
R541.6
A
1002-266X(2016)22-0005-03
2016-01-21)

