談探究氫氧化鈉性質實驗的五個誤區
摘要:以案例形式剖析了探究氫氧化鈉性質實驗中存在的認識誤區,指出了問題所在,提出了相關的建議和改進措施,避免在初中化學教學中步入實驗誤區。倡導重視實驗設計的科學性和嚴密性,幫助學生通過實驗獲得知識、理解知識和鞏固知識。
關鍵詞:氫氧化鈉;性質實驗;實驗誤區;實驗探究;實驗教學
文章編號:1005–6629(2016)7–0062–03 中圖分類號:G633.8 文獻標識碼:B
氫氧化鈉是初中化學學習的一種重要物質,是堿類物質的典型代表物之一。氫氧化鈉溶于水放出熱量、氫氧化鈉溶液顯堿性、氫氧化鈉能與二氧化碳反應、氫氧化鈉與酸發生中和反應等都是氫氧化鈉的重要性質,也是課堂教學的重點。筆者在聽課調研中發現,有些教師在設計實驗方案探究氫氧化鈉的上述性質時,存在原理不正確、方案不科學、結論欠精準等種種問題,步入了實驗探究的誤區,導致學生對知識的理解產生了偏差。現將相關探究案例整理并分析如下,供同行們參考,以期得到指正。
1 探究氫氧化鈉溶于水的熱效應
“氫氧化鈉是白色固體,易溶于水,溶解時放出熱量”。這是教材對氫氧化鈉物理性質的簡單描述。
為了驗證固體氫氧化鈉溶于水放出熱量這一事實,教師沒有利用傳統的“用溫度計測量固體物質溶于水前后的溫度變化”這一實驗方案,而是創新性地設計了如下趣味實驗方案:
向試管內倒入5mL水,先在酒精燈外焰上進行預熱,再集中加熱,直至試管內的水沸騰;移開試管,試管內的水停止沸騰,向剛沸騰過的水中加入些許固體氫氧化鈉,觀察到試管內的水重新沸騰了起來。
學生興致勃勃地觀察、饒有興致地討論,臉上帶著驚喜。經過一番議論之后,教師最終給出了結論:水的重新沸騰是固體氫氧化鈉溶于水時放出了熱量所致。由于學生親眼目睹了實驗現象,便心悅誠服地接受了教師給出的結論。
“水的再次沸騰”果真如教師所說是氫氧化鈉溶解放熱所致嗎?帶著疑問,筆者進行了如下三個實驗:取三支試管,分別向試管內倒入5mL蒸餾水,先在酒精燈外焰上進行預熱,再集中加熱,直至試管內的水沸騰;移開試管,向剛沸騰過的熱水中分別加入少許氯化鈉、硝酸銨、碎瓷片,均觀察到試管內的水重新沸騰起來[1]。
眾所周之,碎瓷片不溶于水;氯化鈉溶于水時,溶液溫度不會有明顯變化,固體硝酸銨溶于水時吸收熱量,溶液溫度應該降低,但把這三種物質分別加入剛沸騰過的水中時,都觀察到水重新沸騰了起來。顯然,“水的重新沸騰是由固體氫氧化鈉溶于水時放出熱量所致”的說法有所欠缺、站不住腳。因此教師設計的實驗方案是不科學的、不可取的。
事實上,給蒸餾水加熱時,由于液體里缺乏形成氣泡的核心,容易導致形成過熱液體,過熱液體是亞穩定狀態。當向過熱液體中加入固體時,會侵入氣泡,提供了氣化中心,所以會看見水重新沸騰起來。
2 探究氫氧化鈉溶液與指示劑作用
氫氧化鈉是一種可溶性堿,它的水溶液能與酸堿指示劑作用,使無色酚酞變紅色。驗證氫氧化鈉溶液顯堿性時,一位教師向試管內倒入少量氫氧化鈉溶液,并滴入幾滴酚酞,學生觀察到試管里的液體瞬間由無色變為紅色,但稍一振蕩,紅色徹底消失。學生觀察到的現象與課本中描述的現象截然不同,于是該教師趕忙又連續滴入了幾滴酚酞,最終觀察到溶液還是無色,為了結束這一“尷尬”局面,便勉強向學生解釋:實驗中所用的氫氧化鈉變質了,導致實驗現象產生了意外。
溶液最終呈現無色,果真是由于氫氧化鈉變質所致嗎?其實,氫氧化鈉變質后往往變成碳酸鈉,碳酸鈉溶液顯堿性,同樣可以使酚酞變紅色。溶液剛上來顯示紅色,說明酚酞并未變質,產生意外現象的主要因素是該教師選用的氫氧化鈉溶液濃度偏大[2]。事實上,使酚酞變紅的堿溶液pH范圍是8.2~10.0,當遇到較濃的堿溶液,酚酞的結構發生改變,因此看不到紅色出現[3]。課后用pH試紙測得所用氫氧化鈉溶液的pH是13,果然不在酚酞變紅范圍內。
3 探究氫氧化鈉與二氧化碳的反應
氫氧化鈉能夠跟酸性氧化物(如二氧化碳、二氧化硫等)發生反應生成鹽和水。為了探究NaOH溶液與CO2之間是否發生反應,教師演示了如下實驗:向一個盛滿二氧化碳氣體的礦泉水瓶里加入少量氫氧化鈉溶液,立即蓋緊瓶塞,振蕩,觀察到礦泉水瓶變癟,由此得出“NaOH溶液與CO2能夠發生反應”這一結論。
教師明白這一結論是不確切的。實驗中礦泉水瓶變癟,不足以證明二氧化碳和氫氧化鈉溶液發生了化學反應,因為二氧化碳溶解在水中也能產生類似的現象。
為了便于對比,教師又補充了一個對比實驗:另取一個礦泉水瓶,倒入少量水,振蕩,通過比較兩個礦泉水瓶變癟的程度不同,重新得出“NaOH溶液與CO2能夠發生反應”這一結論。
事實上,該教師設計的對比實驗是不完美的,是存在缺憾的。原因在于,他并沒有進行變量控制,要充分證明氫氧化鈉與二氧化碳之間確實發生了反應,對比實驗中所使用的礦泉水瓶的材質、形狀大小要相同,倒入水的體積理應與氫氧化鈉溶液的體積相同。但教師恰好忽略了這一點,因此設計的對比實驗方案有瑕疵,無法證明所得結論的真實性。
為證實可溶性堿與二氧化碳之間確實發生化學反應,筆者設計了以下實驗:
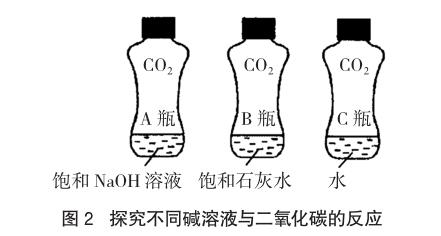
取三個同材質、大小形狀相同的均充滿二氧化碳氣體的軟礦泉水瓶,分別向其中倒入等體積的飽和氫氧化鈉溶液、飽和石灰水及水,加蓋振蕩同樣次數,比較三者變癟的程度,可以明顯觀察到A瓶變癟程度最大,B瓶次之,C瓶變癟程度最小。該實驗不僅證明二氧化碳能夠與堿溶液發生反應,還能夠比較氫氧化鈉、氫氧化鈣與二氧化碳反應程度的不同,是由于二者的溶解能力不同所致。由此提示我們,檢驗二氧化碳氣體時用澄清石灰水,除去二氧化碳時選擇氫氧化鈉溶液,這樣的實驗設計可謂一舉多得,效果更好。
4 探究中和反應的熱效應
酸與堿之間能夠發生中和反應,為驗證氫氧化鈉與鹽酸之間發生中和反應并放出熱量,教師設計了以下實驗方案:
室溫下,取10份相同體積質量分數均為10%的NaOH溶液于10支試管中,分別滴加一定體積10%鹽酸,并測定溶液溫度的最高值,數據記錄如下: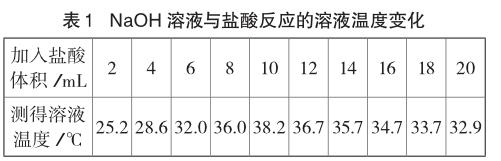
表中數據表明:加入鹽酸的量在2~10mL之間時溶液的溫度逐漸升高,說明中和反應放出熱量;當加入鹽酸的體積在12~20mL之間,溶液溫度逐漸降低。對此,有教師僅解釋為中和反應停止,不再放出熱量,熱量散失,導致溶液溫度降低。
表中數據告訴我們:當滴加稀鹽酸的體積達到10mL時,溫度最高,說明此時是氫氧化鈉溶液和鹽酸恰好完全反應,當反應結束不再放出熱量,隨著稀鹽酸的繼續加入,鹽酸不斷吸收溶液的熱量,導致溶液的溫度逐漸降低,過量鹽酸起到冷卻的作用,才是使溶液的溫度明顯降低。
5 探究氫氧化鈉的變質
氫氧化鈉暴露于空氣中會與空氣中的二氧化碳發生反應而變質,為驗證久置于空氣中的NaOH固體是否變質,某教師設計了如下實驗方案:
取少量固體于試管中,加適量水充分溶解,向試管中滴加幾滴稀鹽酸,沒有觀察到氣泡產生,于是得出結論:該氫氧化鈉固體沒有變質。
實驗中的固體氫氧化鈉一定沒有變質嗎?
其實,酸、堿、鹽之間發生的反應一般是復分解反應,在復分解反應中,酸堿中和反應優先反應,也就是說,當向氫氧化鈉和碳酸鈉的混合液中滴入稀鹽酸時,首先發生中和反應:NaOH+HCl= NaCl+H2O,然后發生反應:Na2CO3+HCl=NaHCO3+NaCl,最后發生反應:NaHCO3+HCl=NaCl+H2O+CO2↑。在上述實驗方案中,雖然鹽酸與氫氧化鈉、碳酸鈉都能發生反應,但是鹽酸與氫氧化鈉之間的中和反應優先發生,待反應完成之后,鹽酸再與碳酸鈉發生反應,先生成碳酸氫鈉,生成的碳酸氫鈉再與鹽酸發生反應才產生二氧化碳氣體。因此剛上來沒有看到氣泡產生,并不能說明固體中一定不含碳酸鈉,還可能是由于鹽酸用量較少所致[4]。若教師使用足量的稀鹽酸進行探究,實驗方案就嚴密了,說服力就更強了。
科學探究是學習化學的重要而有效的方式,化學實驗是進行科學探究的重要途徑,只有設計科學、規范、合理的實驗,才能真正增強學生的實證意識,引導學生養成嚴謹、求實的科學態度,達到理解知識、獲得知識、鞏固知識之目的。
參考文獻:
[1]張偉,李路路.對一則實驗改進的探討[J].中學化學教學參考,2013,(11):72.
[2]張賢金,汪肖楠.三種物質使變紅酚酞褪色機理的再探討[J].化學教學,2009,(4):73~75.
[3]呂秀麗.過氧化鈉與水反應過程中酚酞褪色的新釋疑[J].化學教學,2005,(3):7~8.
[4]王榮橋.淺析對氫氧化鈉變質問題的處理[J].中學化學教學參考,2012,(6):54.

