差熱分析裝置改進及在物理化學實驗教學中的應用
許新華, 吳梅芬, 肖寒霜, 王曉崗
(同濟大學 化學系, 上海 200092)
?
差熱分析裝置改進及在物理化學實驗教學中的應用
許新華, 吳梅芬, 肖寒霜, 王曉崗
(同濟大學 化學系, 上海200092)
介紹了用簡單材料制作風冷系統,并將其用于改造實驗教學用的差熱分析儀。測試表明,采用風冷系統后可以大大提高差熱分析儀電爐的降溫速率,在常規實驗條件下,一般15 min內可以將加熱后的爐體溫度降低到40 ℃以下,顯著減少了實驗中的無效等待時間,為在基礎物理化學實驗課程中開展綜合性的差熱分析實驗項目創造了條件。用改造后的差熱分析儀測定了KNO3-NaNO3二元熔鹽體系的液固平衡相圖,該熔鹽組份在加熱過程中經歷固態晶相轉變和固-液相轉化,且轉變溫度隨熔鹽組成連續變化,與傳統的簡單二元體系相圖有很大差別。采用改造后的差熱分析儀可以在常規實驗課時內較完整地測得該復雜體系相圖,實驗教學效果良好。
差熱分析; 物理化學實驗; 二元熔鹽體系; 相圖
差熱分析技術是現代熱分析的主流實驗技術,在材料科學、物理學、化學及生命科學等領域有廣泛的應用。差熱分析實驗是物理化學實驗教學中的經典實驗項目,通常以CuSO4·5H2O的脫水過程為研究對象[1-3],也有將差熱分析應用于CaC2O4·2H2O脫水及分解反應[4]、鉛-錫合金相圖測定[5-6]、CaC2O4·H2O脫水反應動力學[6]以及層狀材料熱穩定性測量[7]等實驗教學的研究。但是,差熱分析實驗教學的一個主要問題就是單次測量耗時較長,尤其是線性升溫后,儀器降溫過程的無效實驗時間過長,導致無法在有限的實驗教學課時內完成多批次測定,因此差熱分析法的一些重要應用性實驗項目,如相圖測定或者熱動力學分析等,往往無法在4課時內完成,甚至8課時完成也非常困難。差熱分析儀屬于比較昂貴的基礎物理化學實驗儀器,如果只能在實驗教學中進行簡單的定性觀察和測量,顯然是極大的浪費。有鑒于此,我們從商品化的教學型差熱分析儀改造入手,通過添加簡單附件,有效加快了儀器的降溫速率,縮短了無效實驗時間,并在經過改造的儀器上進行二元熔鹽KNO3-NaNO3體系復雜相圖的測定實驗,取得良好的教學效果。
1 教學型差熱分析儀的改造
教學型差熱分析儀采用南京桑力電子設備廠的ZCR差熱實驗裝置(見圖1),該型差熱分析儀控溫范圍為室溫~1 100 ℃、升溫速率1~20 ℃/min、DTA分析儀的分辨率為1V、量程為2 000V[8],能滿足基礎實驗教學的要求。
為提高爐體的冷卻速率,在儀器上加裝一個風冷系統,使用微型無電刷直流風扇NMB 3100KL-04 W(80 mm×80 mm×25 mm),風扇固定在用工程塑料加工的圓環外罩上,由按鈕開關控制風扇啟動,由差熱實驗裝置的控溫儀提供12 V、0.15 A直流電。差熱曲線測量完成后,取下加熱爐頂蓋及隔熱蓋片,將加熱爐提升后,把風冷系統密貼放置在加熱爐保護網罩頂端的定型卡環上(見圖2),風扇產生的軸流冷風自上而下同時吹過加熱爐體的爐膛內外,產生很好的冷卻效果。

圖1 ZCR差熱實驗裝置加熱爐體及冷卻風扇附件
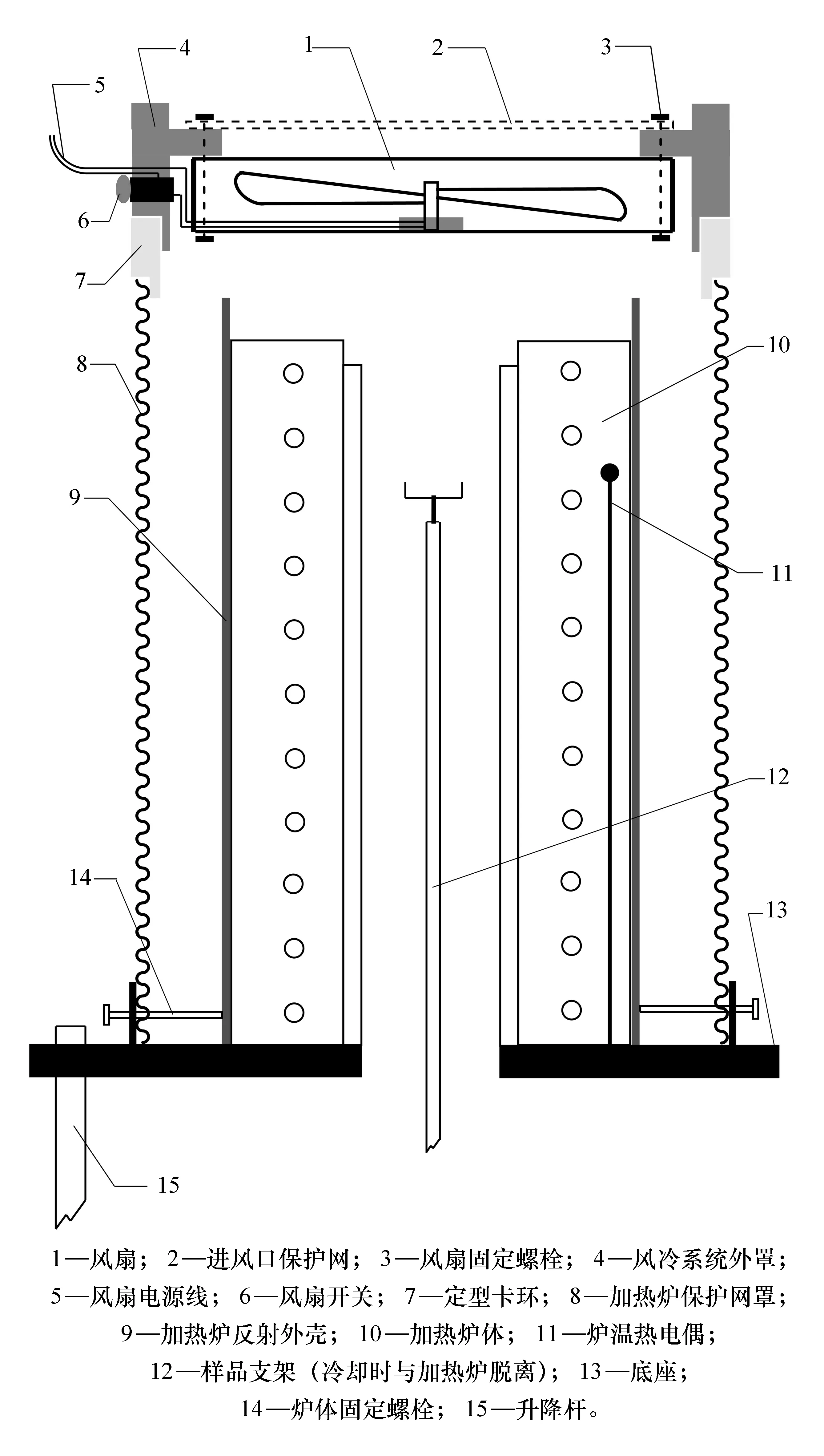
圖2 風冷系統與差熱加熱爐裝配結構圖
ZCR差熱實驗裝置的加熱爐在自然冷卻狀態和風冷狀態下的降溫曲線見圖3,可以看出加裝風冷系統后,差熱裝置的加熱爐能夠在30 min以內自350 ℃降溫至40 ℃以下,比較合理;而在自然冷卻狀態下,同樣的降溫過程耗時超過90 min,相當于2個實驗課時的時間。換句話說,如果沒有風冷系統,一個常規的4課時實驗,除去實驗指導時間和加熱爐降溫時間后,剩下的真正進行差熱曲線測量的時間內只能完成1次差熱曲線的測量,即使8課時實驗也只能最多完成3次差熱曲線的測量,要在有限的實驗課時內完成諸如熱動力學分析或者相圖測定等綜合性實驗內容幾乎是不可能的。
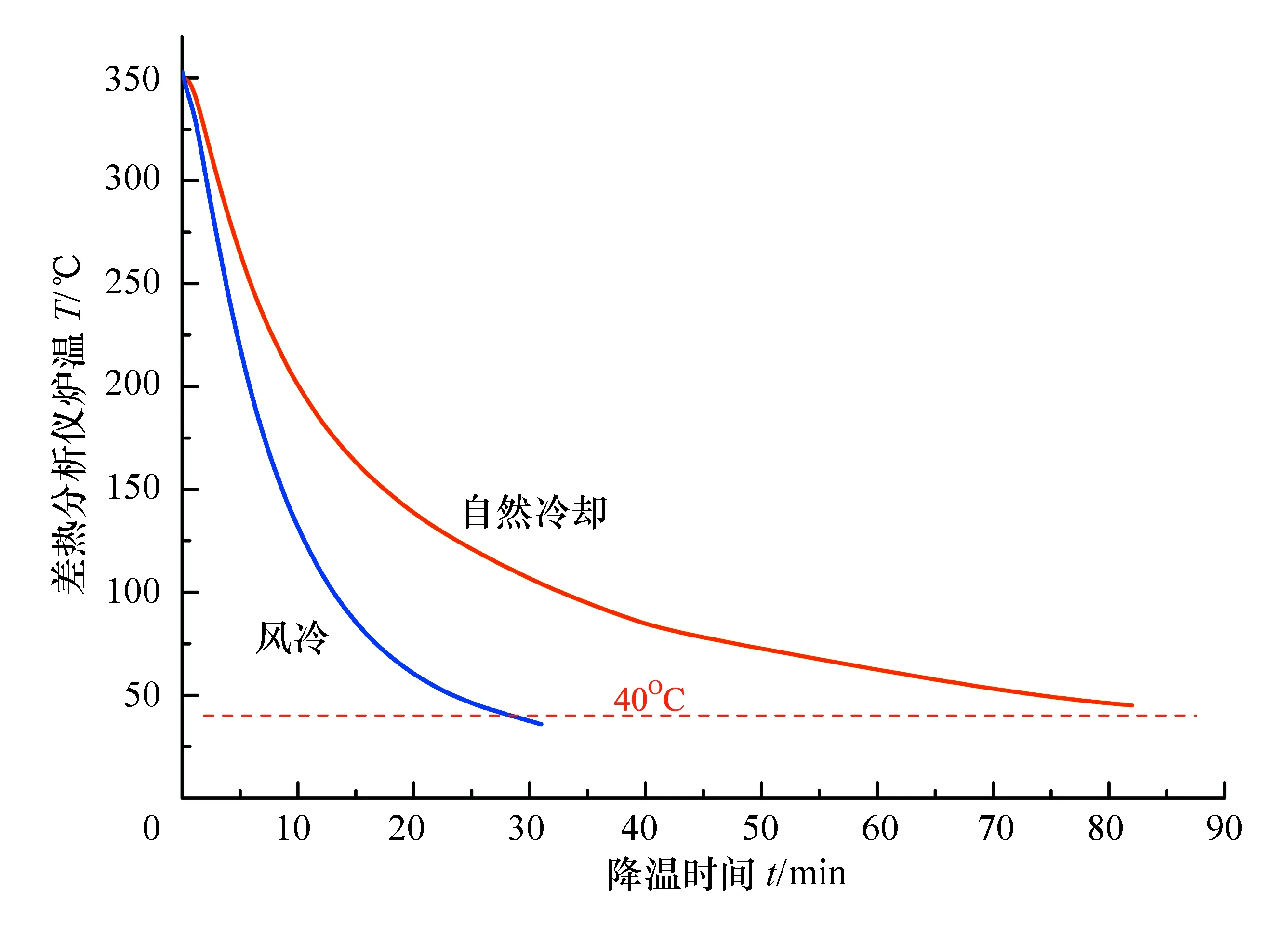
圖3 自然冷卻與風冷的降溫曲線對比
在基礎物理化學實驗課程中,差熱分析的實驗溫度一般低于350 ℃,由于加熱爐外殼采用反射材料,樣品托盤所在的爐膛中心溫度往往高于爐體溫度,兩者相差約100 ℃。在風冷條件下,加熱爐自250 ℃左右冷卻至40 ℃以下所需時間大約20 min以內,因此完成一次差熱分析測試的周期約為50 min,這就為在有限的實驗課時內進行多次測量創造了條件。
2 KNO3-NaNO3熔鹽體系復雜相圖的差熱分析測定
2.1實驗簡介
KNO3-NaNO3二元熔鹽體系是一個涉及固相晶型轉變的液固平衡體系,相圖[9]見圖4,其中A區為熔融液態單相區,B區為液固平衡二相區,C區為Na,K//NO3三方晶系固體單相區,D區為固溶體+Na,K//NO3三方晶系固體二相區,E區為固體NaNO3+ Na,K//NO3三方晶系固體二相區,F區為NaNO3溶于KNO3中形成的固溶體單相區,G區為固溶體+NaNO3固體二相區。純凈的KNO3和NaNO3分別在130 ℃和277 ℃發生由斜方晶系向三方晶系的轉變。形成二元熔鹽體系后,其晶系轉變溫度降低至109 ℃附近,隨后的升溫過程伴隨有復雜的固相轉變融合過程,在223 ℃以上開始部分熔融,直至達到液線溫度。
熔融鹽是非常優良的儲熱材料,采用熔鹽作為光熱發電的傳熱和儲熱工質,可顯著提高光熱發電系統的熱效率、系統的可靠性和經濟性,幫助光熱發電站實現持續穩定運行[10-12]。光熱發電領域目前經商業化應用驗證的成熟熔鹽產品的成分組成為60%NaNO3和40%的KNO3二元混合熔鹽,它利用相變材料在相變過程中吸收(釋放)大量熱量而實現能量轉換,能將太陽輻射能存儲起來,在需要能量時再將其釋放,從而解決了太陽能間歇性、波動性的特點。大多數硝酸鹽的熔點在300 ℃左右,其突出的優點是價格低、腐蝕性小及在500 ℃以下不會分解。與其他熔鹽(如碳酸鹽、氯化鹽、氟化鹽)相比,硝酸鹽具有很大的優勢。
測定KNO3-NaNO3二元熔鹽體系的液-固平衡相圖,對于理解涉及固-固、液-固相間轉化的規律,以及判斷熔鹽體系作為儲熱材料的使用條件,都有重要的意義。
2.2儀器與試劑
試劑:KNO3(A.R.),NaNO3(A.R.),-Al2O3粉末。
儀器:ZCR-III型差熱分析儀,φ5 mm×4 mm鋁坩堝。
2.3相圖測定方法和實驗組織
2.3.1樣品制備
將KNO3和NaNO3在105 ℃干燥4 h,然后置于干燥器中冷卻待用;按組成配比稱取適量的KNO3和NaNO3混合物,總質量約10 g,研磨攪拌均勻后置于具塞玻璃試管中,10 ℃/min程序升溫至380 ℃,保溫30 min,并用細玻璃棒不時攪拌;以5 ℃/min的降溫速率冷卻至100 ℃左右,再將樣品試管置于干燥器中冷卻至室溫;將KNO3-NaNO3熔融體機械粉碎,在瑪瑙研缽中研磨,過80~120目篩,所得熔鹽粉末裝入密封試劑瓶中,置于干燥器中保存。共制得20個不同組成的熔鹽樣品,另加2個純組分。樣品制備工作在實驗前預先完成。
2.3.2KNO3-NaNO3熔鹽材料的差熱分析(DTA)曲線測定
2.3.3實驗組織
對于8課時實驗,可安排2套差熱實驗裝置合作共同測定一套完整相圖實驗數據,學生可選擇約15個不同組成的樣品,測量其DTA曲線。對于4課時實驗,可安排3套差熱實驗裝置合作,測定約10條DTA曲線,雖然實驗點稍稀疏,仍足以勾勒出相圖的輪廓。
2.4結果與討論
不同組成的KNO3-NaNO3二元熔鹽樣品的DTA曲線呈現出多種形態,且峰型各異,部分典型的DTA曲線如圖5所示。可以看出,每條DTA曲線上都有兩類峰,其一位于150 ℃以下,其二位于220 ℃以上,前者對應于硝酸鹽晶體由斜方晶系向三方晶系轉變過程,后者則是固體熔鹽的融化過程,這兩個過程都是吸熱過程。
KNO3-NaNO3二元熔鹽樣品的組成-相轉變溫度關系數據見表1。

圖5 不同組成KNO3-NaNO3熔鹽的DTA曲線(升溫速率10 ℃/min)

硝酸鈉摩爾分數xNaNO3晶相轉變溫度TCT/℃固態轉變溫度T/℃*固線溫度TS/℃液線溫度TL/℃**0.0000126.77/338.71338.710.0186119.12/298.58333.050.0412119.55/271.94324.280.0727117.75/262.31315.520.1387106.66/249.08295.920.2122109.49/220.88277.010.2276108.29/218.48271.850.3340109.07/220.88241.940.3795109.84/221.31233.520.4473111.47/222.09226.730.4983114.31/222.52222.520.5492115.94/220.37227.760.6200108.64/222.09231.890.6632113.88/221.31237.990.7223110.27/222.09254.410.8066113.88/220.11269.360.8767110.7/253.20285.010.8789110.7/265.00284.660.9151105.46/274.47293.080.9496111.47249.71289.30301.940.9807/264.03299.70307.271.0000/277.32309.76309.76
注:*大部分樣品無法確認圖4相圖中C區與D區、C區與E區的分界線溫度;**已經過校正。
在程序升溫測定的差熱曲線上,以各峰前緣的斜率最大點的切線與基線的交點對應的溫度作為過程的始點溫度,分別得到固態熔鹽的晶相轉變溫度TCT和起始熔融溫度(即固線溫度)TS。在程序升溫差熱曲線上確定熔融過程結束時的溫度(即液線溫度)TL的標準不一,有以峰頂溫度為據的,也有以熔融峰后緣上斜率最大點的切線與基線的交點對應的溫度為據的,甚至有以曲線回歸基線點的溫度為據的,其選擇原則根據所用儀器、實驗條件和測量對象不同而有所取舍。本實驗采用經過校正的以熔融峰后緣上斜率最大點的切線與基線的交點對應的溫度作為液線溫度TL。當然,液線溫度的準確測定應以程序降溫測定的DTA曲線上結晶過程的始點溫度為準,但是由于課時和儀器性能的限制,無法在基礎實驗課程中廣泛采用。由各樣品DTA曲線測得的相轉變溫度數據列于表1中,圖6是根據表1數據繪制的相圖。
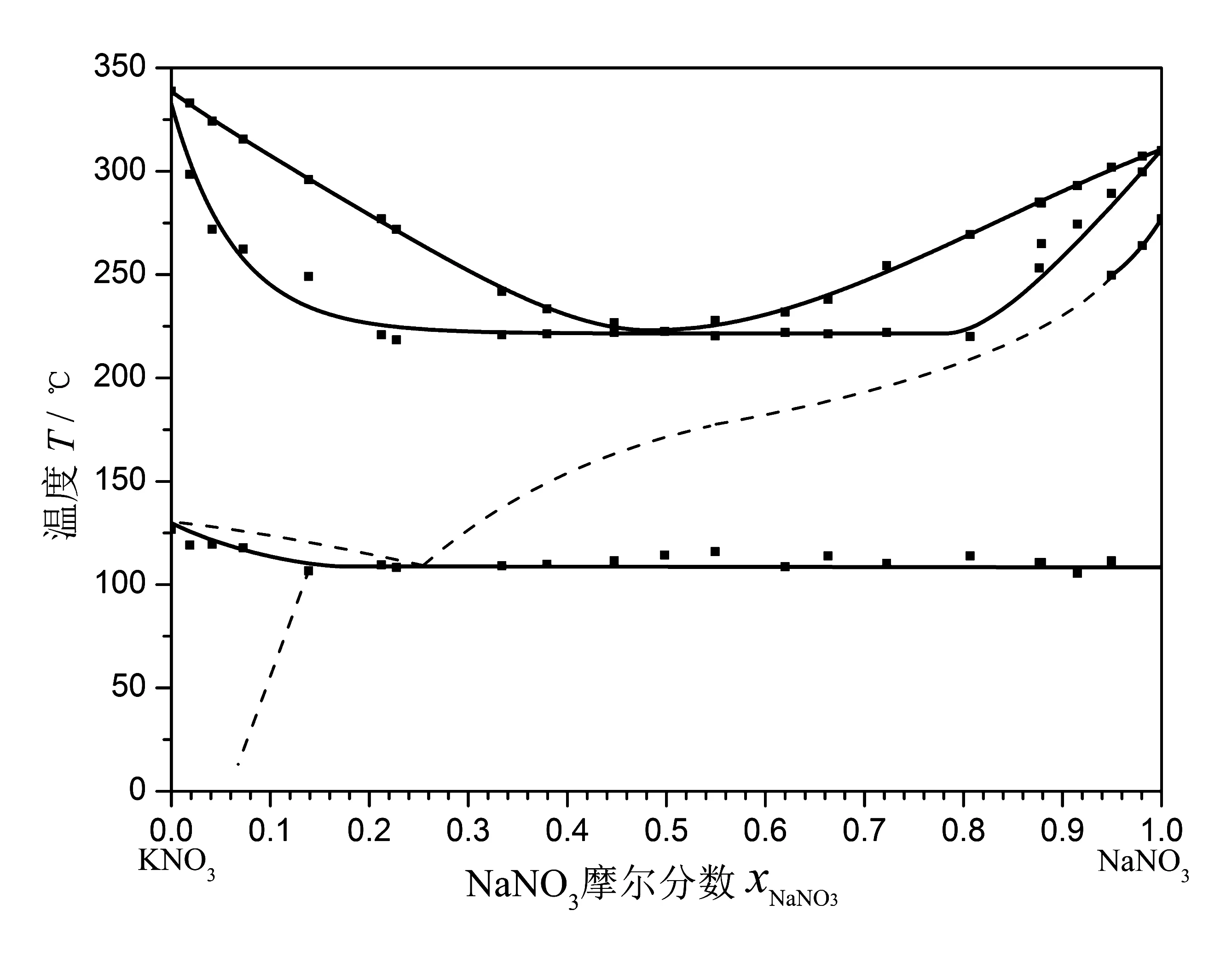
圖6 差熱分析法實驗測定的KNO3—NaNO3二元熔鹽體系液固平衡相圖
從圖6看出,程序升溫差熱分析數據可以較清晰地標示出硝酸鹽熔鹽體系由斜方晶系轉變為三方晶系的溫度,在NaNO3的摩爾分數xNaNO3大于0.13時,該轉變溫度基本穩定,平均值為108.3 ℃,與文獻值(109 ℃)非常接近。熔鹽體系的固-液轉變過程在差熱分析曲線上也能夠較清晰地分辨出來,當xNaNO3在0.20~0.80范圍內,固線近似水平,液線形狀與文獻相圖(見圖4)基本相符。液線與固線在xNaNO3≈0.49處相交,形成最低點,溫度為221 ℃,略低于文獻值的223 ℃。文獻相圖表明,固線溫度自xNaNO3=0.20時的232 ℃,經過最低點xNaNO3=0.49時的223 ℃,在xNaNO3=0.80時達到235 ℃,形成一個明顯的淺弧線;而實驗測得的固線在此組成范圍內形狀更加平直,近似直線,這個結果與差示掃描熱分析(DSC)實驗的結果相似[15]。值得注意的是,除了在靠近NaNO3端的極少部分樣品外,文獻相圖中的C區與D、E區的分界線在DTA曲線上基本無法明確標示,雖然可以在不少實驗曲線上觀察到DTA曲線偏離基線的情況,但是不能確定為固態多晶相混合物轉變為單一晶相的Na,K//NO3三方晶系固體的過程,文獻[15]采用X-射線衍射技術對不同組成的KNO3-NaNO3二元熔鹽樣品進行分析,均僅測得KNO3、NaNO3兩種晶體的特征衍射峰的疊加譜,而沒有得到單一晶相的Na,K//NO3三方晶系固體的特征衍射峰,因此在DTA曲線上無法觀測到連續的固態晶相轉變過程似也合理。
平直的固線往往意味著存在最低共熔點混合物,但是研究表明[15-18]KNO3-NaNO3二元熔鹽體系卻是不存在最低共熔點混合物的,這與經典物理化學實驗中簡單二元液固平衡相圖實驗體系(如鉛-錫合金或錫-鉍合金)有很大區別,這對學生拓寬知識面,全面理解相平衡理論和相圖結構具有重要意義。圖7繪出了xNaNO3=0.20~0.80范圍內220 ℃以上固-液轉化過程的DTA曲線,可以看出隨著樣品組成向xNaNO3=0.49的兩側發生改變,熔融過程的DTA峰位也隨之發生連續變化,且峰型變寬、峰高變低,以液線最低點樣品的峰頂溫度為基準,在其左右兩側樣品的峰頂溫度移動均達到約50 ℃,這與形成低共熔點混合物體系的DTA曲線有明顯差別,后者隨著樣品組成變化只會有峰高的變化,峰型和峰溫基本不變。
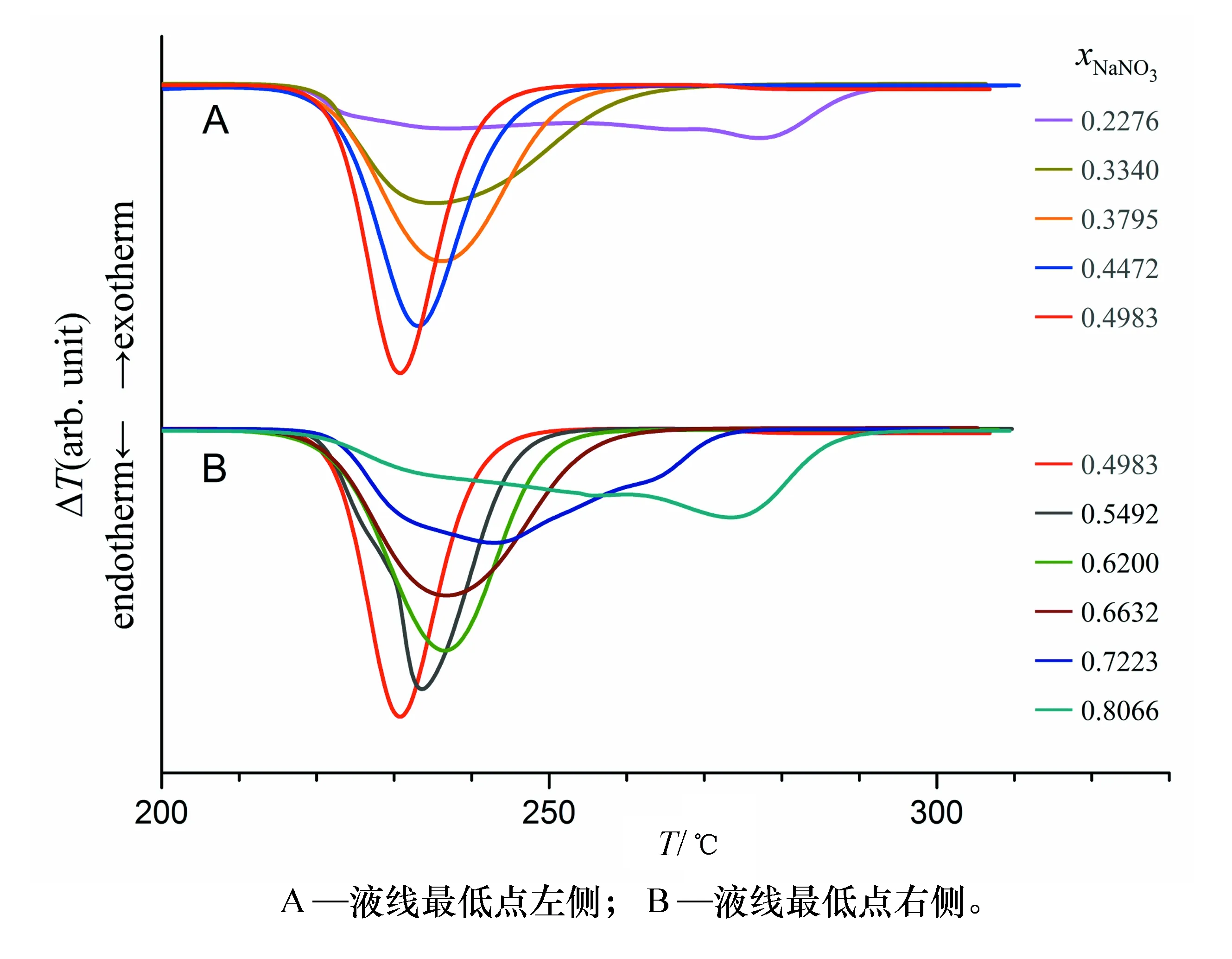
圖7 KNO3-NaNO3二元熔鹽體系固-液轉化過程的DTA曲線
3 結論
采用電腦冷卻用的無電刷風扇,經過簡單加工和裝配,制成與教學型差熱分析儀配套使用的風冷系統,能夠快速冷卻實驗儀器,保證在有限的實驗課時內完成多輪次的差熱分析曲線測定,為開展綜合性差熱分析實驗教學創造了條件。在此基礎上,開發了用差熱分析法研究KNO3-NaNO3二元熔鹽體系液固平衡相圖的實驗教學項目。與傳統的簡單二元體系液固平衡相圖實驗相比,該實驗試劑價廉易得,安全無毒,且用量極少;相變過程包括固態晶相轉化和固-液轉化,相圖結構中包含類似低共熔點形態,但是二組分間實際上又沒有形成低共熔點混合物,體現了相平衡和相變過程的多樣性和復雜性。
本實驗項目可以培養學生的獨立思考能力,根據實際情況具體分析問題,而不是盲從書本知識。通過改造實驗儀器,將差熱分析法用于測定復雜相變體系的相圖,填補了物理化學實驗相關內容的空白,對學生全面理解和掌握相平衡理論和概念有積極幫助,實驗教學效果良好。
References)
[1] 復旦大學. 物理化學實驗[M].2版.北京:高等教育出版社,1993.
[2] 北京大學化學學院物理化學實驗教學組. 物理化學實驗[M].4版.北京:北京大學出版社,2010.
[3] 羅士平. 物理化學實驗[M].2版.北京:化學工業出版社,2010.
[4] 于文生,呂英士,王進賢. 差熱分析實驗的改進[J]. 科技資訊,2008(32):3.
[5] 許新華,王曉崗,吳梅芬. 簡易差熱裝置在合金相圖測定實驗中的應用[J]. 實驗技術與管理,2013,30(12):72-76,86.
[6] 陳良坦,董振榮,黃泰山. 差熱分析在物化實驗中的應用[J]. 實驗室研究與探索,2001,20(2):96-98.
[7] 湯穎,孟梅,徐敬芳,等. 一個物理化學綜合實驗的設計與實踐[J]. 實驗室科學,2010,13(2):98-99.
[8] 南京桑力電子設備廠. ZCR 差熱實驗裝置使用說明書[EB/OL].(2012-01-16)[2015-04-28]. http://www.sangli.com.cn/end.asp?id=163.
[9] Centre for Research in Computational Thermochemistry(CRCT). FACT Compound and Solution Database[EB/OL]. [2015-04-28]. http://www.crct.polymtl.ca/FACT/phase_diagram.php?file=KNO3-NaNO3.jpg&dir=FTsalt.
[10] 彭強,丁靜,魏小蘭,等. 硝酸熔鹽體系在能源利用中的研究進展[J]. 現代化工,2009,29(6):17-22,24.
[11] 路陽,彭國偉,王智平,等. 熔融鹽相變儲熱材料的研究現狀及發展趨勢[J]. 材料導報,2011,25(11):38-42.
[12] 葛志偉,葉鋒,Mathieu Lasfargues,等. 中高溫儲熱材料的研究現狀與展望[J]. 儲能科學與技術,2012,1(2):89-102.
[13] 劉振海,畠山立子. 分析化學手冊:第八分冊 熱分析[M].2版.北京:化學工業出版社,1999.
[14] Pope M I, Judd M D. Differential Thermal Analysis[M]. London:Heyden and Son Ltd,1977.
[15] Kramer C M, Wilson C J. The Phase Diagram of NaNO3-KNO3[J]. Thermochim Acta,1980,42:253-264.
[16] Zamali H, Jemal M. Diagrammes de Phase des Systemes Binaries KNO3-CsNO3et KNO3-NaNO3[J]. J Therm Anal,1994,41:1091-1099.
[17] Jriri T, Rogez J, Mathieu J C, et al. Thermodynamic Analysis of the CsNO3-KNO3-NaNO3System[J]. J Phase Equil,1999,20(5):515-525.
[18] Sangster J. Thermodynamics and Phase Diagrams of 32 Binary Common-Ion Systems of the Group Li,Na,K,Rb,Cs//F,Cl,Br,I,OH,NO3[J]. J Phase Equil, 2000,21(3):241-268.
Improvement of DTA apparatus and its application in physical chemistry experimental teaching
Xu Xinhua, Wu Meifen, Xiao Hanshuang, Wang Xiaogang
(Department of Chemistry, Tongji University, Shanghai 200092, China)
The air-cooling system (fan) was fabricated with simple assemblies to improve the commercial DTA apparatus for experimental teaching. It was proved that the cooling rate of the DTA furnace could be increased greatly by using this fan. Under ordinary experiment conditions, the heated furnace could be cooled down to the temperature below 40 ℃ within 15 min. By reducing the useless waiting time, it is possible to conduct the comprehensive DTA experiments in the basic physical chemistry experiment curriculum. By using the improved DTA apparatus, the solid-liquid phase diagram of KNO3-NaNO3binary fused salt system was measured. Both the transition between solid crystal phases and the transition from solid to liquid can be observed in this system, and the transition temperatures vary with the sample compositions. This is quite different from that for simple eutectic binary systems. The experiment can be finished in the reasonable laboratory time, and the results in experimental teaching are better.
DTA(differential thermal analysis); physical chemistry experiment; binary fused salt system; phase diagram
DOI:10.16791/j.cnki.sjg.2016.01.017
2015- 05- 04修改日期:2015- 06- 22
同濟大學第七期精品實驗建設項目(1380104077)
許新華(1967—),男,浙江黃巖,博士,副教授,從事物理化學及實驗的教學工作
E-mail:xxh01@tongji.edu.cn
王曉崗(1965—),男,江蘇鹽城,博士,教授,同濟大學化學實驗教學示范中心主任,研究方向為納米電化學.
O657.99; O64-33
B
1002-4956(2016)1- 0067- 05
儀器設備研制與應用

