稀土尾礦土壤細菌群落結構對植被修復的響應
陳 熙,劉以珍,李金前,葛 剛,吳 蘭,*,李永繡
1 南昌大學生命學院,南昌 330031
2 江西金達萊環保股份有限公司,南昌 330031
?
稀土尾礦土壤細菌群落結構對植被修復的響應
陳熙1,2,劉以珍1,李金前1,葛 剛1,吳 蘭1,*,李永繡1
1 南昌大學生命學院,南昌330031
2 江西金達萊環保股份有限公司,南昌330031
選用贛州-安遠稀土棄廢尾礦及其不同植被修復的堆浸田為研究對象,調查廢棄尾礦及6種不同植被修復方案下土壤理化性質的變化,并利用變性凝膠梯度電泳(DGGE)技術,分析土壤微生物群落結構對植被修復的響應。結果表明:與未修復尾礦土壤相比,經不同植被修復后的土壤理化性質均得到明顯改良,其中土壤含水量、有機質含量均比未修復尾礦土壤增加2—3倍。微生物群落結構分析表明,植被修復后土壤微生物群落與廢棄尾礦土壤微生物群落親緣度僅為0.21,表明植被修復后,土壤微生物群落結構發生了明顯變化,且微生物多樣性、均勻度、豐富度與未修復尾礦土壤相比均有了明顯的提高。而在不同植被修復方案中,以濕地松和山胡椒為優勢群落的兩種植被修復方案對土壤改良效果最為明顯,這兩種修復方案不僅能顯著改善土壤的固水性、有機質含量,并且對微生物群落的改善作用也最為顯著。典范對應分析表明,廢棄尾礦土壤微生物群落結構受土壤pH影響最為顯著,而植被修復后土壤微生物群落的環境影響因子則轉變為含水量、有機質、有機碳及總磷含量。進一步揭示了微生物在植被修復過程中所起到的重要作用,并為礦山生態重建過程中的土壤改良工作提供了豐富的理論依據。
贛州;稀土廢棄尾礦;微生物群落多樣性;變性梯度凝膠電泳(DGGE)
南方離子型稀土礦自20世紀70年代在贛州被發現以來,因其分布廣、儲量高、易提取等特點而被大規模開采[1],目前南方離子型稀土礦的主要開采技術包括池浸法、堆浸法、原位浸析法[2]。堆浸法作為運用最為廣泛的開采方法,可利用地形筑堆,就地浸提,集中生產,因此有著較高的提取效率[3],但開采需剝離山體表層植被并進行“搬山運動”,使礦山生態平衡受到嚴重破壞,而開采后殘留的硫酸銨浸提液也會對稀土尾礦的土壤及水環境產生影響,因此對受破壞稀土尾礦進行生態修復已經成了不可缺少的重要任務。
植被修復作為生態修復中的主體內容,在稀土礦山尾礦的生態修復過程中得到了廣泛運用。稀土尾礦土壤營養匱乏、固水性差、含砂量高的極端環境特點給植被修復帶來不利的影響[4],因此土壤基質的改良在植被修復的過程中尤為關鍵。土壤微生物作為土壤生態系統中的重要組成部分,參與植物與土壤間營養物質及能量的流通[5],在土壤基質改良過程中起到重要的作用。相關研究表明,土壤微生物群落結構受植被類型、數量影響顯著[6]。然而在植被修復過程中土壤微生物群落如何進行響應,植被-土壤養分-微生物系統在稀土尾礦修復中如何相互促進,目前國內外鮮有報道。
本研究通過分析堆浸工藝開采的礦山經不同模式植被修復后土壤微生物群落結構分布規律,并通過與未修復樣地土壤相比較,分析稀土尾礦微生物群落結構對植被修復的響應,為礦山生態重建過程中的土壤改良工作提供參考。
1 材料與方法
1.1研究區概況及樣品采集
研究區域為安遠中重稀土規劃礦區,該礦區位于贛州市安遠縣北部約30 km,總面積約395 km2,為首批國家規劃稀土礦區。屬亞熱帶濕潤季風氣候區,光照充足,雨量充沛。整體植被修復于2013年5月進行,植被修復在安遠縣板石鎮崗下工區一處堆浸開采礦山的堆浸田進行(25°16′37.00″N, 115°26′18.08″E),待修復樣地土壤為黃色、砂質,粘性較弱。將待修復樣地進行6種不同的植被修復模式,并選取一處未修復樣地為對照。每種修復模式重復3次,以田垅相隔。每種修復模式面積約0.9 km2,總修復面積為5.4 km2。各植被修復方案主要種植植被見表1,植物種植間距為1.5—2 m,各方案種植密度約為1200—1300株/km2木本植物和14000—19000株/km2草本植物。植被種植后需按照不同植物習性定期進行除草、擴穴、松土、培蔸等維護工作。

表1 植被修復方案Table 1 Vegetation restoration scheme
土壤樣品采集于經兩個月修復后的13年9月,采樣以 “S”型5點混合法的取樣方式使用環刀對0—15 cm樣地表層土壤進行取樣,每樣地各取4份平行樣,共取28份樣品。將樣品裝入已標記的自封袋中帶回實驗室,將土壤樣品過40目篩,去除石塊、昆蟲殘體,植物殘根等雜質后,取部分樣品參照《土壤農業化學分析方法》[7]:使用電位法測定土壤pH;70℃過夜烘干法測定土壤含水量(Soil Moisture,簡稱SM);500℃ 馬弗爐法測定土壤去灰分干重(Ash Free Dry Mass,簡稱AFDM),用來表示土壤中的有機質含量;Easychem流動注射分析儀測定土壤氨態氮、硝態氮及總氮含量;高溫重鉻酸鉀氧化-容量法測定土壤總有機碳含量;釩鉬黃吸光光度法測定土壤總磷含量。另外取部分土壤放入已滅菌的2mL離心管中,并置于-80℃冰箱保存,用于土壤細菌群落結構分析。
1.2樣品分析
1.2.1微生物總DNA提取、細菌16SrDNA的PCR擴增
土壤微生物總DNA提取采用硫酸鋁-玻璃珠法提取[8]。細菌16SrDNA使用通用引物GC-358f/907r進行擴增,GC-358f序列[9]為:5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3′,下劃線部分為GC夾序列,907r序列[9]為:5′-CCGTCAATTCMTTTGAGTTT-3′(上海生工生物公司)。25μL擴增體系為:10×PCR buffer 2.5μL、MgCl2(25mmol/L) 3μL、dNTPS(2mmol/L)2μL、引物(10μmol/L)各0.25μL、DNA聚合酶(5 U/μl)0.125μL、土壤DNA模板2μL、ddH2O 14.375 μL。細菌PCR擴增條件為:95℃預變性3 min,94℃ 變性30 s,57℃ 退火30 s,72℃ 延伸90 s,35個循環,最后72℃ 延伸7 min[5],細菌的PCR目的片段均采用1%瓊脂糖凝膠電泳檢測并使用OMEGA公司的PCR純化試劑盒進行純化。
1.2.2目的片段變性梯度凝膠電泳(Denatured Gradient Gel Electrophoresis)
使用美國伯樂公司的Bio-Rad Universal Mutation Detection System對PCR純化產物進行DGGE跑膠,細菌PCR片段使用6%的聚丙烯酰胺,尿素及去離子甲酰胺作為變性劑,根據查閱文獻及條件摸索,本研究中細菌PCR片段最佳變性劑濃度梯度為40%—60%,PCR純化產物上樣量為10 μL,整個電泳系統在電壓85 V, 60℃ 恒溫狀態下在1×TAE 緩沖液中進行電泳16 h。電泳結束后采用銀染法[10]對凝膠進行染色并拍照。
1.2.3數據分析
使用SPSS 21.0 for Windows對土壤理化參數進行統計學分析,DGGE圖譜使用Photoshop CS6進行處理,Quantity One 4.6.2進行DGGE圖譜分析。土壤細菌群落與理化因子的典型對應分析(CCA分析)使用軟件為Canoco 4.0 for Windows。
2 結果與分析
2.1安遠稀土礦區植被修復與未修復樣地土壤理化性質
安遠稀土礦區不同植被修復樣地土壤理化參數如表2所示,結果提示,安遠稀土廢棄尾礦經植被修復后,六種修復方案土壤理化性質均得到改善。其中A方案修復后土壤中的銨態氮、硝態氮含量顯著降低,而含水量、有機質、總有機碳含量增加了3倍左右,且總氮總磷含量亦有一定程度的提高,因此為改善土質的最佳植被修復方案,此外,C、D、E、F方案也均能在一定程度上通過降低土壤中的銨態氮、硝態氮含量,增加土壤中的含水量、有機質、總有機碳、總氮、總磷的含量來改善土壤質量,而B方案并未降低土壤中的銨態氮、硝態氮含量,也無法顯著提高總有機碳,總氮、總磷含量,因此B方案能否對土壤起到明顯的改良效果還需隨修復時間的增加繼續進行調查、分析。

表2 安遠稀土礦區不同植被修復樣地土壤理化參數Table 2 The soil physics and chemistry character in in different scheme area
2.2土壤細菌PCR擴增
提取各土壤樣品的微生物基因組DNA后,將每個樣地的兩個重復樣品DNA合并后進一步使用16S rDNA細菌通用引物GC-358f/907r進行PCR擴增并純化,共得到14個PCR產物(7個樣地,每個樣地2個重復)。擴增結果如圖1所示。
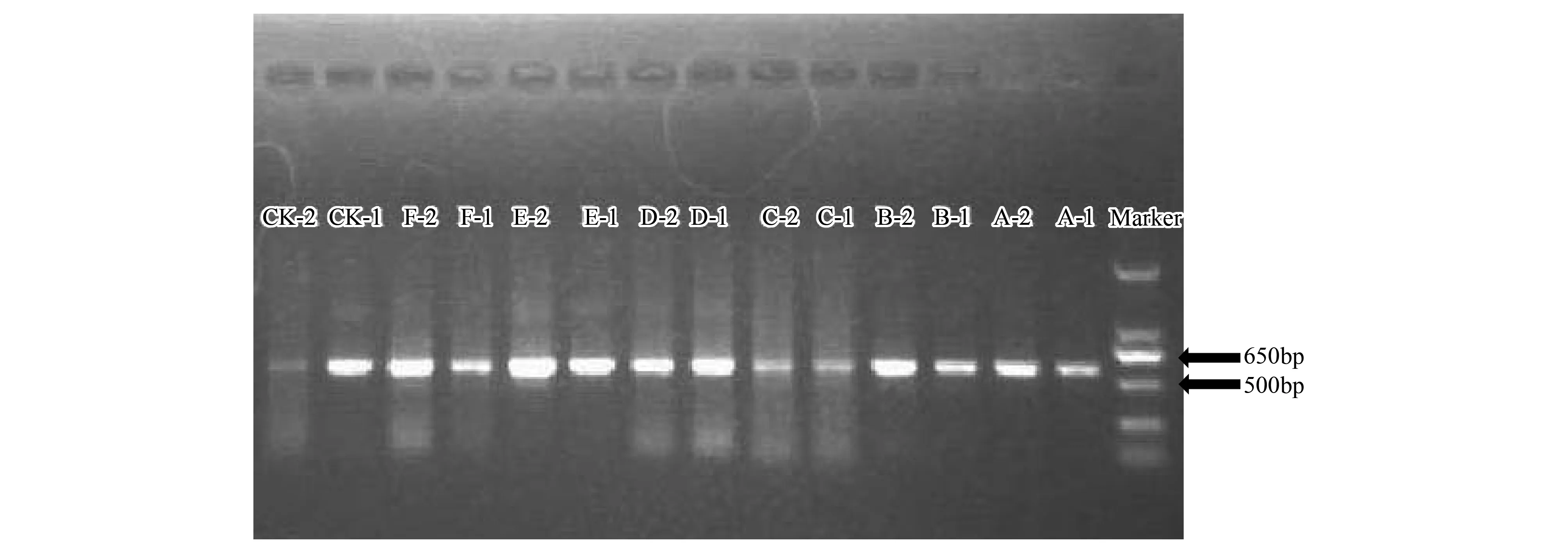
圖1 土壤細菌PCR結果Fig.1 The soil bacterium PCR resultA:濕地松樣地;B:木荷樣地;C:油茶樣地;D:臍橙樣地;E:桉樹樣地;F:山胡椒樣地
細菌PCR電泳后所有樣品條帶均處于同一水平面,其中細菌樣品條帶位于Marker的500bp和650bp條帶之間,約625bp,與PCR引物范圍相符。
2.3植被修復及未修復樣地表層土壤細菌群落結構分析
2.3.1植被修復及未修復樣地表層土壤細菌DGGE圖譜分析
由于DGGE凝膠通量有限,而理化參數測定結果表明本研究中各樣地的平行樣的重復性較好,因此將每個樣地的兩個重復樣品DNA合并后進行PCR擴增并純化,即每塊樣地共有兩份平行樣進行DGGE凝膠電泳,使用Quantity One 4.6.2對DGGE圖譜進行條帶識別及相似性分析,每條泳道不同位置的條帶為樣品中被分離的PCR產物片段,即不同的細菌類群。本研究結果如圖2所示,從圖中我們可以初步看出,DGGE電泳圖中各泳道條帶數目、強度、遷移率均存在一定程度的差異,其中未修復樣地的兩份DNA分離出的條帶數目為10/7條,而植被修復樣地則分離出12—25條數目不等的條帶,植被修復樣地的土壤細菌群落豐富度都高于未修復樣地;在不同植被修復樣地中,山胡椒(Linderaglauca(Sieb. et Zucc.) Bl.)樣地的兩份DNA分離出的條帶數目為25/23條,為所有樣地中條帶數目最多的樣地,而臍橙(Citrussinensis(L.) Osbeck)樣地分離出的條帶數目為12條,為所有樣地中條帶數目最低的樣地。此外,在條帶示意圖中,1號條帶和34號條帶僅在山胡椒樣地中出現,3號條帶僅在濕地松樣地中出現,28號條帶僅在木荷樣地中出現,這表明在山胡椒、濕地松、木荷樣地中可能存在獨有的細菌類群。

圖2 不同樣地表層土壤細菌DGGE圖譜及條帶分布示意圖Fig.2 The soil bactria DGGE atlas and band schematic diagram in different scheme areaA:濕地松樣地;B:木荷樣地;C:油茶樣地;D:臍橙樣地;E:桉樹樣地;F:山胡椒樣地
2.3.2植被修復及未修復樣地表層土壤細菌DGGE聚類分析
對所有樣品進行UPGAMA聚類分析[12],從圖3可知,7種樣地14個樣品的細菌群落共分為兩大族群,其中未修復樣地聚為一類簇群,6種不同植被修復樣地聚為另一族群,兩大族群相似性僅為21%,表明與未修復樣地相比,修復樣地微生物群落結構發生了顯著變化。而植被修復樣地簇群又分為兩類不同的分支,其中油茶(CamelliaoleiferaAbel.),臍橙樣地微生物聚為一支,相似性為43%,而濕地松(pinuselliottii,)、木荷(Schimasuperba)、桉樹(Eucalyptus)、山胡椒樣地聚為另一支,微生物群落相似性為45%。

圖3 不同方案樣地細菌群落DGGE聚類分析Fig.3 The soil bacterial community dendrogram in different scheme areaA:濕地松樣地;B:木荷樣地;C:油茶樣地;D:臍橙樣地;E:桉樹樣地;F:山胡椒樣地
2.3.3植被修復及未修復樣地表層土壤細菌群落多樣性分析
通過使用基因型豐富度(S), Shannon-Wiener 多樣性指數(H′),Pielou 均勻度指數(E)這3項指標來比較各個樣品的細菌多樣性,本研究中所有樣地細菌群落的基因型豐富度、Shannon-Wiener 多樣性指數、Pielou 均勻度指數如表3所示。從表中可以看出,各樣地的多樣性指數均存在不同程度的差異,其中未修復樣地土壤微生物的豐富度、Shannon-Wiener 多樣性指數、均勻度均低于植被修復樣地,而在6種不同植被修復方案樣地中豐富度、Shannon-Wiener 多樣性指數最高的樣地為山胡椒樣地,均勻度最高的樣地為木荷樣地;而豐富度、Shannon-Wiener 多樣性指數、均勻度最低的則均為臍橙樣地。通過相關性分析表明,該研究所有樣地的土壤細菌群落的豐富度與Shannon-Wiener 多樣性指數為極顯著正相關(P<0.01),而均勻度與豐富度及Shannon-Wiener 多樣性指數均為顯著正相關(P<0.05)。

表3 各樣地表層土壤細菌群落基因型豐富度、Shannon-Wiener 指數和均勻度指數平均值Table 3 The average Genotypic richness,Shannon-wiener diversity indexand Pielou evenness index of bacterial community
A:濕地松樣地,B:木荷樣地;C:油茶樣地;D:臍橙樣地;E:桉樹樣地;F:山胡椒樣地
2.3.4植被修復及未修復樣地表層土壤細菌群落和環境因子的典范對應分析(CCA)
為進一步研究土壤細菌群落結構與土壤理化性質的關系,將DGGE指紋圖譜中每一條帶的光密度值作為物種數據,使用CANOCO軟件做(表4)。

表4 安遠稀土礦區土壤環境因子與細菌群落CCA分析結果Table 4 Result of (canonical correspondence analysis, CCA) between the bacterial communities and environmental factors in RE mine area of An Yuan

圖4 安遠稀土礦區細菌群落結構與環境因子CCA排序圖Fig.4 CCA ordination graph between the bacterial communities and environmental factors in RE mine area of An YuanA:濕地松樣地;B:木荷樣地;C:油茶樣地;D:臍橙樣地;E:桉樹樣地;F:山胡椒樣地
CCA結果表明,第一第二排序軸分別解釋了影響細菌群落結構18.4%和16.8%的變異,而前4個排序軸共解釋了影響細菌群落結構57.6%的變異。該分析結果表明,所檢測的環境因子能夠在一定程度上解釋土壤微生物群落結構的變化,但還存在其他可能影響微生物群落結構的環境因子。

2.3.5討論
土壤微生物是土壤生態系統的重要生命體,它可以通過對土壤生態系統營養元素的調節作用促進污染土壤的生態系統穩定性,具有巨大的潛在環境修復功能[11],Junjian Li[12]等人研究了土壤酶活性及微生物多樣性對中國西北地區煤礦開采后廢棄尾礦植被修復的影響,結果表明土壤中的細菌、真菌、古菌均在植被修復過程中起著重要的作用。而在廢棄尾礦上種植植物,也能夠有效抑制土壤肥力、水分的流失,植物的根系,殘體也能提供土壤微生物生長所需能量,方晰[13]等人就研究了湘潭錳礦渣廢棄地進行植被修復對土壤微生物數量及酶活性的影響,結果表明植被修復能明顯提高礦渣廢棄地土壤微生物數量和酶活性。目前國內外對于廢棄尾礦微生物協同植被的修復生態系統研究較少,尤其稀土尾礦在植被修復在過程中微生物所進行協同作用的研究更是未見報道。本研究在安遠稀土尾礦植物-微生物-土壤復合生態恢復體系下,分析了土壤理化性質、細菌群落結構的變化及其它們之間的關系,對細菌群落在稀土尾礦植被修復過程中對土壤所起到的改良作用進行了初步的探討。本研究結果表明,經2個月植被修復后,土壤的理化性質得到了明顯提高,微生物群落結構發生了明顯變化,其中植被修復后土壤含水量,有機質含量均增加了2—3倍左右,土壤微生物群落結構多樣性和豐富度也顯著增加,這表明廢棄尾礦整體土壤得到了明顯改良。安遠稀土尾礦土壤土質以粉粒和沙粒為主,土壤肥力保持能力極差,環境貧瘠,而土壤pH受硫酸銨溶液澆灌影響呈酸性,微生物活動受到抑制,群落多樣性均勻度均處于較低水平,受此影響土壤中物質及能量循環受到抑制,導致含水量、有機質、總有機碳及總氮等理化參數均處于較低水平,土壤環境極其惡劣,經此推斷pH可能為未修復土壤微生物群落的主要影響因子。而本研究采用的修復植物均為抗性較強的本地植物,這有利于植被群落的迅速構建,植被修復后,植物的固著作用使得土壤營養元素得到一定程度的積累,土壤也逐漸由強酸性轉變為弱酸性,影響土壤微生物群落結構的環境因子發生改變,受土壤理化性質的改善的影響,土壤微生物群落有了積極的響應,生物量及多樣性增加,能夠對土壤中更多種類的碳源加以利用,并通過分泌不同功能的土壤酶,進一步改善土壤營養元素的含量,而根系微生物通過促進土壤與植被間的能量傳輸,確保植物生長所需營養元素。因此在微生物的調節功能下,植被修復后土壤環境得到明顯的改良,而土質的改良又能確保植物能夠順利生長,穩定植被群落。
不同植被類型會對土壤微生物群落結構產生顯著的影響[14]。在本研究中,不同的植被恢復方案對土壤環境有著不同的改良效果。在本研究中,對土壤環境改良效果較好的方案為濕地松(A)及山胡椒(F)修復方案。這兩種修復方案對土壤的固水性、有機質含量來改及微生物群落的改善作用最為顯著。濕地松因其耐寒,抗高溫,耐旱亦耐水濕的特征而被廣泛運用于植被修復工程中,相關研究表明,濕地松[15]對土壤微生物多樣性影響顯著,其中濕地松土壤微生物對糖類、羧酸類和氨基酸類碳源有著較高的利用率。山胡椒喜好的土壤環境為微酸的砂質壤土,這與稀土尾礦土質相類似,山胡椒修復方案有利于群落的構建,地被的迅速形成,從而改善土壤環境,而山胡椒與土壤微生物群落結構之間相互影響還有待進一步研究。結果顯示,濕地松及山胡椒均能積極適應稀土礦山尾礦極端的土壤環境,并在生長過程中通過與微生物的相互作用而明顯改善尾礦的土壤理化性質,最終使得土壤環境得到顯著的改良效果。
本研究取樣時間處于植被修復初期,雖然植被修復2個月后土壤質量得到了明顯改善,但該植被修復方案能否長期穩定且有效工作,仍需至少一年或更長時間的監測。此外,目前國內外對植被修復過程中微生物群落功能的研究較少,為揭示土壤微生物在植被修復中所起到的作用,進一步的微生物功能分析尤為必要,例如對土壤酶活性的分析及微生物對碳源利用能力的分析,通過植被修復后土壤微生物群落結構與功能變化研究,能夠進一步揭示微生物在植被修復過程中所起到的重要作用,為礦山生態重建過程中的土壤改良工作提供更豐富的理論依據。
3 結論
(1)稀土礦的開采嚴重破壞了礦山土壤質量,稀土尾礦土壤固水性差、有機質含量低、氮離子含量高、微生物群落多樣性及均勻度較低。而2個月的植被修復使得稀土尾礦的土壤環境得到了一定程度的改良,各修復方案下土壤含水量,有機質增加了2—3倍,土壤微生物多樣性豐富度也顯著增加。
(2)從土壤微生物對植被修復的響應來看,不同的植被恢復方案對土壤環境有著不同的改良效果,其中顯著提高土壤含水量和有機質、微生物多樣性和豐富度的濕地松及山胡椒修復方案較為理想。
(3)典范對應分析表明,植被修復后土壤細菌群落結構受環境因子變化的影響與未修復樣地細菌群落結構有明顯差異,而不同植被修復樣地間的土壤細菌群落結構也因受不同環境因子的影響而存在差異。
[1]楊芳英, 廖合群, 金姝蘭. 贛南稀土礦產開采環境代價分析. 價格月刊, 2013, (6): 87-90.
[2]伍紅強, 尹艷芬, 方夕輝. 風化殼淋積型稀土礦開采及分離技術的現狀與發展. 有色金屬科學與工程, 2011, 1(2): 73-76.
[3]李永繡, 張玲, 周新木. 南方離子型稀土的資源和環境保護性開采模式. 稀土, 2010, 31(2): 80-85.
[4]Li M S. Ecological restoration of mineland with particular reference to the metalliferous mine wasteland in China: A review of research and practice. Science of the Total Environment, 2006, 357(1/3): 38-53.
[5]張杰, 余潮, 王自海, 董昌強, 劉倩純, 吳蘭. 不同植被群落表層土壤中細菌群落多樣性. 環境科學研究, 2013, 26(8): 866-872.
[6]Waid J S. Does soil biodiversity depend upon metabiotic activity and influences?. Applied Soil Ecology, 1999, 13(2): 151-158.
[7]Lu R K. Analytical Methods for Soil and Agricultural Chemistry. Beijing: Agricultural Science and Technology Press of China, 1999.
[8]Wu L, Ge G, Zhu G F, Gong S J, Li S G, Wan J B. Diversity and composition of the bacterial community of Poyang Lake(China) as determined by 16S rRNA gene sequence analysis. World Journal of Microbiology and Biotechnology, 2012, 28(1): 233-244.
[9]Muyzer G, Teske A, Wirsen C O, Jannasch H W. Phylogenetic relationships ofThiomicrospiraspecies and their identification in deep-sea hydrothermal vent samples by denaturing gradient gel electrophoresis of 16S rDNA fragments. Archives of Microbiology, 1995, 164(3): 165-172.
[10]Sanguinetti C J, Dias N E, Simpon A J. Rapid silver staining and recovery of PCR products separated on polyacrylamide gels. Biotechniques, 1994, 17(5): 914-921.
[11]滕應, 駱永明, 李振高. 污染土壤的微生物修復原理與技術進展. 土壤, 2007, 39(4): 497-502.
[12]Li J J, Zhou X M, Yan J X, Li H J, He J Z. Effects of regenerating vegetation on soil enzyme activity and microbial structure in reclaimed soils on a surface coal mine site. Applied Soil Ecology, 2015, 87: 56-62.
[13]方晰, 田大倫, 武麗花, 唐志娟. 植被修復對錳礦渣廢棄地土壤微生物數量與酶活性的影響. 水土保持學報, 2009, 23(4): 221-226.
[14]Loranger-Merciris G, Barthes L, Gastine A, Leadley P. Rapid effects of plant species diversity and identity on soil microbial communities in experimental grassland ecosystems. Soil Biology and Biochemistry, 2006, 38(8): 2336-2343.
[15]陳法霖, 鄭華, 陽柏蘇, 歐陽志云, 張凱, 屠乃美. 外來種濕地松凋落物對土壤微生物群落結構和功能的影響. 生態學報, 2011, 31(12): 3543-3550.
Response of a rare earth tailing soil bacterial community structure to vegetation restoration
CHEN Xi1,2, LIU Yizhen1, LI Jinqian1, GE Gang1, WU Lan1,*, LI Yongxiu1
1SchoolofLifeScience,NanChangUniversity,Nanchang330031,China
2JiangxiJindalaiEnvironmentalProtectionCompanyLimited,Nanchang330031,China
Ion-absorbed-type of rare earth deposits that are located in Ganzhou have been mined on a large scale since the 1970s because of their wide distribution, high reserves, and easy extraction. The deposits are extracted locally by heap leaching and processed through centralized production. Heap leaching has higher extraction efficiency than traditional methods, but it can strip the vegetation at the mine and alter severely the ecological balance. Additionally, the residue of ammonium sulfate has an impact on the soil and water components of the rare earth tailings after exploitation. Therefore, ecological restoration of rare earth tailings has become an indispensable task.Microorganisms are important component of the soil ecosystem; they promote stability of contaminated soil ecosystems by adjusting the function of the soil. Nutrients and microbes in an ecosystem have enormous potential in environmental repair. However, questions such as how soil microbial community responds during the process of vegetation restoration or how to develop a mutually beneficial relationship within the plant-microbe-soil composite ecological restoration system during restoration of rare earth tailings do not yet have clear answers.This article studied how the plant-microbe-soil composite ecological restoration system improved soil quality in An Yuan rare earth tailing and analyzed the change of the bacterial community structure after vegetation restoration. Finally, it discussed how bacteria improved soil quality during the restoration of vegetation on rare earth tailings.In this study, Ganzhou-AnYuan rare earth tailings area and vegetation areas undergoing different levels of restoration were selected as research study sites. We investigated the quality of soil in the original tailing area and in six vegetation restoration areas and used denatured gradient gel electrophoresis technology and canonical correspondence analysis to illustrate the characteristics of soil microbial community structure. Finally, we discussed how soil microbial community responded to the vegetation restoration.Original soil quality of rare earth mines was severely damaged by exploitation. Original rare earth tailings had poor soil moisture content, organic matter content, high nitrogen ion content, and low microbial community diversity and evenness. Soil quality in areas undergoing different levels of vegetation restoration were significantly improved compared to the quality of tailings soil without vegetation restoration, the soil moisture content and organic matter content increased 2—3 times after vegetation restoration. Bacterial community structure analysis showed that after vegetation restoration soil bacterial community structure changed significantly; the relatedness degree of bacterial community was only 0.21 between the original rare earth tailings soil and the vegetation restoration soil, bacterial diversity, evenness, and abundance were significantly improved compared to the original tailing soils. Among the different vegetation restoration schemes, the vegetation restoration schemes with the highest improvement in soil quality utilizedPinuselliottiiandLindera. These two schemes not only improved the soil moisture content and organic matter content, they also improved significantly bacterial community in the soil. Canonical correspondence analysis showed that bacterial community structure in the soil of the original rare earth tailings was significantly affected by soil pH, and once the vegetation was restored, the main environmental factors were replaced by soil moisture content, organic matter, organic carbon, and total phosphorus content. This study further reveals that microbes play an important role in the process of vegetation restoration and the study provides a rich theoretical basis for ecological restoration of rare earth tailings.
Ganzhou; rare-earth tailing; microbial community diversity; DGGE(Denatured Gradient Gel Electrophoresis)
10.5846/stxb201411182280
科技部支撐計劃資助項目(2012BAE01B02);國家973計劃資助項目(2012CBA01200);南昌大學研究生創新專項資助項目(cx2012004)
2014-11-18;
2015-06-29
Corresponding author.E-mail: wl690902@hotmail.com
陳熙,劉以珍,李金前,葛剛,吳蘭,李永繡.稀土尾礦土壤細菌群落結構對植被修復的響應.生態學報,2016,36(13):3943-3950.
Chen X, Liu Y Z, Li J Q, Ge G, Wu L, Li Y X.Response of a rare earth tailing soil bacterial community structure to vegetation restoration.Acta Ecologica Sinica,2016,36(13):3943-3950.

