參麥注射液對中晚期非小細胞肺癌患者免疫功能的影響
李 嶸
?
參麥注射液對中晚期非小細胞肺癌患者免疫功能的影響
李嶸
目的對中晚期非小細胞肺癌患者采用參麥注射液治療,分析其對免疫功能的影響。方法將中晚期肺癌患者隨機分為2組。實驗組采用GP方案化療,同時使用參麥注射液;對照組僅采用GP方案化療。治療2個周期后評價療效。于治療前后抽取入組研究對象空腹血,采用免疫散射比濁法測定免疫球蛋白IgA、IgG、IgM水平,流式細胞儀測定T細胞亞群CD3、CD4、CD8水平。結果實驗組有效率為60.3%、疾病控制率達到87.7%,明顯高于對照組,差異均有統計學意義(P<0.05)。與治療前比較,治療后實驗組IgA、IgG、IgM、CD3、CD4、CD4/CD8升高,CD8降低,差異有統計學意義(P<0.05);對照組治療后CD3較治療前有所降低,CD4較治療前有所提高。治療后2組間進行比較,實驗組患者的CD3、CD4、CD4/CD8均明顯高于對照組,CD8明顯低于對照組,差異有統計學意義(P<0.05)。結論參麥注射液能夠明顯增強中晚期非小細胞肺癌患者的免疫功能,尤其是細胞免疫功能,提高治療效果。
參麥注射液;肺癌;免疫功能
DOI:10.3969/j.issn.1001-5930.2016.07.010
(ThePracticalJournalofCancer,2016,31:1075~1077)
目前,肺癌的發病率及死亡率逐年上升,而在肺癌的各種病理分型中,非小細胞肺癌發病率最高,占90%[1]。大部分NSCLC患者在疾病的早期無明顯癥狀,就診時疾病已發展至中晚期,錯過了最佳的手術時機,只能選擇放、化療。這部分患者不僅受腫瘤本身的影響,放化療等抗腫瘤治療帶來的不適也會進一步降低患者的生活質量,患者的免疫功能也會受到影響[2]。參麥注射液是目前臨床常用的輔助藥,有提高免疫功能、改善局部微循環、抑制血小板聚集等多種功能[3]。本研究通過選擇在我院住院治療的中晚期非小細胞肺癌患者,在抗腫瘤治療的同時,聯合參麥注射液輔助治療,分析其對中晚期非小細胞肺癌患者免疫功能的影響。
1 材料與方法
1.1一般資料
選取于2009年1月至2015年1月在我院住院治療的中晚期肺癌患者123例,均經影像學、病理檢查確診為NSCLC。入組標準:有可測量的腫瘤病灶,KPS≥60分,血常規、肝功能、腎功能、電解質、心電圖均正常,預計生存期大于3個月,既往未接受其它抗腫瘤治療,無化療禁忌證。
將研究對象隨機分為2組,實驗組73例,男性38例,女性35例,年齡35~80歲,平均年齡(57.4±7.5)歲;臨床分期:Ⅲa期34例,Ⅲb期29例,Ⅳ期10例;病理類型:鱗癌39例,腺癌34例。對照組50例,男性25例,女性25例,年齡34~81歲,平均年齡(61.2±7.7)歲;臨床分期:Ⅲa期24例,Ⅲb期20例,Ⅳ期6例;病理類型:鱗癌25例,腺癌25例。2組患者在年齡、性別、臨床分期等方面無明顯差異,具有可比性(P>0.05)。
1.2治療方案
實驗組:采用吉西他濱-順鉑(GP)方案化療。吉西他濱(GEM):1 000 mg/m2,加入0.9%氯化鈉250 ml,靜脈滴注30 min,第1、8天;順鉑(DDP):25 mg/m2,加入0.9%氯化鈉500 ml,靜脈滴注2 h,第1~3天。適當水化,21天為1個周期。同時將參麥注射液50 ml(正大青春寶藥業有限公司,批號:0910342),加入到5%葡萄糖注射液250 ml,靜脈滴注10天。
對照組:采用吉西他濱-順鉑(GP)方案化療。吉西他濱(GEM):1 000 mg/m2,加入0.9%氯化鈉250 ml,靜脈滴注30 min,第1、8天;順鉑(DDP):25 mg/m2,加入0.9%氯化鈉500 ml,靜脈滴注2 h,第1~3天,21天為1個周期。
2組患者均給予格拉司瓊3 mg,每日1次,化療前靜脈滴注;出現白細胞下降者,給予重組人粒細胞刺激因子150 μg皮下注射。2組均重復進行2個周期的治療。
1.3觀察指標
治療開始第1天及最后1天抽取入組研究對象空腹靜脈血,采用免疫散射比濁法測定免疫球蛋白IgA、IgG、IgM水平,流式細胞儀測定T細胞亞群CD3、CD4、CD8水平。
1.4療效評價
對入組患者依據WHO標準進行療效評價,包括完全緩解(CR)、部分緩解(PR)、穩定(SD)、進展(PD)。有效為CR+PR,疾病控制為CR+PR+SD。
入組的研究對象在接受治療前、治療4周期后進行檢查,包括血常規、肝腎功能、CT、彩超等。根據CT結果進行療效評價。
1.5數據處理
采用SPSS17.0統計學軟件進行數據處理,以均數±標準差表示,計數資料采用χ2檢驗,組間比較采用t檢驗,等級資料采用秩和檢驗,P<0.05為差異有統計學意義。
2 結果
2.12組患者治療效果的比較
對2組患者的治療效果進行比較,結果發現,實驗組有效率為60.3%,疾病控制率達到87.7%,明顯高于對照組的30.0%、72.0%,差異有統計學意義(P<0.05),見表1。

表1 2組患者治療效果的比較(例,%)
2.22組患者治療前后免疫球蛋白的比較
對2組患者治療前后的免疫球蛋白IgA、IgG、IgM進行比較,結果發現,在治療前,2組患者的IgA、IgG、IgM無明顯差異(P>0.05);治療后實驗組IgA、IgG、IgM均較治療前明顯升高,且高于對照組,差異有統計學意義(P<0.05),見表2。
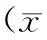
表2 2組患者治療前后免疫球蛋白的比較±s)
注:*為與治療前比較,差異有統計學意義,P<0.05;#為與對照組比較,差異有統計學意義,P<0.05。
2.32組患者治療前后T淋巴亞群的比較
對2組患者在治療前后免疫功能相關指標、T淋巴亞群進行比較,結果發現,在治療前,2組患者的CD3、CD4、CD8、CD4/CD8無明顯差異(P>0.05)。經過治療后,實驗組患者的CD3、CD4、CD4/CD8較治療前提高,差異有統計學意義(P<0.05);對照組治療后CD3較治療前有所降低,CD4較治療前有所提高。治療后2組間進行比較,實驗組患者的CD3、CD4、 CD4/CD8均明顯高于對照組,CD8明顯低于對照組,差異有統計學意義(P<0.05),見表3。
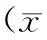
表3 2組患者治療前后T淋巴亞群的比較±s)
注:*為與治療前比較,差異有統計學意義,P<0.05;#為與對照組比較,差異有統計學意義,P<0.05。
3 討論
晚期非小細胞肺癌由于錯過了最佳的手術時機,治療上主要選用放化療[4]。中晚期肺癌患者不僅受到惡性腫瘤的影響,多周期的抗腫瘤也會導致患者出現免疫功能低下。近幾年來,臨床治療上多采用中西醫結合,聯用中藥輔助治療,有效增強了患者的免疫功能,提高了治療效果及改善了患者的生活質量。
參麥注射液是1種純中藥制劑,主要由人參、麥冬制成,是生脈散衍變而來[5]。參麥注射液中,人參能夠安神,麥冬能夠補益[6]。近年來參麥注射液越來越多地用于惡性腫瘤患者,不僅可以提高惡性腫瘤患者的免疫功能,還能夠改善患者的消化、吸收功能,促進蛋白質、核酸的吸收[7]。
在本研究中,實驗組采用GP方案化療,同時使用參麥注射液,對照組僅采用GP方案化療,治療2個周期后評價療效,結果發現,實驗組有效率為60.3%,疾病控制率達到87.7%,明顯高于對照組,這提示,加用參麥注射液能夠提高中晚期非小細胞肺癌的療效。治療后實驗組IgA、IgG、IgM、CD3、CD4、CD4/CD8均較治療前明顯升高,且高于對照組,CD8較治療前降低,并明顯低于對照組。這表明參麥注射液能夠明顯增強中晚期非小細胞肺癌患者的免疫功能。
作為人體免疫系統的重要部分,T淋巴細胞還分為4個亞群,包括誘導-輔助T細胞(Ti/Th)、殺傷T細胞(Tc)、抑制T細胞(Ts)、超敏反應性T細胞。在這其中,T細胞表面標志均有CD3,而Ti/Th的表面標志是CD4,Ts/Tc細胞的表面標志是CD8[8]。有實驗研究表明,參麥注射液可以引起網狀內皮系統興奮性增加,單核巨噬細胞功能增強,機體的抗感染能力增強,增加機體組織器官對特異性細胞的免疫調節功能調節[9]。有研究者對老年晚期NSCLC患者進行研究發現,實驗組采用參麥注射液聯合吉西他濱化療,對照組僅用吉西他濱化療,實驗組在功能量表、癥狀量表、生活質量量表方面的評分均優于對照組,免疫球蛋白和淋巴細胞亞群均較治療前明顯改善[10]。這與本研究結果相一致。
綜上所述,參麥注射液能夠明顯增強中晚期非小細胞肺癌患者的免疫功能,尤其是細胞免疫功能,提高治療效果,是臨床上理想的輔助治療藥物,值得廣泛推廣使用。
[1]張亞棍.非小細胞肺癌的化療進展〔J〕.中國醫藥科學,2011,1(15):40-42.
[2]姜怡瀏.中醫綜合方案維持治療晚期非小細胞肺癌對疾病進展時間和生活質量的影響〔J〕.中國中西醫結合雜志,2011,31(10):1311-1316.
[3]陳麗.參麥注射液對阿霉素所致大鼠心肌損傷保護作用的實驗研究〔J〕.實用癌癥雜志,2003,18(2):129-131.
[4]Aupein A.Meta analysis of concomltant versus sequential radio-chemotherapy in locally advanced non small cell lung cancer〔J〕.Clin Oncol,2010,28(13):2181-2190.
[5]劉萍,沈培強,吳東方,等.參麥注射液聯合羥基喜樹堿抑制腫瘤血管生成的作用機制〔J〕.中國醫院藥學雜志,2011,31(3):213-217.
[6]運乃茹.參麥注射液藥理及臨床研究進展〔J〕.河北中醫,2011,33(8):1253-1255.
[7]郎群峰,駱俊杰.參麥注射液對胃癌患者圍手術期免疫營養治療的效果〔J〕.浙江醫藥大學學報,2009,33(6):1355-1356.
[8]Rakozy CK,Mohamed AV,Vo TD,et al.CD56+/CD4+ lymphomas and leukemias are morphologically,innumophenotypo cally,cytogenetically and clinically diverse〔J〕.Am J Clin Pathol,2001,116(2):168-176.
[9]蔣伯剛.參麥注射液聯合化療治療老年晚期非小細胞肺癌30例臨床療效觀察〔J〕.亞太傳統醫藥,2013,12(9):155-156.
[10]湯建軍.參麥注射液聯合吉西他濱對老年非小細胞肺癌患者生活質量及免疫功能的影響〔J〕.河南中醫,2014,2(34):349-351.
(編輯:甘艷)
Ginseng Injection on Immune Function of Patients with Middle-late Stage Non-small Cell Lung Cancer
LIRong.
MeishanPeople’sHospital,Meishan,620000
ObjectiveTo study the effect of ginseng injection on immune function of patients with locally advanced non-small cell lung cancer.MethodsMiddle-late stage lung cancer patients were randomly divided into 2 groups,the experimental group received GP chemotherapy and ginseng injection,the control group received GP chemotherapy,evaluation of curative effect was conducted after 2 cycles.Fasting blood was extracted before and after treatment,by immune scattering turbidimetric method immunoglobulin IgA,IgG,IgM level were detected,flow cytometry was used to detect T cell subsets CD3,CD4,CD8 levels.ResultsThe effective rate of the experimental group was 60.3%,the disease control rates reached 87.7%,which was significantly higher than the control group,the difference was statistically significant(P<0.05);In the experimental group,IgA,IgG,IgM,CD3,CD4,CD4/CD8 after treatment was obviously higher,CD8 reduced,the difference was statistically significant(P<0.05);In the control group,CD3,CD4/CD8 after treatment was reduced,CD4 improved,the difference was statistically significant(P<0.05);CD3,CD4,CD4/CD8 of the experimental group were significantly higher than those of the control group,CD8 was significantly lower than the control group,the difference was statistically significant(P<0.05).ConclusionGinseng injection can obviously increase the immune function of patients with locally advanced non-small cell lung cancer,especially the cellular immune function,and improve the effect of treatment.
Ginseng injection;Lung cancer;Immune function
620000 四川省眉山市人民醫院
R734.2
A
1001-5930(2016)07-1075-03
2015-10-08
2016-03-10)

