檜木醇對腎癌786-O細胞增殖及相關細胞因子的影響
崔 龍 趙 娟
?
檜木醇對腎癌786-O細胞增殖及相關細胞因子的影響
崔龍趙娟
目的從體外水平研究檜木醇(hinokitio1)的抗腎癌作用,探討其作用機制。方法采用MTT法和流式細胞術檢測檜木醇對腎癌786-O細胞增殖的抑制作用和促凋亡作用的影響;采用Western-blot檢測檜木醇對人腎癌786-O細胞Caspase-3剪切體、LC3和P62蛋白表達水平的影響。以3-MA驗證其抗癌作用與自噬作用的關系。結果檜木醇對腎癌786-O細胞增殖有顯著抑制作用,主要是通過激活Caspase 途徑對細胞凋亡進行誘導。同時檜木醇可以對腎癌786-O細胞進行誘導自噬發生,使LC3蛋白的表達量出現顯著上調,而P62蛋白表達則顯著下調。結論檜木醇能夠顯著抑制腎癌786-O細胞的增殖,而且可以通過過度激活細胞自噬促進腎癌細胞凋亡。
腎癌;786-O細胞;檜木醇;自噬
DOI:10.3969/j.issn.1001-5930.2016.07.004
(ThePracticalJournalofCancer,2016,31:1056~1058)
腎癌是常見的泌尿系統惡性腫瘤,在男性腫瘤中死亡率居第6位,在女性腫瘤中死亡率居第8位[1]。腎癌患者癥狀大多表現不明顯,目前當確診為腎癌時,患者中有20%~30%已經開始出現遠處轉移現象。腎癌的形成是一個相當復雜的病理過程,與遺傳和環境因素有關,但是其中還包括了表觀遺傳學方面的異常,具體發病機制還有待進一步研究[2]。檜木醇(hinokitio1),是提取于柏科植物的一種天然化合物[3],通過國內外同行的多年研究發現其在抗菌、抗氧化、抗炎癥反應和誘導分化等方面有重要的作用[4-5],而近年對于其抗腫瘤的特性研究最為廣泛,且其抗腫瘤作用可能與其DNA的凋亡和損傷誘導作用有關[6-8]。本研究主要在于探討檜木醇是否有抗腎癌作用,并且對其可能的作用機制進行初步研究。
1 材料與方法
1.1實驗材料
人腎癌細胞株786-O(來源于中國科學院細胞庫);檜木醇(來源于美國Sigma公司);Z-VAD-FMK及3-MA(來源于美國Enzo公司);RPMI 1640培養基(來源于美國Hyclone公司);MTT檢測試劑盒(來源于美國Invitrogen公司);Lipofectamine 2000(來源于美國Invitrogen 公司);Annexin V/PI凋亡檢測試劑盒(來源于美國BD公司);本研究中抗體均從美國Cell Signaling Technology公司購買。
1.2方法
1.2.1細胞培養人腎癌786-O細胞培養于含體積分數為10%的FBS及100 mg/L鏈霉素、 100 U/mL青霉素的RPMI-1640培養基中進行傳代培養,培養基放置于37 ℃、5%(體積分數) CO2的培養箱中培養。實驗分為:對照組(0 mmol/L檜木醇組)和實驗組[加入不同濃度檜木醇(2.5 μmol/L、5.0 μmol/L、10.0 μmol/L)]。
1.2.2MTT檢測細胞增殖當細胞處于對數增長期時,取出各組細胞震蕩重懸離心使其在液體中分布均勻,調整細胞使其濃度為2×104個/ml,然后以100 μl/孔加入到96孔板中。各組設置5個重復。48 h作用后,準備好濃度為5 g/L的MTT溶液,每個孔加入20 μl MTT溶液,進行孵育4 h,吸棄上清液。隨后向每個孔中加入DMSO 150 μl,置于振蕩器上進行10 min震蕩,使結晶全部溶解。在490 nm條件下用酶標儀進行光密度值(OD)測定,增殖率=試驗組/對照組×100%。此次實驗做3次重復。
1.2.3流式細胞儀檢測細胞凋亡水平給予相應藥物作用的細胞在培養48 h后,取出各組786-O細胞,進行PBS洗滌預冷,然后按1×10/mL的密度進行重懸,再各取500 μl細胞加入流式管,再加入5 μl Annexin V-FITC和5 μl PI,進行震蕩離心,混合均勻后在避光的條件下放置15 min進行孵育,隨后使用流式細胞儀定量對各組細胞凋亡情況進行檢測,此次實驗做3次重復。
1.2.4Western-blot 檢測處理48 h后,吸棄培養基后,PBS冰浴沖洗,96孔板中加入RIPA裂解液。按照標準操作完成蛋白的提取。蛋白定量(BCA蛋白定量法)后,隨后將5×蛋白上樣緩沖液加入孔中,然后在95 ℃條件下進行煮10 min。SDS-PAGE凝膠電泳后,轉移到NC膜上,后以5%BSA將其封閉1 h。再加一抗于4 ℃放置過夜,用TBST洗膜后,加二抗后室溫1 h孵育,隨后ECL化學發光液5 min孵育,以Image Quant 凝膠成像系統儀對開展顯影觀察,用β-actin作內參。
1.3統計學分析
2 結果
2.1檜木醇對人腎癌786-O細胞的增殖抑制作用
MTT檢測結果表明,當檜木醇濃度為2.5 μmol/L時,24 h藥物處理使腎癌786-O細胞增殖活力受到顯著抑制(P<0.05),并且在本實驗中腎癌786-O細胞檜木醇抑制作用呈現一定程度的藥物濃度依賴性增長趨勢,當檜木醇濃度分別為2.5、5.0、10.0 μmol/L,腎癌細胞的增殖率分別為62.8%、27.6%、14.2%。
2.2流式細胞儀檢測腎癌786-O細胞凋亡的變化
為Annexin V/PI流式細胞術檢測腎癌細胞死亡率結果表明,當給藥濃度為2.5 μmol/L時,檜木醇作用24和48 h后,隨著時間得增加,腎癌786-O細胞的死亡率也存在增加的趨勢。2個時間點(檜木醇作用24、48 h后)Annexin V+/PI-細胞比率依次是1.03%和5.02%,Annexin V+/PI+比率依次是5.78%和24.8%。
2.3檜木醇對腎癌786-O細胞Caspase-3、LC3-Ⅱ、p62蛋白表達水平的影響
Caspase-3作為凋亡主要的最終執行者之一,細胞凋亡情況可以通過其含量高低直接反映出來[7]。經Western blot檢測,在2.5 μmol/L檜木醇處理24 h后,腎癌786-O細胞Caspase-3蛋白含量顯著升高(P<0.05);LC3-Ⅱ蛋白的表達量有明顯上升現象(P<0.05),而P62蛋白的表達量有明顯下降現象(P<0.05)。見表1。
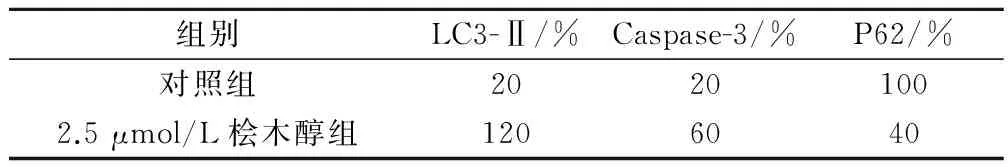
表1 檜木醇對腎癌786-O細胞蛋白表達水平的影響
2.4檜木醇細胞增殖抑制作用與細胞自噬的關系
本研究中加入自噬上游抑制劑來進一步闡明檜木醇對腎癌細胞的抑制作用和自噬作用的關系。MTT實驗結果如表2所示,2 mmol/L的3-MA 24 h能夠顯著抑制由2.5 μmol/L檜木醇帶來的腎癌細胞增殖抑制作用(P<0.05)。其中3-MA是典型的自噬上游抑制劑,本結果提示,檜木醇的抗腫瘤作用可能與腫瘤細胞自噬作用有關。
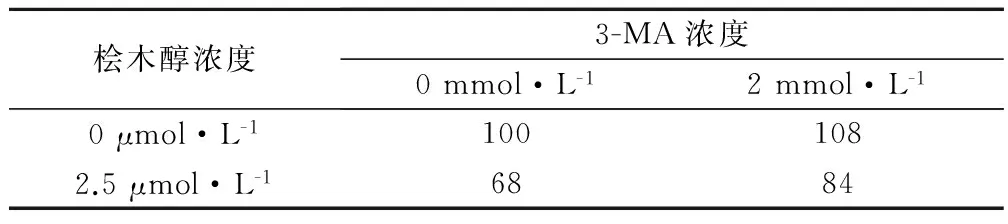
表2 檜木醇與3-MA對腎癌786-O細胞生存率的影響/%
3 討論
近年不少研究結果顯示,肥胖和糖尿病等代謝性疾病的發生率不斷升高帶來的患者罹患腫瘤風險的不斷提高。作為一種天然提取物,近年研究結果發現檜木醇具有抗肺癌、直腸癌和乳腺癌的作用[7-9],然而對于腎癌的研究鮮有報道。本次研究結果表明檜木醇能夠很大程度上對腎癌786-O細胞的增殖產生抑制作用(P<0.05),且一定程度上呈現出劑量依賴性增長趨勢,且其對腎癌細胞的凋亡有促進作用(P<0.05)。在2.5 μmol/L檜木醇處理24 h后,腎癌786-O細胞Caspase-3蛋白含量顯著升高(P<0.05),說明檜木醇帶來的腎癌786-O細胞凋亡作用可能是通過Caspase途徑來實現的;同時檜木醇處理后LC3-Ⅱ蛋白的表達量顯著上升(P<0.05),P62蛋白的表達量顯著下降(P<0.05)。
近年來,自噬在生命科學及醫學研究領域是一大熱點。自噬主要有維持細胞內環境穩態和細胞能量代謝兩個方面的作用。在自噬泡內,物質被酸性水解酶水解后形成糖原和脂肪酸等小分子物質,然后重新釋放至胞質內,繼續參與到物質的代謝功能或再循環的過程中[10]。
目前由于自噬的作用較為復雜,所以在腫瘤中的作用尚且不是很清楚[11]。在生理狀態正常的情況下,自噬的抗癌作用主要通過清除受損的線粒體、胞內產生的ROS和錯誤的折疊蛋白,來對基因組的穩定性和DNA的完整性進行維持。然而在腫瘤發生后,自噬能夠促進腫瘤細胞在低氧、低營養條件下的存活,主要通過給腫瘤細胞供給能量來實現[12]。近年,腫瘤治療研究領域的新熱點之一就是以自噬為靶點的腫瘤治療。
自噬與細胞凋亡的關系及其機制目前還非常復雜不明。在自噬被抑制時,由于胞內合成底物非常缺乏以及代謝的嚴重障礙,而使細胞凋亡發生;然而當胞內嚴重激活自噬時,由于物質的過度消耗,從而也會導致細胞發生凋亡[13]。自噬的活化作用使LC3-Ⅰ發生酯化,從而LC3-Ⅱ型蛋白產生,且其定位于自噬泡,所以LC3蛋白可作為自噬檢測一種標志蛋白。本次研究通過western blot檢測結果表明,檜木醇處理腎癌786-O細胞后,P62蛋白的表達量顯著下降(P<0.05),而P62蛋白是細胞自噬活動的特異性底物之一。本次研究結果很可能是由于檜木醇引起細胞自噬被過度激活,使胞內物質消耗過度,從而導致腎癌786-O細胞凋亡。在本研究中,當腎癌細胞給予3-MA來進行抑制細胞自噬活動后,細胞凋亡率顯著下降(P<0.05),這一結果更加表明檜木醇對腎癌細胞的抗腫瘤作用與自噬作用有密切關系。
本研究證明了檜木醇在體外水平的抗腎癌作用,且初步發現其抗癌作用可能與細胞自噬被過度激活有關。
[1]Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014〔J〕.CA Cancer J Clin,2014,64(1):9-29.
[2]陸鵬,張堅,嚴志強,等.囊性腎癌29例診治分析〔J〕.2012,27(1):70-72.
[3]Suzuki H,Ueda T,Juranek I,et al.Hinokitiol,a selective inhibitor of the platelet-type isozyme of arachidonate 12-lipoxygenase〔J〕.Biochem Biophys Res Commun,2000,275(3):885-889.
[4]倪曉辰,趙志紅,馬永良,等.檜木醇誘導人腎透明細胞癌786-O細胞凋亡及其機制研究〔J〕.中國腫瘤臨床,2015,42(1):43-46.
[5]Komaki N,Watanabe T,Ogasawara A,et al.Antifungal me-
chanism of hinokitiol against Candida albicans〔J〕.Biol Pharm Bull,2008,31(4):735-737.
[6]Shih YH,Lin DJ,Chang KW,et al.Evaluation physical ch-
aracteristics and compaison antimicrobial and anti-inflammation potentials of dental root canal sealers containing hinokitiol invitro〔J〕.PLos one,2014,9(6):e94941.
[7]Wang WK,Lin ST,Chang WW,et al.Hinokitiol induces autophagy inmurine breast and colorectal cancer cells〔J〕.Environ Toxicol,2016,31(1):77-84.
[8]Li LH,Wu P,Lee JY,et al.Hinokitiol induces DNA damaged and autophagy followed by cell cycle arrest and denescence in genfitinib-resistant lung adenocarcinoma cells〔J〕.PLos one,2014,9(8):e104203.
[9]Mizushima N,Komatsu M.Autophagy:renovation of cells a-
nd tissues〔J〕.Cell,2011,147:728-741.
[10]Choi AM,Ryter SW,Levine B.Autophagy in human health and disease〔J〕.N Engl J Med,2013,268(19):1845-1846.
[11]White E.Deconvoluting the context-dependent role for autophagy in cancer〔J〕.Nat Rev Cancer,2012,12(6):401-410.
[12]Marino G,Niso-Santano M,Bachrecke EH,et al.Self-consumption:the interplay of autophagy ad apoptosis〔J〕.Nat Rev Mol Cell Biol,2014,15(2):81-94.
[13]Lee YS,Choi KM,Kim W,et al.Hinokitiol inhibits cell gr-
owth through induction of S-phase arrest and apoptosis in human colon cancer cells and suppresses tumor growth in a mouse xenograft ex periment〔J〕.J Nat Prod,2013,76(120):2195-2202.
(編輯:甘艷)
Effect of Hinokitol on Proliferation of RCC 786-O and Related Cytokines
CUILong,ZHAOJuan.
XiangyangCenterHospital,Xiangyang,441021
ObjectiveTo study the hinokitol anti-renal carcinoma effect in vitros,and explore the mechanism.Methods MTT and flow cytometry assay were used to detect the effect of hinokitol on RCC 786-O cell proliferation inhibition and apoptosis;assay hinokitol influence on RCC 786-O cells caspase-3 shear body,LC3 and p62 protein expression were detected by Western blot.To verify the relationship between the anti-cancer effect and autophagy by 3-MA.ResultsHinokitol can significantly inhibit the proliferation of human 786-O cells,induce cell apoptosis by activating Caspase pathway.At the same time hinokitol induced RCC 786-O cell autophagy,leading to LC3 protein expression was significantly up-regulated,while P62 protein expression was down regulated.ConclusionHinokitol can significantly inhibit the proliferation of RCC786-O cells,and excessive activation of autophagy can promote apoptosis of human renal carcinoma cell line.
Renal cell carcinoma;786-O cells;Hinokitol;Autophagy
441021 湖北省襄陽市中心醫院
趙娟
R737.11
A
1001-5930(2016)07-1056-03
2015-08-10
2015-12-21)

