牙齦卟啉單胞菌對兔血管內皮組織中白細胞介素-33表達的影響
李維善 李德超 邱蓉蓉
佳木斯大學附屬口腔醫院牙周黏膜病科,佳木斯 154007
牙齦卟啉單胞菌對兔血管內皮組織中白細胞介素-33表達的影響
李維善李德超邱蓉蓉
佳木斯大學附屬口腔醫院牙周黏膜病科,佳木斯 154007
目的用牙齦卟啉單胞菌感染兔建立動脈粥樣硬化(AS)模型,觀察感染兔主動脈血管內皮細胞中白細胞介素-33(IL-33)的變化,探討牙齦卟啉單胞菌與AS的關系。方法將24只新西蘭大白兔分為對照組和實驗組。實驗組每周1次靜脈注射牙齦卟啉單胞菌培養液,持續12周,建立感染兔AS模型;對照組每周1次注射等量生理鹽水。實驗13周處死實驗動物,觀察主動脈血管的組織結構;通過免疫組織化學染色、實時熒光半定量聚合酶鏈式反應和Western blot法檢測兔主動脈血管內皮細胞中IL-33 mRNA和蛋白質的表達。結果實驗組血管內皮細胞IL-33 mRNA相對表達量為58.244±2.407,IL-33蛋白相對表達量為1.863±0.171,對照組IL-33 mRNA相對表達量為3.143±0.805,IL-33蛋白相對表達量為0.537±0.028;實驗組IL-33的mRNA和蛋白的表達量均明顯高于對照組(P<0.01)。結論牙齦卟啉單胞菌感染能促進血管內皮細胞表達IL-33,可能對AS的發生發展有一定的調節作用。
牙齦卟啉單胞菌;血管內皮組織;白細胞介素-33;動脈粥樣硬化
牙齦卟啉單胞菌是慢性牙周炎的主要致病菌。動脈粥樣硬化(atherosclerosis,AS)是心血管疾病中最常見的一種炎癥性疾病,嚴重威脅人類健康。已有研究[1]表明,微生物感染在AS發病中起重要作用。炎癥學說已成為AS的研究熱點。已有研究[2]發現,牙周炎和AS間存在相關性,炎癥因子可能是兩者相關性的橋梁和紐帶。白細胞介素-33(interleukin-33,IL-33)在炎癥、感染、自身免疫性疾病中發揮重要的作用,與AS的發生發展也關系密切[3]。IL-33 是AS的保護因子,其含量變化可提示AS的嚴重程度。目前牙齦卟啉單胞菌對IL-33表達影響的研究還比較少見。本研究通過牙齦卟啉單胞菌感染AS動物模型來觀察血管內皮細胞中IL-33的表達,以探討牙齦卟啉單胞菌在AS中的作用。
1 材料和方法
1.1細菌的培養與鑒定
牙齦卟啉單胞菌標準菌株ATCC33277(廣東省微生物菌種保藏中心提供)復蘇后接種于哥倫比亞血平板上,厭氧罐內37 ℃培養3~5 d,革蘭染色后鏡檢,油鏡下可見革蘭染色陰性的紅色桿狀菌體。于腦心浸液肉湯(brain heart infusion broth,BHI)液體培養基中培養增菌,用麥氏比濁法將鑒定后的菌液配制成密度為1×107CFU·mL-1。
1.2實驗分組
選擇24只新西蘭大白兔(佳木斯大學實驗動物中心提供)作為實驗動物,體重為2.0~2.5 kg,隨機分為兩組。實驗組18只,靜脈注射100 μL密度為1× 107CFU·mL-1牙齦卟啉單胞菌培養液,每周1次,持續12周,建立牙齦卟啉單胞菌感染的AS模型[4];對照組6只,每周1次靜脈注射100 μL生理鹽水。13周后處死所有動物,取兔主動脈,部分用10%甲醛溶液固定,用于組織病理學和免疫組織化學實驗,余下部分使用液氮保存,用于基因和蛋白質表達情況的檢測。
1.3主動脈的病理組織學觀察
主動脈標本切片采用蘇木精-伊紅(hematoxylineosin,HE)常規染色,制成病理組織切片,顯微鏡下觀察。
1.4IL-33表達的檢測
1.4.1主動脈血管內皮中IL-33的分布采用免疫組織化學染色法觀察主動脈血管內皮中IL-33的分布。血管組織經修整后,脫水、透明、浸蠟和包埋,采用免疫組織化學法進行染色。標本切片,室溫下孵育5~10 min,滴加一抗和二抗(Santa Cruz公司,美國),顯色,復染,中性樹膠封片,置于Motic3000顯微攝影系統下于400倍下攝片,觀察IL-33染色情況,以細胞質內出現棕黃色顆粒,且著色強度高于背景非特異性染色者判定為陽性。采用Image-pro plus 6.0病理圖像分析系統對IL-33陽性表達進行半定量分析,以積分光密度(integral optical density,IOD)代表IL-33蛋白的相對表達量。IOD測量方法為陽性面積×平均光密度。每組隨機分析6個高倍視野,取其均值代表該組IL-33的相對表達量。
1.4.2主動脈血管內皮中IL-33 mRNA的表達每組各選取5個樣本,采用實時熒光半定量聚合酶鏈式反應法檢測IL-33 mRNA的表達[5],每個樣品重復3次,采用FR-2000型圖像分析系統進行光密度掃描,光密度測量結果代表mRNA的相對表達量,取平均值進行統計學分析。實驗所用引物序列如下:上游引物,5'-CCAGAATAGTGAGAGTGGGGAA-3';下游引物,5'-CGCATGTAGTAAGGTGGGAACC-3';產物長度為110 bp。
1.4.3IL-33蛋白的表達量采用Western blot法檢測IL-33蛋白的表達量[6]。對照組和實驗組各取3只兔的主動脈,用蛋白裂解液提取蛋白,用BCA試劑盒檢測蛋白濃度,以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH )為內參。每個樣品取20 μg蛋白質上樣,進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。冰上90 V電壓下轉膜90 min,BSA封閉,置搖床上1 h,孵育一抗,4 ℃過夜,次日TBST洗3次,室溫下孵育二抗1 h,化學發光、顯影、定影,用凝膠圖形分析。
1.5統計學分析
采用SPSS 18.0軟件進行單因素方差分析,比較實驗組與對照組的差異。檢驗水準為雙側α=0.05。
2 結果
2.1兔主動脈組織學觀察
對照組主動脈血管平整、致密,內膜完整,彈力纖維和平滑肌纖維規整;實驗組可見內膜層有不程度增厚,并向管腔內輕度凸出,形成斑塊,內膜主要為泡沫細胞(圖1);該結果證實AS動物模型建模成功。
2.2免疫組織化學染色
IL-33的免疫組織化學染色結果見圖2:IL-33的陽性表達主要集中于細胞質內,呈棕黃色。實驗組IOD值為2 253.848±195.689,對照組為1 803.587± 184.653,二者差異有統計學意義(P<0.01),實驗組相對表達量高于對照組。
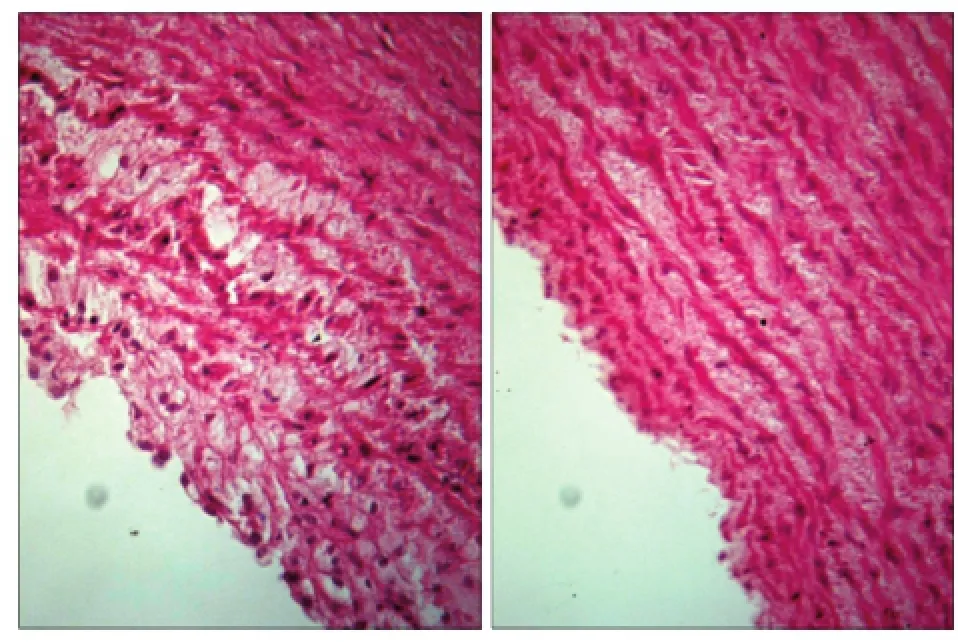
圖1 血管內皮細胞的組織學觀察 HE × 200Fig 1 Histological observation of vascular endothelial cells HE × 200
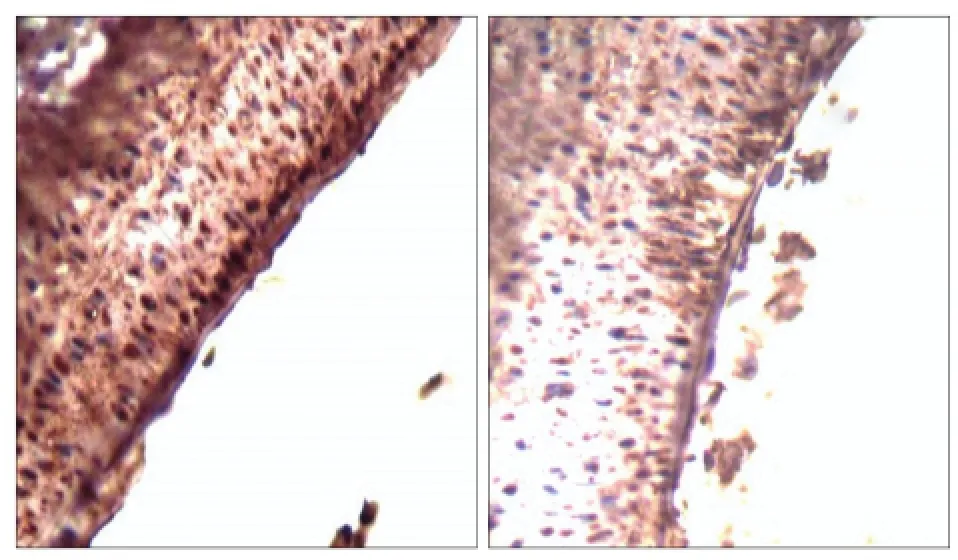
圖2 IL-33的表達 免疫組織化學染色 × 200Fig 2 The expressions of IL-33 immunohistochemistry × 200
2.3IL-33 mRNA的表達
實驗組IL-33的mRNA相對表達量為58.244± 2.407,對照組為3.143±0.805,實驗組明顯高于對照組,兩組差異有統計學意義(P<0.01)。
2.4IL-33蛋白的表達
IL-33蛋白表達的Western blot檢測結果見圖3,實驗組相對表達量為1.863±0.171,對照組為0.537± 0.028,兩組間差異有統計學意義,實驗組明顯高于對照組(P<0.01)。

圖3 IL-33的Western blot檢測Fig 3 Western blot analysis of IL-33
3 討論
牙齦卟啉單胞菌是目前公認的慢性牙周炎的主要致病菌,其慢性感染可影響血管內皮細胞的完整性,脂蛋白代謝,凝血以及血小板功能等[7],損傷牙周組織和局部血管生理功能。研究[8]發現,牙齦卟啉單胞菌感染可誘導豬冠狀動脈和主動脈AS的形成,為其建立動物模型提供了佐證。
目前認為,AS是炎癥性疾病[9],是血管內膜損傷導致脂質沉積和纖維組織增生的過程,是一種大中動脈的慢性炎癥反應[10],其發生發展始終伴隨著炎癥反應,長期感染亦是炎癥性心血管疾病的危險因素[11]。牙周炎是微生物感染引起的慢性感染性疾病,可引起齦溝液等局部組織的炎癥細胞因子水平升高,而高水平的炎癥細胞因子與AS形成密切相關。Li等[12]發現,小鼠經靜脈注射牙齦卟啉單胞菌后AS病變范圍擴大。Lalla等[13]發現,小鼠局部感染牙齦卟啉單胞菌后,AS斑塊數目增加,AS的病變范圍也增加了40%,且在主動脈檢測出牙齦卟啉單胞菌DNA的存在。Jain等[14]建立AS模型,用絲線結扎磨牙并接種牙齦卟啉單胞菌誘發牙周炎,結果發現,在發生牙周炎的兔動脈壁上脂質沉積增加,說明牙齦卟啉單胞菌是AS的潛在危險因素。
IL-33是白細胞介素-1家族的一員,在許多免疫疾病中有多向效應,對炎癥有雙向調控作用[15]。在自身免疫性疾病和變態反應性疾病中有促炎作用,而對多種心血管疾病有保護作用。IL-33主要表達在成纖維細胞、上皮細胞和內皮細胞中。IL-33在內皮細胞的細胞核中積聚,具有促使血管內皮的免疫反應輔助性T細胞(helper T cell,Th)1向Th2轉化的作用,由此發揮保護血管內皮的功能。AS的炎癥反應主要由Th1細胞分化及其激活的炎癥細胞因子驅動,Th1細胞有促進AS斑塊失穩定作用[16],而Th2介導的反應可抑制AS斑塊的形成和促進已形成斑塊的溶解,IL-33可誘導Th1細胞向Th2細胞分化,減少Th1相關因子分泌,增加Th2因子的分泌[17],因此IL-33可能在AS發展中起保護作用。IL-33的表達水平可提示AS的嚴重程度。本實驗結果顯示,牙齦卟啉單胞菌感染后致使AS模型的血管內皮細胞內IL-33的分布、基因和蛋白表達均增加,提示牙齦卟啉單胞菌在AS發展過程中有促進作用,其具體機制有待進一步深入研究。
[1] Persson GR, Persson RE. Cardiovascular disease and periodontitis: an update on the associations and risk[J]. J Clin Periodontol, 2008, 35(8 Suppl):362-379.
[2] Lockhart PB, Bolger AF, Papapanou PN, et al. Periodontaldisease and atherosclerotic vascular disease: does the evidence support an independent association? a scientific statement from the American Heart Association[J]. Circulation,2012, 125(20):2520-2544.
[3] Foks AC, Lichtman AH, Kuiper J. Treating atherosclerosis with regulatory T cells[J]. Arterioscler Thromb Vasc Biol,2015, 35(2):280-287.
[4] 張明珠, 梁景平, 李超倫, 等. 牙齦卟啉單胞菌感染兔動脈粥樣硬化模型的建立[J]. 上海交通大學學報(醫學版),2007, 27(6):642-645. Zhang MZ, Liang JP, Li CL, et al. Establishment of rabbit atherosclerotic model with Porphyromonas gingivalis infection[J]. J Shanghai Jiaotong Univ (Med Sci), 2007, 27 (6):642-645.
[5] 陳偉, 劉艷, 楊緊根, 等. 實時定量PCR技術檢測結核分枝桿菌蛋白編碼基因表達水平研究[J]. 中國病原生物學雜志, 2012, 7(4):254-257. Chen W, Liu Y, Yang JG, et al. Level of expression of the genes coding for proteins in Mycobacterium tuberculosis according to qRT-PCR[J]. Chin J Pathog Biol, 2012, 7(4): 254-257.
[6] 魏魁杰, 張雷, 楊筱, 等. 細胞角蛋白17在口腔鱗癌中的表達[J]. 華西口腔醫學雜志, 2011, 29(4):404-408. Wei KJ, Zhang L, Yang X, et al. Expression of cytokeratin 17 in oral squamous cell carcinoma[J]. West Chin J Stomatol,2011, 29(4):404-408.
[7] Han YW, Wang X. Mobile microbiome: oral bacteria in extra-oral infections and inflammation[J]. J Dent Res, 2013,92(6):485-491.
[8] Brodala N, Merricks EP, Bellinger DA, et al. Porphyromonas gingivalis bacteremia induces coronary and aortic atherosclerosis in normocholesterolemic and hypercholesterolemic pigs[J]. Arterioscler Thromb Vasc Biol, 2005, 25(7):1446-1451.
[9] Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011,473(7347):317-325.
[10] Matheeussen V, Waumans Y, Martinet W, et al. Dipeptidyl peptidases in atherosclerosis: expression and role in macrophage differentiation, activation and apoptosis[J]. Basic Res Cardiol, 2013, 108(3):350.
[11] 屠彥, 陳暉. 口腔感染引發心血管疾病的機制[J]. 國際口腔醫學雜志, 2010, 37(2):182-185. Tu Y, Chen H. Mechanism of cardiovascular disease caused by oral infection[J]. Int J Stomatol, 2010, 37(2):182-185.
[12] Li L, Messas E, Batista EL Jr, et al. Porphyromonas gingivalis infection accelerates the progression of atherosclerosis in a heterozygous apolipoprotein E-deficient murine model [J]. Circulation, 2002, 105(7):861-867.
[13] Lalla E, Lamster IB, Hofmann MA, et al. Oral infection with a periodontal pathogen accelerates early atherosclerosis in apolipoprotein E-null mice[J]. Arterioscler Thromb Vasc Biol, 2003, 23(8):1405-1411.
[14] Jain A, Batista EL Jr, Serhan C, et al. Role for periodontitis in the progression of lipid deposition in an animal model[J]. Infect Immun, 2003, 71(10):6012-6018.
[15] Pei C, Barbour M, Fairlie-Clarke KJ, et al. Emerging role of interleukin-33 in autoimmune diseases[J]. Immunology,2014, 141(1):9-17.
[16] Pylaeva EA, Potekhina AV, Provatorov SI, et al. Effector and regulatory blood lymphocyte subpopulations in stable coronary artery disease[J]. Ter Arkh, 2014, 86(9):24-30.
[17] Miller AM, Xu D, Asquith DL, et al. IL-33 reduces the development of atherosclerosis[J]. J Exp Med, 2008, 205(2):339-346.
(本文編輯吳愛華)
Effects of Porphyromonas gingivalis on interleukin-33 expression in rabbit vascular endothelium tissues
Li Weishan,Li Dechao, Qiu Rongrong.(Dept. of Periodontal and Mucosal Diseases, The Affiliated Stomatology Hospital of Jiamusi University, Jiamusi 154007, China)
Supported by: The Research Project of The Education Department of Heilongjiang Province (12531707); The Fund of Graduate Student Research Innovation in Jiamusi University (LM2014-041). Correspondence: Li Weishan, E-mail: weishanli666@ 126.com.
ObjectiveTo investigate interleukin-33 (IL-33) in the arterial vascular endothelium of rabbits infected with Porphyromonas gingivalis (P. gingivalis), and to explore the relationship between P. gingivalis and atherosclerosis. Methods A total of 24 rabbits were randomly divided into control and experimental groups. The experimental group received intravenous injection of P. gingivalis once a week for 12 weeks to establish a coronary atherosclerosis model. The rabbits in the control group were injected with equal volume of physiological saline. All the rabbits were killed after 13 weeks. The IL-33 expression levels in the arterial vascular endothelium of the rabbits were detected through immunohistochemistry, reverse transcription polymerase chain reaction, and Western blot analysis. The effects of P. gingivalis on the IL-33 expression in the arterial vascular endothelium of the rabbits were analyzed. ResultsThe relative expression levels of IL-33 mRNA in the vascular endothelium cells were 58.244±2.407, and the relative expression levels of IL-33 protein were 1.863±0.171 in the experimental group. The relative expression levels of IL-33 mRNA were 3.143±0.805, and the relative expression levels of IL-33 protein were 0.537± 0.028 in the control group. The expression levels of IL-33 mRNA and protein of vascular endothelium cells in the experimental group were significantly higher than those of the control group (P<0.01). ConclusionP. gingivalis infection promotes IL-33 expression levels in vascular endothelial cells and may regulate the occurrence and development of atherosclerosis.
Porphyromonas gingivalis;vascular endothelium tissue;interleukin-33;atherosclerosis
R 780.2
A
10.7518/hxkq.2016.04.007
2015-11-23;
2016-03-12
黑龍江省教育廳科研基金(12531707);佳木斯大學研究生科研創新基金(LM2014-041)
李維善,副主任醫師,碩士,E-mail:weishanli666@126. com
李維善,副主任醫師,碩士,E-mail:weishanli666@126. com

