牙周局部炎癥影響小鼠腸道機械及免疫屏障功能
謝美蓮 余挺 卓穎 黃馨 謝寶儀 軒東英,3 章錦才,3
1.南方醫科大學附屬口腔醫院牙周科,廣州 510280;2.廣州醫科大學附屬口腔醫院牙周科,廣州 510150;3.中國科學院大學存濟醫學院附屬杭州口腔醫院牙周科,杭州 310006
·牙周病學專欄·
牙周局部炎癥影響小鼠腸道機械及免疫屏障功能
謝美蓮1余挺2卓穎1黃馨1謝寶儀1軒東英1,3章錦才1,3
1.南方醫科大學附屬口腔醫院牙周科,廣州 510280;2.廣州醫科大學附屬口腔醫院牙周科,廣州 510150;3.中國科學院大學存濟醫學院附屬杭州口腔醫院牙周科,杭州 310006
目的探索牙周局部炎癥對小鼠腸道屏障(生態屏障、機械屏障、免疫屏障)功能的影響。方法將20只雄性C57BL/6J小鼠隨機分為牙周炎組(P組)和對照組(C組),每組10只。P組使用浸泡牙齦卟啉單胞菌的絲線行牙周結扎10 d,C組假性結扎。分離上頜骨測量牙槽骨喪失量,取腸道內容物行16s rRNA焦磷酸測序分析菌群結構,免疫組織化學檢測回腸組織occludin、claudin2、NOD2蛋白的表達。結果P組的牙槽骨喪失量高于C組(P<0.001)。P組與C組的主要菌門及卟啉單胞菌種比例無統計學差異(P>0.05),P組occludin、claudin2、NOD2的表達高于C組(P=0.039,P=0.011,P=0.039)。結論牙周局部炎癥在一定程度上影響了小鼠腸道的機械及免疫屏障功能。
牙周炎;炎癥性腸病;腸道菌群;機械屏障
牙周炎是由菌斑微生物引發的以牙周支持組織破壞為主要特征的慢性炎癥性疾病[1],是成年人失牙的主要原因[2]。流行病學資料顯示牙周炎與一系列全身系統性疾病包括胃腸道疾病如炎癥性腸病(inflammatory bowel disease,IBD)等相關[3-5]。約旦流行病學調查顯示IBD人群的牙周炎患病率是非IBD人群的4.9~7.0倍[6]。IBD人群的牙周袋探診深度較非IBD人群高0.8~0.9 mm[7]。然而,牙周炎與胃腸道疾病的關聯機制并不清楚,菌群失調可能是其重要機制[8]。研究[9]發現口腔喂飼牙齦卟啉單胞菌(Porphy-romonas gingivalis,P. gingivalis)可導致小鼠腸道菌群結構改變和腸道機械屏障受損,但未誘導出明確的牙周炎和牙周組織破壞[10]。至此仍無明確證據表明,牙周炎對腸道功能包括菌群結構和腸道屏障有不利影響。本研究以結扎法誘導實驗性牙周炎,通過檢測牙周炎狀態下小鼠腸道的生態、機械及免疫屏障變化,探索牙周炎對小鼠腸道功能的影響,為牙周炎與腸道疾病的關聯機制提供依據。
1 材料和方法
1.1牙周炎模型的建立與驗證
1.1.1實驗性牙周炎模型建立將20只SPF級雄性C57BL/6J小鼠(22周齡,體重27.2 g± 2.5 g)隨機分為牙周炎組(P組)和對照組(C組),每組10只。4%水合氯醛腹腔注射麻醉下,P組使用浸泡P. gingivalis ATCC33277肉湯24 h的5-0絲線行雙側上頜第二磨牙(M2)牙周結扎,C組使用浸泡無菌水的5-0絲線行假性結扎。一次性結扎10 d后,處死小鼠取材。
1.1.2實驗性牙周炎模型驗證分離上頜骨,用10%中性甲醛溶液固定。取一側脫鈣液(10%EDTA,0.2 mol·L-1Tris)脫鈣3周,M2頰側正面朝下包埋,切5 μm厚切片,蘇木精-伊紅(hematoxylin-eosin,HE)染色。體視顯微鏡下拍照,定性分析牙周組織炎癥。另一側于沸水中煮15 min,剝凈軟組織、漂白,1%亞甲基藍水溶液染色1 min,沖洗、晾干,體視顯微鏡下拍照,Image J軟件(NIH公司,美國)測量3個磨牙頰腭側共18個位點的釉牙骨質界-牙槽嵴頂距離[11],均值為樣本的牙槽骨喪失量。
1.216s rRNA焦磷酸測序法檢測腸道菌群結構
分離腸道的回腸至結腸部分[12],5 mL生理鹽水沖取腸道內容物,混勻,PowerSoil?DNA提取試劑盒(MO BIO公司,美國)提取總DNA,操作按照試劑盒說明書進行。所得DNA進行凝膠電泳,確認DNA質量合格。針對16s rRNA的V3、V4高變區序列設計特異性引物(V3,TACGGRAGGCAGCAG;V4,GGACTACCAGGGTATCTAAT),進行聚合酶鏈反應(polymerase chain reaction,PCR)擴增。擴增程序設定為:95 ℃ 2 min,95 ℃ 20 s、55 ℃15 s、72 ℃ 5 min 循環25次,72 ℃ 10 min。對擴增后的產物進行提純,末端修復,連上接頭、測序引物后,采用Illumina Miseq高通量平臺測序,測序策略為PE 300。測序所得序列通過去除低質量序列、接頭污染序列及含N比例大于5%序列等過程完成數據過濾,得到可信的目標序列。目標序列采用PEAR序列拼接算法將雙末端測序序列根據末尾的重疊情況進行拼接,導入分析軟件QIIME 1.8.0進行分析[13]。
1.3免疫組織化學檢測回腸組織occludin、claudin2、NOD2蛋白的表達
取長度為2 cm的回腸(距回盲端2 cm),4%多聚甲醛固定,常規脫水、浸蠟、包埋,切4 μm厚切片。切片常規脫蠟、水化,微波熱抗原修復13 min(修復液1 mmol·L-1Tris-EDTA),冷卻后PBS緩沖液(0.01 mol·L-1,pH 7.2~7.4)沖洗,30 mL·L-1過氧化氫滅活15 min,10%山羊血清封閉10 min。37 ℃下孵育一抗(Abcam兔抗小鼠occludin、兔抗小鼠claudin2、大鼠抗小鼠NOD2一抗分別孵育2、2、3 h),PBS沖洗,37 ℃下孵育二抗30 min,PBS沖洗, DAB(工作濃度1∶20)顯色30 s,蘇木素復染,常規脫水、透明,中性樹膠封片,Olympus IX83顯微鏡下鏡檢,Image Pro Express 6.0軟件拍照。每組隨機選取5個樣本,每個樣本隨機選取5個不連續切片上的5個視野(×400),利用ImagePro Plus 6.0軟件計算蛋白染色的平均光密度值。
1.4統計學處理
采用SPSS 17.0軟件進行數據分析,以均數±標準差描述結果。牙槽骨喪失量、菌群比例以及平均光密度值均采用兩獨立樣本t檢驗行兩組間比較。
2 結果
2.1實驗性牙周炎模型成功建立
頜骨HE染色(圖1上)顯示,P組牙齦退縮,上皮及上皮下結締組織大量炎癥細胞浸潤,C組牙周組織正常。亞甲基藍染色(圖1下)顯示,P組出現明顯的牙槽骨喪失。

圖1 實驗性牙周炎模型的驗證Fig 1 Verification of experiment periodontitis model
P、C組的牙槽骨喪失量分別為(0.38±0.06)、(0.15±0.02)mm,統計分析表明,P組的牙槽骨喪失量高于C組(P<0.001)。
2.2腸道菌群結構分析比較
本次測序腸道檢測出8個主要菌門:擬桿菌門、厚壁菌門、變形菌門、放線菌門、候選菌門、疣微菌門、無壁菌門、脫鐵桿菌門,其中前5種菌門占測得序列的99.6%以上。聚類樹圖顯示組內樣本一致性較好(圖2)。
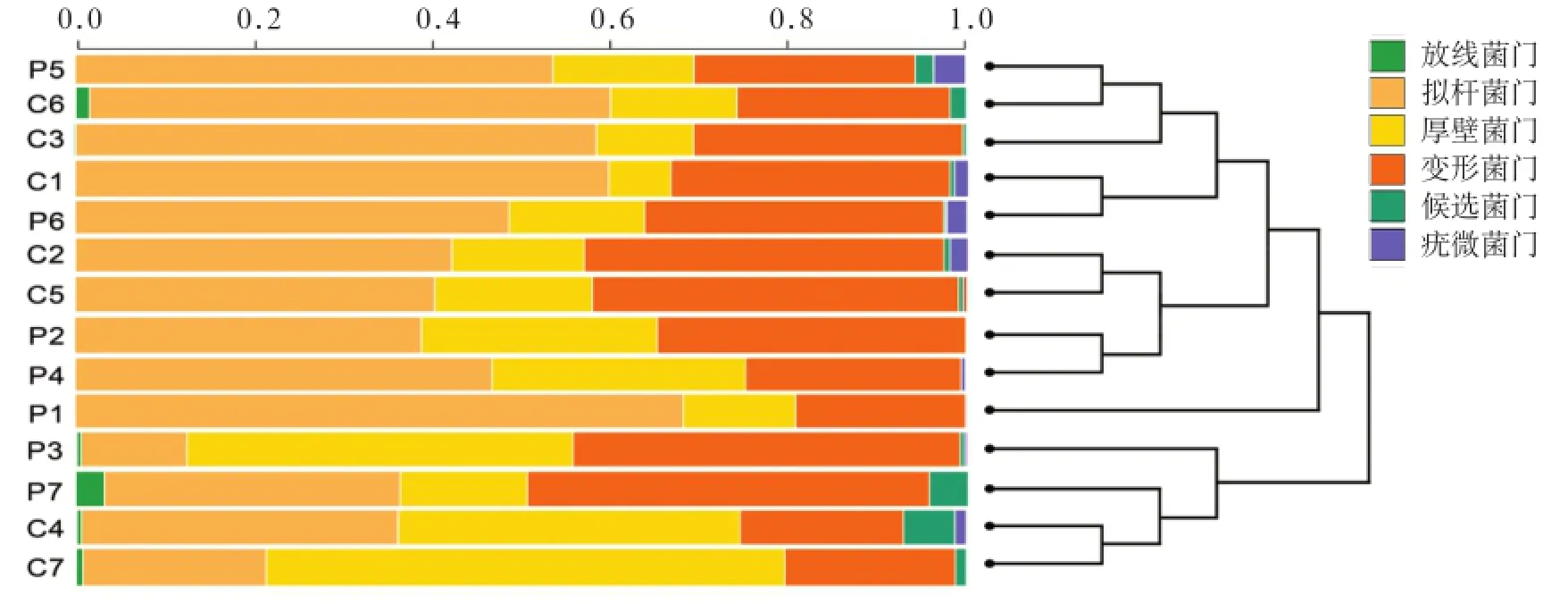
圖2 各樣本腸道菌群結構聚類樹圖Fig 2 Cluster dendrogram generated of the gut microbiota across the samples
2組主要菌門及卟啉單胞菌種比例的比較見表1。與C組相比,P組擬桿菌門、厚壁菌門、候選菌門、無壁菌門、脫鐵桿菌門比例下降,變形菌門、放線菌門、疣微菌門、卟啉單胞菌種比例升高,但均無統計學差異(P>0.05)。對于脫鐵桿菌門, C組檢出比例為0.05‰,P組未檢出,二者間無統計學差異(P>0.05)。
2.3回腸組織中occludin、claudin2、NOD2蛋白的表達
免疫組織化學結果(圖3)顯示,occludin、claudin2均表達于回腸黏膜上皮細胞的胞漿,NOD2表達于上皮細胞及間質單核巨噬細胞系的胞核。P組occludin、claudin2、NOD2的表達高于C組(P=0.039,P=0.011,P=0.039)(表2)。
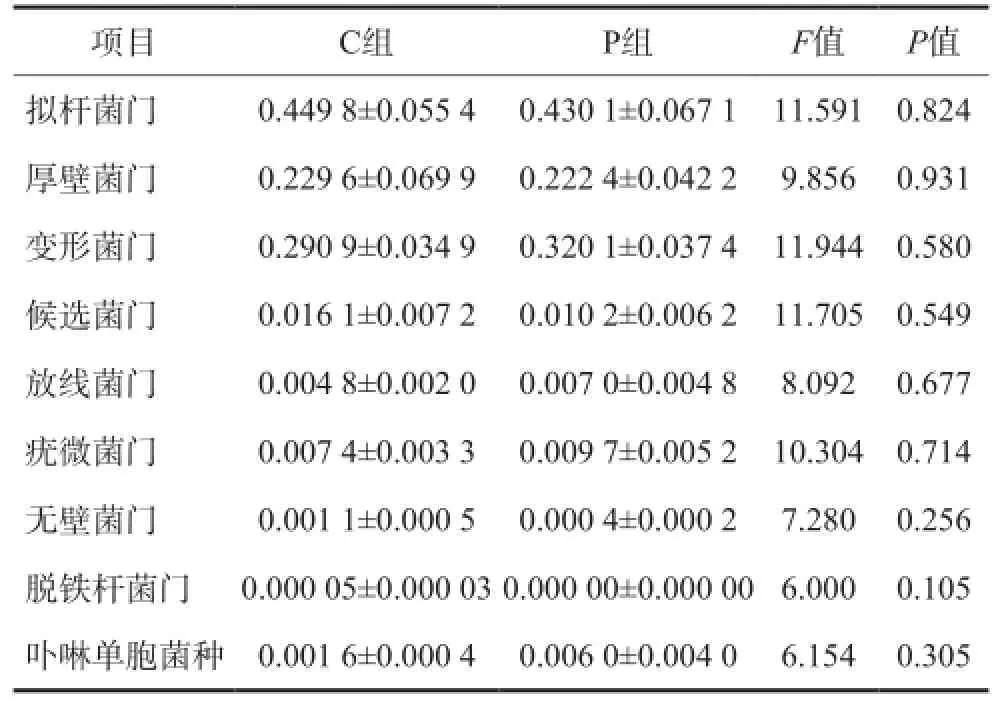
表1 2組主要菌門及卟啉單胞菌種比例的比較Tab 1 Comparison of the abundance of the main phyla and genus parabacteroides of two groups
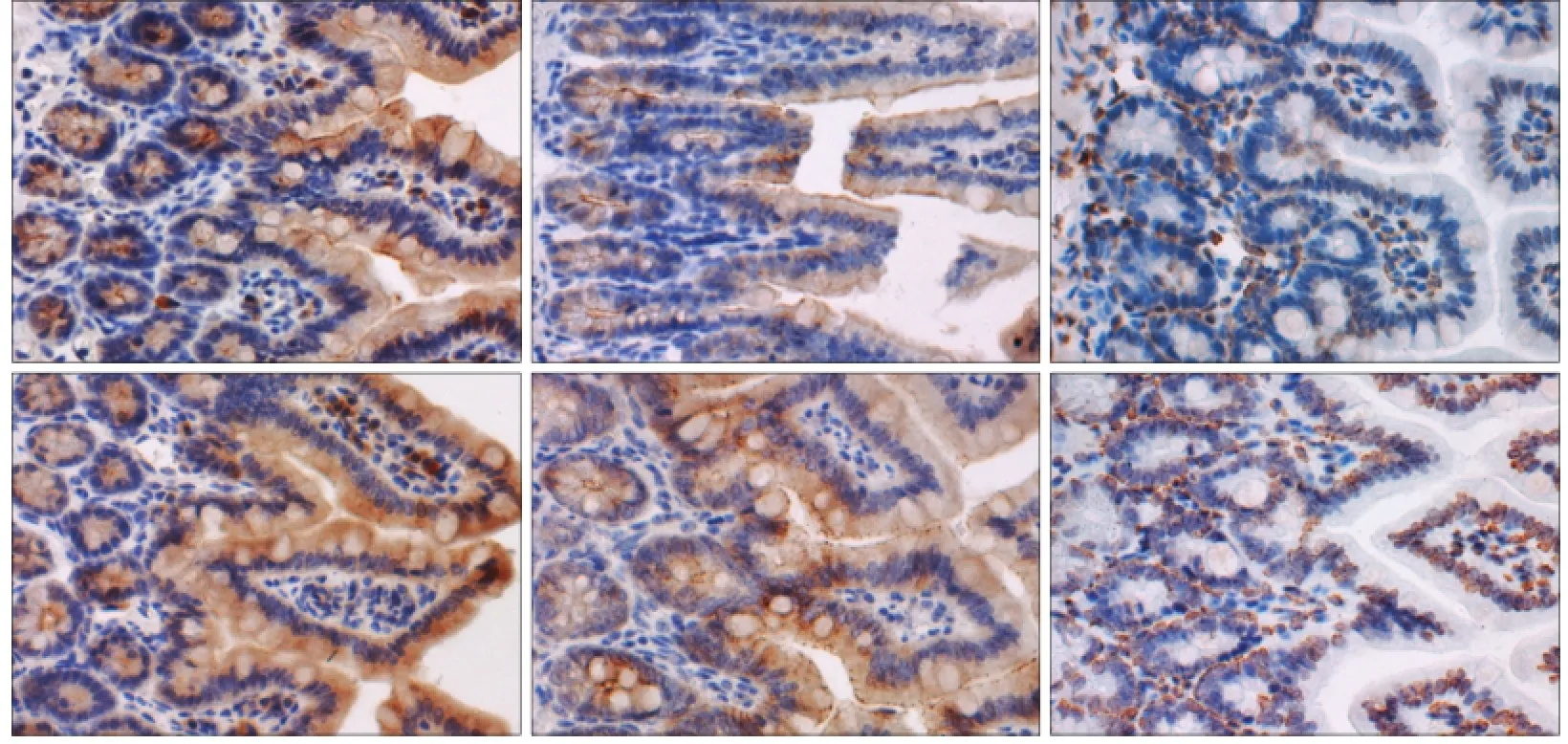
圖3 2組回腸組織occludin、claudin2及NOD2蛋白的表達 免疫組織化學 × 400Fig 3 Occludin, claudin2 and NOD2 in the ileum of two groups immunohistochemistry × 400
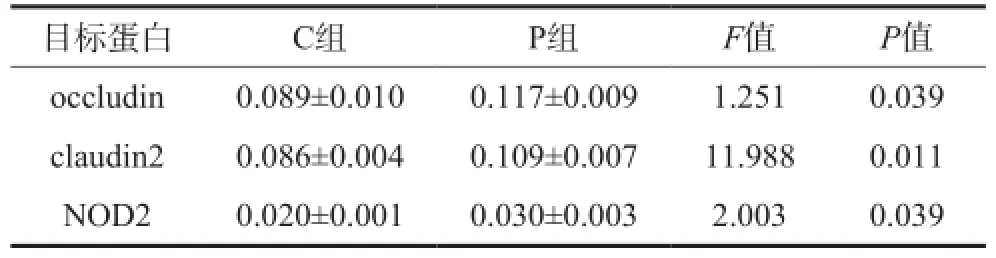
表2 2組回腸組織occludin、claudin2、NOD2蛋白表達的比較Tab 2 Comparison of occludin, claudin2 and NOD2 expression in ileum of two groups
3 討論
腸道屏障包括由腸道正常菌群組成的生態屏障、由完整上皮和各類緊密連接蛋白(如occludin、claudin2[14])組成的機械屏障以及由腸道黏膜內各類免疫細胞及免疫蛋白(如NOD2[15])組成的免疫屏障,三者在功能上緊密聯系,共同行使腸道免疫功能[16]。本研究結果顯示,牙周炎組小鼠腸道菌群結構無顯著改變,但其機械屏障和免疫屏障發生了一定程度的變化。
在生態屏障方面,牙周局部炎癥對小鼠腸道菌群的菌門結構及卟啉單胞菌種比例并無顯著影響。值得注意的是,盡管沒有顯著性,牙周炎小鼠的腸道未能檢測出脫鐵桿菌門的存在。Robertson等[17]認為脫鐵桿菌門與人類健康或疾病狀態都沒有明確關聯。有趣的是,近年有研究[18]發現,脫鐵桿菌門在牙周炎患者的齦下菌群中的比例高于非牙周炎患者。脫鐵桿菌門也存在于感染牙髓中并被認為可能是根尖周疾病的潛在病原菌[19]。此外,在肥胖小鼠、結腸炎小鼠以及被豬鞭蟲感染的小型豬的腸道中,均觀察到了脫鐵桿菌門比例的升高[20-22]。脫鐵桿菌門似乎傾向于在炎癥部位活躍,但卻在牙周炎小鼠的腸道中“缺席”,可能是菌群調控的結果。
在機械屏障方面,occludin是緊密連接蛋白中最早被發現的結構蛋白[23]。occludin與claudins家族共同組成轉運通道,控制上皮屏障通透性,其過量表達時上皮通透性明顯增加[14]。Choi等[24]研究發現,牙周炎患者的牙齦上皮出現occludin的過量表達;而claudin2的上調及其他claudins的改變被認為與IBD的疾病活動期相關[25]。在本實驗中,牙周炎小鼠同時出現occludin和claudin2的表達上調,表明其腸道機械屏障功能受損。此外,claudin2的上調還伴隨著腸道上皮細胞對抗原大分子胞吞作用的增強[26]。NOD2在牙周炎小鼠的高表達驗證了這一點。
NOD2是胃腸道上皮細胞及髓系、淋巴系造血細胞內的先天性免疫蛋白[27],其可識別進入胞內的革蘭陰性菌和革蘭陽性菌的胞壁肽聚糖,啟動對病原體的應答反應[15]。牙周炎小鼠腸道出現NOD2的高表達,說明腸道免疫屏障被激活,這可能是機械屏障受損的結果,也可能說明腸道正常菌群已經發生了一定程度的變化。
本研究采用單次牙周結扎建立小鼠牙周炎模型,主要基于以下兩點:1)多次麻醉將引起注射局部炎癥反應[28];牙周結扎時采用腹腔注射麻醉,多次結扎可能引起腹腔、腸道及系統的非特異性炎癥反應,混淆本實驗結果。2)Nakajima團隊的實驗中,在單次109CFU數量的活牙齦卟啉單胞菌管飼后的48 h可檢測到P組的卟啉單胞菌種比例顯著高于C組[9],提示大量喂飼牙齦卟啉單胞菌可造成腸道菌群結構改變;但即使是多次喂飼,實驗小鼠上也并沒有觀察到顯著的牙槽骨吸收[10];因此,牙齦卟啉單胞菌喂飼不足以引起典型的牙周炎。單次結扎可最大限度地減少建模手段本身對系統性炎癥水平及腸道菌群結構變化的影響。本實驗因結扎使用的絲線含有牙齦卟啉單胞菌,盡管菌群檢測的結果顯示P組的卟啉單胞菌種比例并不顯著高于C組,但尚不能否認本實驗的結果與牙齦卟啉單胞菌的吞菌無關。
綜上所述,本實驗結果尚不能說明牙周局部炎癥對小鼠腸道菌群結構有顯著的調控,但在一定程度上影響了其腸道屏障功能,包括機械屏障受損以及免疫屏障激活,提示控制牙周疾病可能有利于預防和控制胃腸道疾病,但其相關的具體生理機制仍需深入研究和探討。
[1] Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation[J]. Nat Rev Immunol,2015, 15(1):30-44.
[2] 駱凱, 閆福華. 牙周病與全身健康[J]. 中國實用口腔科雜志, 2009, 2(4):203-206. Luo K, Yan FH. Periodontal diseases and human health[J]. Chin J Pract Stomatol, 2009, 2(4):203-206.
[3]朱習華, 劉麗, 許文青. 牙周病與糖尿病關聯性的Meta分析[J]. 廣東牙病防治, 2014, 22(2):76-78. Zhu XH, Liu L, Xu WQ. Meta-analysis of the relationship between periodontitis and diabetes[J]. J Dent Prevent Treat,2014, 22(2):76-78.
[4] Gurav AN. The implication of periodontitis in vascular endothelial dysfunction[J]. Eur J Clin Invest, 2014, 44(10):1000-1009.
[5] Vavricka SR, Manser CN, Hediger S, et al. Periodontitis and gingivitis in inflammatory bowel disease: a case-controlstudy[J]. Inflamm Bowel Dis, 2013, 19(13):2768-2777.
[6] Habashneh RA, Khader YS, Alhumouz MK, et al. The association between inflammatory bowel disease and periodontitis among Jordanians: a case-control study[J]. J Periodont Res, 2012, 47(3):293-298.
[7] Brito F, de Barros FC, Zaltman C, et al. Prevalence of periodontitis and DMFT index in patients with Crohn's disease and ulcerative colitis[J]. J Clin Periodontol, 2008, 35(6): 555-560.
[8] Chassaing B, Gewirtz AT. Gut microbiota, low-grade inflammation, and metabolic syndrome[J]. Toxicol Pathol,2014, 42(1):49-53.
[9] Nakajima M, Arimatsu K, Kato T, et al. Oral administration of P. gingivalis induces dysbiosis of gut microbiota and impaired barrier function leading to dissemination of enterobacteria to the liver[J]. PLoS One, 2015, 10(7):e0134234.
[10] Arimatsu K, Yamada H, Miyazawa H, et al. Oral pathobiont induces systemic inflammation and metabolic changes associated with alteration of gut microbiota[J]. Sci Rep, 2014,4:4828.
[11] Kimura S, Nagai A, Onitsuka T, et al. Induction of experimental periodontitis in mice with Porphyromonas gingivalisadhered ligatures[J]. J Periodontol, 2000, 71(7):1167-1173.
[12] Belzer C, Gerber GK, Roeselers G, et al. Dynamics of the microbiota in response to host infection[J]. PLoS One, 2014,9(7):e95534.
[13] Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Res, 2013, 41(Database issue):D590-D596.
[14] Anderson JM, Van Itallie CM. Tight junctions and the molecular basis for regulation of paracellular permeability[J]. Am J Physiol, 1995, 269(4 Pt 1):G467-G475.
[15] Barnich N, Aguirre JE, Reinecker HC, et al. Membrane recruitment of NOD2 in intestinal epithelial cells is essential for nuclear factor-κB activation in muramyl dipeptide recognition[J]. J Cell Biol, 2005, 170(1):21-26.
[16] Zhang K, Hornef MW, Dupont A. The intestinal epithelium as guardian of gut barrier integrity[J]. Cell Microbiol, 2015,17(11):1561-1569.
[17] Robertson BR, O'Rourke JL, Neilan BA, et al. Mucispirillum schaedleri gen. nov., sp. nov., a spiral-shaped bacterium colonizing the mucus layer of the gastrointestinal tract of laboratory rodents[J]. Int J Syst Evol Microbiol, 2005, 55 (Pt 3):1199-1204.
[18] Kumar PS, Griffen AL, Barton JA, et al. New bacterial species associated with chronic periodontitis[J]. J Dent Res,2003, 82(5):338-344.
[19] Siqueira JF, Rocas IN, Cunha CD, et al. Novel bacterial phylotypes in endodontic infections[J]. J Dent Res, 2005 (6):565-569.
[20] Walker A, Pfitzner B, Neschen S, et al. Distinct signatures of host-microbial meta-metabolome and gut microbiome in two C57BL/6 strains under high-fat diet[J]. ISME J, 2014,8(12):2380-2396.
[21] Li RW, Wu S, Li W, et al. Alterations in the porcine colon microbiota induced by the gastrointestinal nematode Trichuris suis[J]. Infect Immun, 2012, 80(6):2150-2157.
[22] Berry D, Schwab C, Milinovich G, et al. Phylotype-level 16S rRNA analysis reveals new bacterial indicators of health state in acute murine colitis[J]. ISME J, 2012, 6(11):2091-2106.
[23] Furuse M, Hirase T, Itoh M, et al. Occludin: a novel integral membrane protein localizing at tight junctions[J]. J Cell Biol,1993, 123(6 Pt 2):1777-1788.
[24] Choi YS, Kim YC, Ji S, et al. Increased bacterial invasion and differential expression of tight-junction proteins, growth factors, and growth factor receptors in periodontal lesions[J]. J Periodontol, 2014, 85(8):e313-e322.
[25] Zeissig S, Burgel N, Gunzel D, et al. Changes in expression and distribution of claudin 2, 5 and 8 lead to discontinuous tight junctions and barrier dysfunction in active Crohn's disease[J]. Gut, 2007, 56(1):61-72.
[26] Luettig J, Rosenthal R, Barmeyer C, et al. Claudin-2 as a mediator of leaky gut barrier during intestinal inflammation [J]. Tissue Barriers, 2015, 3(1/2):e977176.
[27] Girardin SE, Boneca IG, Viala J, et al. Nod2 is a general sensor of peptidoglycan through muramyl dipeptide (MDP)detection[J]. J Biol Chem, 2003, 278(11):8869-8872.
[28] Lisowska B, Szymańska M, Nowacka E, et al. Anesthesiology and the cytokine network[J]. Postepy Hig Med Dosw (Online), 2013, 67:761-769.
(本文編輯李彩)
Periodontal inflammation affects the mechanical and immune barrier functions of mice gut
Xie Meilian1, Yu Ting2,Zhuo Ying1, Huang Xin1, Xie Baoyi1, Xuan Dongying1,3, Zhang Jincai1,3.(1. Dept. of Periodontology, The Affiliated Hospital of Stomatology, Southern Medical University, Guangzhou 510280, China; 2. Dept. of Periodontology, The Affiliated Hospital of Stomatology, Guangzhou Medical University, Guangzhou 510150, China; 3. Dept. of Periodontology, Hangzhou Dental Hospital, Savaid Medical School, University of Chinese Academy of Sciences, Hangzhou 310006, China)
Supported by: The National Natural Science Foundation of China (81271160, 81371151, 81470750). Correspondence: Zhang Jincai, E-mail: jincaizhang@live.cn.
ObjectiveTo explore the effects of periodontal inflammation on the functions of gut barrier (ecological barrier,mechanical barrier, and immune barrier) in mice. MethodsTwenty male C57BL/6J mice were randomly divided into periodontitis (P) or control (C) groups. The P group was subjected under a 10-day ligation with Porphyromonas gingivalis to induce periodontitis, whereas the C group was ligated with sham. Maxillae were obtained to assess alveolar bone loss. The phylogenetic structure and diversity of microbial communities in the gut were analyzed by 16s rRNA pyrosequencing. Immunohistochemical analysis was performed to determine the expressions of occludin, claudin2, and NOD2 in the ileum. ResultsCompared with the C group, the P group displayed significant alveolar bone loss (P<0.001). In addition, no significant influence on the main phyla and genus Parabacteroides of the two groups was observed (P>0.05). However, the ileum of the P group showed significantly upregulated occludin, claudin2, and NOD2 (P=0.039, P=0.011, and P=0.039, respectively). Conclusion Periodontal inflammation influences to some extent the mechanical and immune barrier functions of the mice gut.
periodontitis;inflammatory bowel diseases;gut microbiota;mechanical barrier
R 781.4
A
10.7518/hxkq.2016.04.019
2015-12-16;
2016-03-18
國家自然科學基金(81271160,81371151,81470750)
謝美蓮,碩士,E-mail:nymphaea468@126.com
章錦才,教授,博士,E-mail:jincaizhang@live.cn

