RIP1在急性胰腺炎胰腺腺泡細(xì)胞凋亡中的作用探討*
周翔宇,鄭英強(qiáng),何雪梅
(西南醫(yī)科大學(xué)附屬醫(yī)院血管和甲狀腺外科,四川瀘州 646000)
?
RIP1在急性胰腺炎胰腺腺泡細(xì)胞凋亡中的作用探討*
周翔宇,鄭英強(qiáng),何雪梅
(西南醫(yī)科大學(xué)附屬醫(yī)院血管和甲狀腺外科,四川瀘州 646000)
目的探討細(xì)胞凋亡在急性胰腺炎炎癥中的作用及受體相互作用蛋白(RIP)的調(diào)控作用。方法將30只C57小鼠分為3組:對(duì)照組、急性水腫性胰腺炎(AEP)組、急性壞死性胰腺炎(ANP)組。AEP組連續(xù)注射雨蛙素(50 μg/kg)13次;ANP組連續(xù)注射雨蛙素(50 μg/kg)13次,另注射1次脂多糖(15 mg/kg);對(duì)照組注射等量生理鹽水7次。末端脫氧核苷酸轉(zhuǎn)移酶介導(dǎo)的dUTP原位切口末端標(biāo)記法觀察胰腺腺泡細(xì)胞凋亡,實(shí)時(shí)熒光定量PCR法檢測(cè)RIP1 mRNA的表達(dá),蛋白質(zhì)免疫印跡法檢測(cè)RIP1蛋白的表達(dá)。結(jié)果成功建立AEP及ANP小鼠模型。與對(duì)照組比較,2個(gè)胰腺炎模型組均存在細(xì)胞凋亡,且與AEP組比較,ANP組小鼠細(xì)胞凋亡減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。與對(duì)照組比較,AEP組RIP1 mRNA及蛋白表達(dá)均升高,而ANP組降低,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05)。結(jié)論RIP1參與急性胰腺炎的發(fā)病過(guò)程,可能與調(diào)控腺泡細(xì)胞凋亡有關(guān)。
急性胰腺炎;水腫性胰腺炎;壞死性胰腺炎;細(xì)胞凋亡;受體相互作用蛋白
急性胰腺炎是多種病因?qū)е乱让冈谝认賰?nèi)被激活后,引起胰腺組織自身消化、水腫、出血甚至壞死的炎性反應(yīng)。現(xiàn)有的研究認(rèn)為,實(shí)驗(yàn)性胰腺炎炎癥程度與腺泡細(xì)胞的凋亡呈負(fù)相關(guān)[1]。胰腺腺泡細(xì)胞的凋亡對(duì)于急性胰腺炎的臨床轉(zhuǎn)歸是一個(gè)有利的保護(hù)性反應(yīng)[2]。但胰腺腺泡細(xì)胞凋亡的調(diào)控機(jī)制尚不明確。本研究建立急性水腫性胰腺炎(acute edematous pancreatitis,AEP)和急性壞死性胰腺炎(acute necrotizing pancreatitis,ANP)小鼠模型,檢測(cè)兩種模型胰腺腺泡細(xì)胞凋亡及凋亡調(diào)控基因受體相互作用蛋白(receptor interacting protein,RIP)在胰腺腺泡細(xì)胞的表達(dá),進(jìn)一步探討細(xì)胞凋亡在胰腺炎癥中的作用及相關(guān)調(diào)控機(jī)制。
1 材料與方法
1.1實(shí)驗(yàn)動(dòng)物30只雄性C57小鼠購(gòu)自重慶騰鑫生物技術(shù)有限公司,10周齡,體質(zhì)量22~24 g。
1.2儀器與試劑雨蛙素和脂多糖均購(gòu)自美國(guó)Sigma公司,血清淀粉酶和脂肪酶檢測(cè)試劑盒均購(gòu)自南京建成生物制品研究所,Trizol及SYBR Green Master Mix試劑均購(gòu)自美國(guó)Life Technologies公司,StepOne Plus實(shí)時(shí)熒光定量PCR系統(tǒng)購(gòu)自美國(guó)ABI公司,熒光定量PCR試劑盒購(gòu)自日本TaKaRa公司,末端脫氧核苷酸轉(zhuǎn)移酶介導(dǎo)的dUTP原位切口末端標(biāo)記(TUNEL)試劑盒購(gòu)自瑞士Roche公司,RIP單克隆抗體和內(nèi)參β-actin抗體購(gòu)自美國(guó)Santa Cruz公司,二抗購(gòu)自美國(guó)Abcom公司。
1.3方法
1.3.1模型建立急性胰腺炎動(dòng)物模型的建立參考文獻(xiàn)[3]。將所有動(dòng)物于實(shí)驗(yàn)前適應(yīng)性喂養(yǎng)1周,術(shù)前禁食12 h,自由飲水。將30只小鼠分為3組:對(duì)照(CON)組、AEP組、ANP組。AEP組小鼠腹腔注射雨蛙素50 μg/kg,連續(xù)7次,每次間隔1 h;ANP組小鼠腹腔注射雨蛙素50 μg/kg,連續(xù)13次,每次間隔1 h,在最后1次注射雨蛙素時(shí)加注1次脂多糖(15 mg/kg);CON組腹腔注射與雨蛙素相同劑量的生理鹽水,注射7次。
1.3.2標(biāo)本收集和組織學(xué)檢測(cè)于最后1次注射后3 h用3%戊巴比妥鈉(0.1 mL/100 g)行腹腔內(nèi)注射麻醉,下腔靜脈抽取血液0.5~1.0 mL,3 000 r/min離心10 min分離血漿,試劑盒測(cè)定血清淀粉酶和脂肪酶含量。取胰腺組織,常規(guī)固定,石蠟包埋,連續(xù)切片,蘇木素-伊紅(HE)染色,行病理檢查。
1.3.3TUNEL法檢測(cè)胰腺腺泡細(xì)胞凋亡每只小鼠蠟塊任選3張切片,二甲苯脫蠟后,按照說(shuō)明書測(cè)定細(xì)胞凋亡情況。加 TUNEL反應(yīng)液,再加入轉(zhuǎn)化劑-POD(converter-POD),然后與二氨基聯(lián)苯胺(DAB)反應(yīng)顯色,光學(xué)顯微鏡觀察并計(jì)數(shù)。TUNEL陽(yáng)性表達(dá)率=陽(yáng)性表達(dá)細(xì)胞數(shù)/細(xì)胞總數(shù)×100%。
1.3.4實(shí)時(shí)熒光定量PCR檢測(cè)RIP mRNA的表達(dá)取胰腺組織,每塊1 cm3,迅速置于-80 ℃凍存。引物序列,RIPF:5′-CGG GTG TCA GGA ATC AAA TC-3′,RIPR:5′-TGG AAG GTC TCG CAA ATA CTG-3′;β-actinF:5′-AGG GTG TGA TGG TGG GAA T-3′,β-actin R:5′-CTC GGT GAG CAG CAC AGG-3′。按照RNA抽提試劑盒的操作步驟,取凍存胰腺組織50 mg提取總RNA,并利用紫外分光光度計(jì)對(duì)提取的RNA濃度進(jìn)行測(cè)定,并制備cDNA。采用實(shí)時(shí)熒光定量PCR法檢測(cè)RIP mRNA。經(jīng)過(guò)最后的循環(huán)后,用PCR擴(kuò)增儀自帶軟件進(jìn)行熒光定量分析。實(shí)時(shí)熒光定量PCR檢測(cè)結(jié)果使用比較閾值法進(jìn)行定量分析,分析方法采用2-△△Ct方法。
1.3.5蛋白質(zhì)免疫印跡(Western blotting)檢測(cè)RIP蛋白在胰腺組織的表達(dá)按蛋白提取試劑盒說(shuō)明書提取各組小鼠胰腺組織總蛋白。蛋白濃度由二喹啉甲酸(BCA)蛋白濃度測(cè)定試劑盒測(cè)定。對(duì)所提取的蛋白樣品進(jìn)行電泳、轉(zhuǎn)膜、封閉后,加入一抗,4 ℃孵育過(guò)夜。加入過(guò)氧化物酶(HRP)標(biāo)記的二抗,電化學(xué)發(fā)光(ECL)法顯色。用Quantity One軟件測(cè)定各條帶的積分吸光度值。鼠單克隆抗體β-actin作為內(nèi)參對(duì)照。
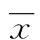
2 結(jié) 果
2.1病理切片觀察AEP組小鼠胰腺呈現(xiàn)典型AEP改變,小葉間隙增寬、水腫、充血,有中性粒細(xì)胞和單核細(xì)胞浸潤(rùn),腺泡細(xì)胞腫脹,但小葉結(jié)構(gòu)完好,未見(jiàn)明顯出血壞死,部分細(xì)胞內(nèi)脂質(zhì)空泡形成。ANP組小鼠胰腺組織結(jié)構(gòu)破壞明顯,小葉排列紊亂,葉間有明顯的炎性反應(yīng)、水腫,小葉邊緣區(qū)大量腺泡細(xì)胞壞死,局部有融合性壞死灶,局部血管壁出血、壞死,脂肪組織壞死。CON組病理切片未見(jiàn)明顯異常。見(jiàn)圖1。
2.2各組血清淀粉酶及脂肪酶水平比較AEP組與ANP組小鼠血清淀粉酶及脂肪酶水平較對(duì)照組均升高,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05);且ANP組小鼠血清淀粉酶及脂肪酶水平均高于AEP組,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05)。見(jiàn)表1。
2.3各組胰腺組織凋亡率比較TUNEL法檢測(cè)對(duì)小鼠胰腺組織凋亡情況,凋亡細(xì)胞的核呈棕黃色,染色質(zhì)凝聚、濃縮。與對(duì)照組相比較,胰腺炎造模小鼠胰腺腺泡細(xì)胞凋亡增加,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與AEP組比較,ANP組中TUNEL陽(yáng)性表達(dá)細(xì)胞減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見(jiàn)圖2。

A:CON組;B:AEP組;C:ANP組。
圖1各組小鼠胰腺病理學(xué)改變(HE染色,×200)

A:CON組;B:AEP組;C:ANP組。
圖2TUNEL法檢測(cè)各組小鼠胰腺腺泡細(xì)胞凋亡(DAB染色,×200)
2.4RIP1 mRNA的表達(dá)各組小鼠胰腺組織RIP1 mRNA表達(dá)水平,見(jiàn)圖3。與對(duì)照組(2-△△Ct值為1.00)比較,AEP組胰腺組織RIP mRNA表達(dá)水平(2-△△Ct值為1.90)增加;ANP組小鼠胰腺組織RIP mRNA表達(dá)(2-△△Ct值為0.30)較AEP組減少。
2.5RIP1蛋白的表達(dá)各組胰腺組織RIP蛋白的表達(dá),見(jiàn)圖4。AEP組小鼠胰腺組織RIP蛋白表達(dá)較對(duì)照組明顯增加;與AEP組比較,ANP組胰腺組織RIP蛋白的表達(dá)明顯減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。

表1 各組小鼠血清淀粉酶及脂肪酶水平比較
*:P<0.05,與CON組比較;#:P<0.05,與AEP組比較。

*:P<0.01,與CON組比較。
圖3各組小鼠胰腺組織RIP1 mRNA表達(dá)

圖4 各組小鼠胰腺組織RIP1蛋白的表達(dá)
3 討 論
急性胰腺炎臨床病變程度輕重不等,輕者以胰腺水腫為主,臨床多見(jiàn),病情常呈自限性,預(yù)后良好。而重癥患者胰腺病變常表現(xiàn)為出血壞死,臨床經(jīng)過(guò)兇險(xiǎn),死亡風(fēng)險(xiǎn)高。胰腺病理變化的輕重程度和急性胰腺炎的臨床表現(xiàn)密切相關(guān),但是調(diào)控胰腺炎癥嚴(yán)重程度的具體因素尚不明確。本研究成功建立了水腫型和壞死型兩種急性胰腺炎小鼠模型,探討這兩種不同炎癥程度急性胰腺炎的可能影響因素。
腺泡細(xì)胞死亡是急性胰腺炎癥過(guò)程中的重要病理特征,因此探討腺泡細(xì)胞死亡的機(jī)制具有重要意義[4]。研究認(rèn)為,腺泡細(xì)胞的壞死和凋亡共同存在于急性胰腺炎的不同病理類型中。凋亡是受調(diào)控的細(xì)胞自主的程序性死亡,胰腺腺泡細(xì)胞凋亡可保護(hù)腺泡細(xì)胞損傷,并可減輕胰腺炎癥程度[5]。本研究發(fā)現(xiàn),AEP小鼠胰腺腺泡細(xì)胞凋亡較ANP小鼠明顯增多,顯示胰腺炎性病變的嚴(yán)重度和細(xì)胞凋亡呈負(fù)相關(guān),誘導(dǎo)胰腺腺泡細(xì)胞的凋亡可能在一定程度上減輕胰腺的炎癥程度。
過(guò)去細(xì)胞壞死被視為不受信號(hào)調(diào)控的無(wú)序過(guò)程,而最近的研究證實(shí)細(xì)胞壞死也存在程序性調(diào)控,稱為程序性壞死。RIP是一種絲氨酸/蘇氨酸蛋白激酶,在細(xì)胞的凋亡與存活、程序性壞死等過(guò)程中發(fā)揮著關(guān)鍵性的作用[6]。RIP1為RIP家族中的第1個(gè)成員,其介導(dǎo)的細(xì)胞程序性壞死在調(diào)控細(xì)胞死亡中起重要作用,抑制RIP1可以減輕壞死性細(xì)胞死亡,這已經(jīng)被有關(guān)腦出血、肝臟缺血再灌注、小腸缺血等體內(nèi)和(或)體外的研究所證實(shí)[7-8]。有關(guān)RIP1在胰腺炎中的作用,以往研究用雨蛙素誘導(dǎo)胰腺炎,RIP水平和細(xì)胞壞死程度直接相關(guān)。Liu等[9]通過(guò)體外實(shí)驗(yàn)也證實(shí)RIP1可介導(dǎo)細(xì)胞壞死。本研究則是分別用雨蛙素及雨蛙素加脂多糖誘導(dǎo)不同的胰腺炎模型,探討RIP1的表達(dá)情況。結(jié)果顯示:AEP小鼠胰腺組織中RIP1 mRNA及蛋白表達(dá)均較ANP小鼠明顯增加,證實(shí)RIP1參與了急性胰腺炎的發(fā)生、發(fā)展過(guò)程。相較于單獨(dú)使用雨蛙素,加用脂多糖后,基因水平和蛋白水平都證實(shí)RIP1表達(dá)明顯降低,說(shuō)明脂多糖抑制了RIP1的表達(dá)。
有關(guān)壞死調(diào)控蛋白R(shí)IP1在胰腺炎中的具體作用機(jī)制,目前尚不清楚。Yao等[10]研究證實(shí),RIP1通過(guò)調(diào)節(jié)死亡受體介導(dǎo)巨噬細(xì)胞的自噬和凋亡。在胰腺癌細(xì)胞中敲除RIP1后,原本對(duì)腫瘤壞死因子相關(guān)的凋亡誘導(dǎo)配體(TRAIL)誘導(dǎo)凋亡抵制的細(xì)胞變得對(duì)TRAIL誘導(dǎo)凋亡異常的敏感,說(shuō)明RIP1有抑制細(xì)胞凋亡的作用[11]。Nikseresht等[12]也證實(shí),抑制RIP1可減輕脂多糖誘導(dǎo)的細(xì)胞凋亡。其機(jī)制是,抑制RIP1發(fā)揮抗炎效應(yīng),且增加了抗氧化活性[12]。結(jié)合本研究結(jié)果,AEP組小鼠的細(xì)胞死亡以凋亡為主,壞死較少,而調(diào)控程序性死亡的RIP1卻明顯增加;ANP組小鼠的細(xì)胞死亡以壞死為主,凋亡較少,此時(shí)RIP1卻明顯減少。造成這種差異的原因目前尚不清楚,筆者推測(cè)可能是AEP過(guò)程中細(xì)胞壞死更多接受程序性調(diào)控,而ANP可能以非程序性調(diào)控壞死為主。是否RIP1介導(dǎo)的程序性死亡和細(xì)胞凋亡通過(guò)相互調(diào)控而發(fā)揮作用,其具體的機(jī)制是后續(xù)研究關(guān)注的重點(diǎn)。
[1]Xu P,Lou XL,Chen C,et al.Effects of peroxisome proliferator-activated receptor-γ activation on apoptosis in rats with acute pancreatitis[J].Dig Dis Sci,2013,58(12):3516-3523.
[2]Fortunato F,Bürgers H,Bergmann F,et al.Impaired autolysosome formation correlates with Lamp-2 depletion: role of apoptosis,autophagy,and necrosis in pancreatitis[J].Gastroenterology,2009,137(1):350-360.
[3]鄭英強(qiáng),黃娟,曾凡才,等.雨蛙素及脂多糖在小鼠急性胰腺炎建模中的應(yīng)用[J].世界華人消化雜志,2014,22(27):4068-4074.
[4]Lewarchik CM,Orabi AI,Jin S,et al.The ryanodine receptor is expressed in human pancreatic acinar cells and contributes to acinar cell injury[J].Am J Physiol Gastrointest Liver Physiol,2014,307(5):G574-G581.
[5]Li N,Wu X,Holzer RG,et al.Loss of acinar cell IKKα triggers spontaneous pancreatitis in mice[J].J Clin Invest,2013,123(5):2231-2243.
[6]Dhingra R,Lin J,Kirshenbaum LA.Disruption of RIP1-FADD complexes by microRNA-103/107 provokes necrotic cardiac cell death[J].Circ Res,2015,117(4):314-316.
[7]Su X,Wang H,Kang D,et al.Necrostatin-1 ameliorates intracerebral hemorrhage-induced brain injury in mice through inhibiting RIP1/RIP3 pathway[J].Neurochem Res,2015,40(4):643-650.
[8]Matsuoka Y,Tsujimoto Y.Role of RIP1 in physiological enterocyte turnover in mouse small intestine via nonapoptotic death[J].Genes Cells,2015,20(1):11-28.
[9]LiuY,YangL,ChenKL,etal.Knockdown
of GRP78 promotes apoptosis in pancreatic acinar cells and attenuates the severity of cerulein and LPS induced pancreatic inflammation[J].PLoS One,2014,9(3):e92389.
[10]Yao Z,Zhang P,Guo H,et al.RIP1 modulates death receptor mediated apoptosis and autophagy in macrophages[J].Mol Oncol,2015,9(4):806-817.
[11]Humphries F,Yang S,Wang B,et al.RIP kinases: key decision makers in cell death and innate immunity[J].Cell Death Differ,2015,22(2):225-236.
[12]Nikseresht S,Khodagholi F,Nategh M,et al.RIP1 inhibition rescues from LPS-induced RIP3-mediated programmed cell death,distributed energy metabolism and spatial memory impairment[J].J Mol Neurosci,2015,57(2):219-230.
Study on role of RIP1 in apoptosis of pancreatic acinar cell in acute pancreatitis*
ZhouXiangyu,ZhengYingqiang,HeXuemei
(DepartmentofVascularandThyroidSurgery,AffiliatedHospitalofSouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
ObjectiveTo investigate the role of apoptosis and the regulating role of receptor interacting protein 1(RIP1) in acute pancreatitis.MethodsThirty C57 mice were divided into three groups: control group,acute edematous pancreatitis (AEP) group and acute necrotizing pancreatitis (ANP) group.The AEP group was continuously injected by cerulein 50 μg/kg for 13 times,the ANP group was continuously injected by cerulein 50 μg/kg for 13 times and lipopolysaccharide 15 mg/kg once; the control group was injected by the same volume of normal saline for 7 times.The acinar cell apoptosis was observed by the terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate nick-end labeling (TUNEL) assay.The RIP1 mRNA expression was measured by real time fluorescence PCR.The expression of RIP1 protein was detected by Western blotting.ResultsThe mouse models of AEP and ANP were established successfully.Compared with the control group,acinar cell apoptosis existed in both AEP and ANP model groups,moreover compared with the AEP group,apoptosis in the ANP group were decreased,the differences were statistically significant(P<0.05).Compared with the control group,the expression of RIP1 mRNA and protein in the AEP group was increased,while which in the ANP group were decreased,the differences were statistically significant(P<0.05).ConclusionRIP1 participate in the pathogenesis of acute pancreatitis,which may associate with acinar cell apoptosis.
acute pancreatitis;edematous pancreatitis;necrotizing pancreatitis;apoptosis;receptor interacting protein
國(guó)家自然科學(xué)基金資助項(xiàng)目(81100272);四川省科技廳基金資助項(xiàng)目(2014JY0004)。作者簡(jiǎn)介:周翔宇(1977-),副主任醫(yī)師,博士,主要從事急性胰腺炎發(fā)病機(jī)制與免疫相關(guān)研究。
R576
A
1671-8348(2016)21-2894-03
2016-01-26
2016-04-13)
論著·基礎(chǔ)研究doi:10.3969/j.issn.1671-8348.2016.21.004

