新型含異惡唑環的1,3,5-三嗪類衍生物的合成及其抗真菌活性
馮菊紅, 丁 濤, 榮 霞, 龔 昕, 巨修練
(武漢工程大學 化工與制藥學院 教育部綠色化工過程重點實驗室,湖北 武漢 430074)
?
·研究論文·
新型含異惡唑環的1,3,5-三嗪類衍生物的合成及其抗真菌活性
馮菊紅, 丁濤, 榮霞, 龔昕, 巨修練*
(武漢工程大學 化工與制藥學院 教育部綠色化工過程重點實驗室,湖北 武漢430074)
摘要:以三聚氯氰為原料,依次與取代胺和惡霉靈經逐級取代反應合成了17個新型的含異惡唑環的1,3,5-三嗪類衍生物(3a~3q),其結構經1H NMR和ESI-MS表征。抗真菌活性測試結果表明:在用藥量為300 μg·mL-1時,2-(5-甲基異惡唑基-3-)氧基-4-(鄰氯苯胺基)-6-氯-1,3,5-三嗪(3l )對禾谷鐮刀病菌的抑制率為65%。
關鍵詞:三聚氯氰; 異惡唑; 三嗪類衍生物; 合成; 抗真菌活性
雜環類化合物具有廣泛的生物活性,是新型農藥開發的熱點。異惡唑含氮雜環化合物已被開發成除草劑、殺蟲劑和殺菌劑等農用化學品[1-3]。其中惡霉靈(3-羥基-5-甲基異惡唑)是目前開發最成功的內吸型殺菌劑,具有高效、低毒、廣譜和低殘留等特點,惡霉靈衍生物也顯示出不同的生物活性,故異惡唑環常作為良好的藥效團被引入到化合物中[4-6]。
本課題組曾利用活性亞結構拼接原理,將活性基團2-三氟甲基苯胺基-1,3,5-三嗪與惡霉靈的異惡唑環進行拼接,得到4個含有異惡唑環的三嗪類衍生物,生物活性測試結果表明:該類化合物對草坪褐斑病菌(Rhizoctonia solani AG-1-IB)有較好的抑制性,其中有2個化合物的殺菌活性強于陽性對照物惡霉靈[7]。
鑒于此,本文對該類化合物進行結構改造,將2-位的三氟甲基苯胺基改為其他取代的脂肪胺基或芳香胺基,考察不同胺基對抗真菌活性的影響。以三聚氯氰(1)為原料,依次與取代胺和惡霉靈進行逐級取代反應合成了17個含有異惡唑環的三嗪類衍生物(3a~3q, Scheme 1),其結構經1H NMR和ESI-MS表征。并采用平皿生長速率法對其進行了抗真菌活性測試。
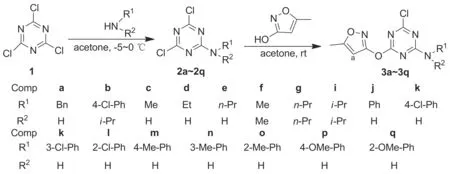
Scheme 1
1實驗部分
1.1儀器與試劑
RY-1G型熔點儀(溫度未校正);Agilent 400MR型核磁共振儀(400 MHz, CDCl3為溶劑,TMS為內標);TRACEMS 2000型質譜儀。
油菜核盤病菌(Sclerotiniasclerotiorum)和禾谷鐮刀病菌(FusariumgraminearumSchw),華中農業大學生物科技學院提供;1,武漢格奧化學試劑有限公司;惡霉靈,延邊綠洲化工有限公司;TLC薄層硅膠板和柱層析硅膠,青島海洋硅膠干燥劑廠;其余所用試劑均為分析純。
1.2合成
(1) 2a~2q的合成通法[8]
將1 1.85 g(10 mmol)溶于丙酮15 mL中,溫度控制在-5~0 ℃,攪拌下緩慢滴加取代胺10 mmol的丙酮(15 mL)溶液,滴畢,于-5~0 ℃反應3 h。過濾,濾餅用丙酮洗滌,濾液蒸干得粗品,經硅膠柱層析[梯度洗脫劑:A=V(石油醚)∶V(乙酸乙酯)=12 ∶1~10 ∶1]純化得2a~2q,收率31.5%~63.7%。
(2) 3a~3q的合成 (以3a為例)
在100 mL三口瓶中依次加入惡霉靈0.46 g(5 mmol),固體碳酸鉀0.49 g(3.55 mmol)和丙酮15 mL,攪拌15 min,緩慢滴加2a 0.9 g(3.5 mmol)的丙酮(15 mL)溶液,于室溫反應6 h。過濾,濾液蒸干后得棕褐色黏稠粗品,經硅膠柱層析(洗脫劑:A=8 ∶1)純化得3a 0.57 g。
用類似方法合成3b~3q。
2-(5-甲基異惡唑基-3-)氧基-4-(芐胺基)-6-氯-1,3,5-三嗪(3a): 白色粉末,收率49.0%, m.p.140~142 ℃;1H NMRδ: 8.14~7.76(m, 5H, ArH), 6.07(s, 1H, a-H), 4.35(s, 2H, NCH2), 2.54(s, 3H, CH3); ESI-MSm/z: 318.0{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(對氯苯基異丙基胺基)-6-氯-1,3,5-三嗪(3b): 白色固體,收率61.4%, m.p.185~187 ℃;1H NMRδ: 7.55~7.37(m, 4H, ArH), 5.98(s, 1H, a-H), 4.67(m, 1H, CH ini-Pr), 2.48(s, 3H, CH3), 1.27 (m, 6H, CH3ini-Pr); ESI-MSm/z: 380.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(甲胺基)-6-氯-1,3,5-三嗪(3c): 白色固體,收率37.7%, m.p.184~186 ℃;1H NMRδ: 6.09(s, 1H, a-H), 3.24(s, 3H, NCH3), 2.48(s, 3H, CH3); ESI-MSm/z: 242.0{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(乙胺基)-6-氯-1,3,5-三嗪(3d): 白色晶體,收率38.5%, m.p.109~111 ℃;1H NMRδ: 6.07(s, 1H, a-H), 3.50(q,J=8.0 Hz, 2H, CH2CH3), 2.46(s, 3H, CH3), 1.24(t,J=8.0 Hz, 3H, CH2CH3); ESI-MSm/z: 256.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(正丙胺基)-6-氯-1,3,5-三嗪(3e): 白色固體,收率23.2%, m.p.137~139 ℃;1H NMRδ: 6.05(s, 1H, a-H), 3.13(m, 2H, NCH2), 2.42(s, 3H, CH3), 1.63(m, 2H, CH2CH3), 1.03(t,J=8.0 Hz, 3H, CH2CH3); ESI-MSm/z: 270.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(二甲胺基)-6-氯-1,3,5-三嗪(3f): 白色晶體,收率32.5%, m.p.119~121 ℃;1H NMRδ: 6.07(s, 1H, a-H), 3.24(s, 3H, NCH3), 3.14(s, 3H, NCH3), 2.46(s, 3H, CH3); ESI-MSm/z: 256.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(二正丙胺基)-6-氯-1,3,5-三嗪(3g): 白色固體,收率51.9%, m.p.77~79 ℃;1H NMRδ: 6.02(s, 1H, a-H), 3.16(m, 2H, NCH2), 3.09(m, 2H, NCH2), 2.42(s, 3H, CH3), 1.70~1.63(m, 4H, CH2CH3), 1.05~1.02(m, 6H, CH2CH3); ESI-MSm/z: 312.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(二異丙基胺基)-6-氯-1,3,5-三嗪(3h): 白色晶體,收率48.6%, m.p.95~97 ℃;1H NMRδ: 6.02(s, 1H, a-H), 4.64(m, 1H, CH ini-Pr), 4.12(m, 1H, CH ini-Pr), 2.45(s, 3H, CH3), 1.31~1.25(m, 12H, CH ini-Pr); ESI-MSm/z: 312.0{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(苯胺基)-6-氯-1,3,5-三嗪(3i): 白色固體,收率75.8%, m.p.135~137 ℃;1H NMRδ: 7.77~7.45(m, 5H, ArH), 6.08(s, 1H, a-H), 2.45(s, 3H, CH3); ESI-MSm/z: 304.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(對氯苯胺基)-6-氯-1,3,5-三嗪(3j): 白色固體,收率75.9%, m.p.188~190 ℃;1H NMRδ: 7.60(d,J=8.0 Hz, 2H, ArH), 7.30(d,J=8.0 Hz, 2H, ArH), 6.06(s, 1H, a-H), 2.48(s, 3H, CH3); ESI-MSm/z: 338.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(間氯苯胺基)-6-氯-1,3,5-三嗪(3k): 白色固體,收率71.4%, m.p.151~153 ℃;1H NMRδ: 7.25~7.00(m, 2H, ArH), 6.96(s, 1H, ArH), 6.64(d,J=7.0 Hz, 1H, ArH), 5.86(s, 1H, a-H), 2.03(s, 3H, CH3); ESI-MSm/z: 338.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(鄰氯苯胺基)-6-氯-1,3,5-三嗪(3l): 淡黃色粉末,收率65.8%, m.p.137~139 ℃;1H NMRδ: 7.32~7.10(m, 2H, ArH), 6.82(dd,J=7.2 Hz, 8.0 Hz, 1H, ArH), 6.71(dd,J=7.2 Hz, 7.6 Hz, 1H, ArH), 5.95(s, 1H, a-H), 2.45(s, 3H, CH3); ESI-MSm/z: 338.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(對甲基苯胺基)-6-氯-1,3,5-三嗪(3m): 白色片狀固體,收率75.0%, m.p.144~146 ℃;1H NMRδ: 7.81~7.69(m, 2H, ArH), 7.46(d,J=7.2 Hz, 2H, ArH), 7.34(d,J=8.0 Hz, 2H, ArH), 6.06(s, 1H, a-H), 2.42(s, 3H, CH3), 2.39(s, 3H, ArCH3); ESI-MSm/z: 317.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(間甲基苯胺基)-6-氯-1,3,5-三嗪(3n): 淡黃色粉末固體,收率81.3%, m.p.128~130 ℃;1H NMRδ: 7.59~7.26(m, 4H, ArH), 6.05(s, 1H, a-H), 2.48(s, 3H, CH3), 2.40(s, 3H, ArCH3); ESI-MSm/z: 317.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(鄰甲基苯胺基)-6-氯-1,3,5-三嗪(3o): 白色顆粒狀固體,收率68.8%, m.p.144~146 ℃;1H NMRδ: 7.27~7.14(m, 4H, ArH), 6.06(s, 1H, a-H), 2.48(s, 3H, CH3), 2.39(s, 3H, ArCH3); ESI-MSm/z: 317.0{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(對甲氧基苯胺基)-6-氯-1,3,5-三嗪(3p): 淡黃色固體,收率65.0%, m.p.138~140 ℃;1H NMRδ: 7.62(d,J=7.6 Hz, 2H, ArH), 6.91(d,J=8.6 Hz, 2H, ArH), 6.02(s, 1H, a-H), 3.93(s, 3H, OCH3), 2.45(s, 3H, CH3); ESI-MSm/z: 333.1{[M+H]+}。
2-(5-甲基異惡唑基-3-)氧基-4-(鄰甲氧基苯胺基)-6-氯-1,3,5-三嗪(3q): 白色固體,收率57.7%, m.p.148~150 ℃;1H NMRδ: 7.57~7.35(m, 4H, ArH), 6.05(s, 1H, a-H), 3.91(s, 3H, OCH3), 2.42(s, 3H, CH3); ESI-MSm/z: 333.1{[M+H]+}。
1.3抗真菌活性測試
采用平皿生長速率法測定3a~3q的抗真菌活性[9]。在150 mL三角瓶中加入PDA培養基60 mL,滅菌備用。用滅菌水配成濃度為300 μg·mL-1的待測樣品,加入培養基中,充分搖勻后倒入直徑為9 cm的滅過菌的培養皿中,每組三個重復,以等量的溶劑為空白對照。以打孔器(內徑5 mm)將生長正常的草坪褐斑菌打孔制成若干菌餅。用接種針將菌餅放于各培養皿中,置于28 ℃無菌恒溫箱內培養。待空白對照接近長滿培養皿時,根據十字交叉法用游標卡尺測量培養皿內菌落直徑,每個處理重復三次,取其平均值作為處理菌落直徑,計算抑菌率。
2結果與討論
2.1 合成與表征
惡霉靈的化學結構存在互變異構現象[10],即烯醇式和酮式(Scheme 2),醇羥基和仲胺基都可以作為官能團進行反應,當惡霉靈作為反應物與中間體2進行取代反應時,可能會出現兩種產物:O-取代和N-取代產物。
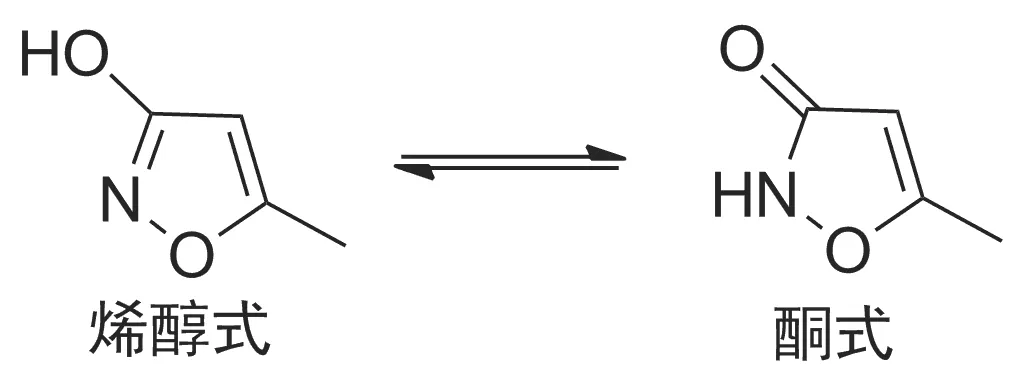
Scheme 2
本文根據惡霉靈區域性選擇反應結果[11-13],以丙酮為溶劑,以無水碳酸鉀為縛酸劑,在室溫條件下進行反應,最終產物的異惡唑雜環的質子吸收峰在δ6.1±0.1,表明產物為O-取代。如果是酮式結構與中間體2進行反應,得到的產物異惡唑雜環的質子峰在δ5.4~5.6。可能是因為烯醇式的異惡唑環為一個芳香雜環體系,故其質子的化學位移在較低場[13]。
2.2 抗真菌活性
3a~3q的抗真菌活性結果見表1。由表1可見,3a~3q對禾谷鐮刀病菌有一定的抑制活性,其中3e, 3i, 3l, 3m的抑菌活性較高;3l的抑菌活性達65%,與陽性對照物惡霉靈的活性相當。
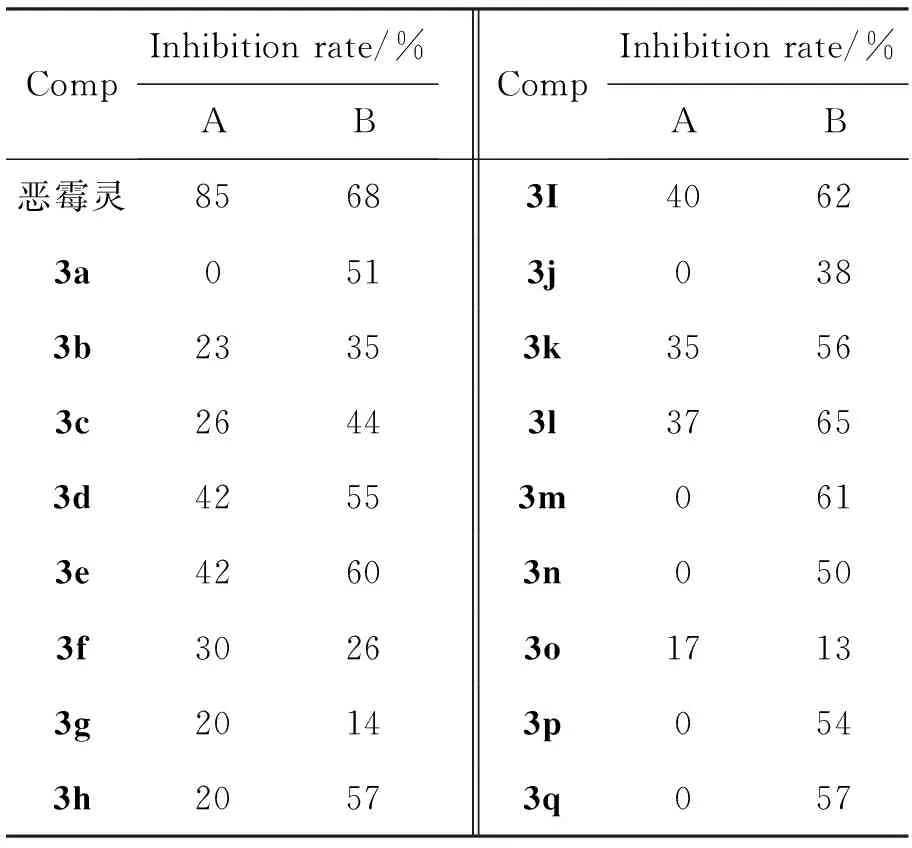
表 1 3a~3q的抗真菌活性*
*A:油菜核盤病菌,B:禾谷鐮刀病菌。
3c, 3d, 3e的抑制活性依次增強,表明胺基取代基的碳鏈增長可以增加其殺菌活性。3f, 3g的活性低于3d和3e,當胺基有兩個取代碳鏈時,可能會降低其活性。胺基為苯基或為脂肪烴基取代,對抑菌活性無影響。
3a~3q對油菜核盤病菌的抑制活性較弱,3a, 3j, 3m, 3n, 3p, 3q沒有顯示活性。3m, 3n, 3p, 3q卻對禾谷鐮刀菌的抑制活性較好,顯示出對這兩種病菌的抑制選擇性。
以三聚氯氰為原料,丙酮為溶劑,依次與取代胺和惡霉靈發生逐級取代反應合成了17個新型的含有異惡唑環的三嗪類衍生物(3a~3q)。初步抗真菌活性測試結果表明:(3a~3q)對禾谷鐮刀病菌的抑制率普遍高于對油菜核盤病菌的抑制率;用藥量為300 μg·mL-1時,2-(5-甲基異惡唑基-3-)氧基-4-(鄰氯苯胺基)-6-氯-1,3,5-三嗪(3l)對禾谷鐮刀病菌的抑制率為65%。該研究結果對該類化合物的構效關系研究奠定了基礎。
參考文獻
[1]Liu Y X, Cui Z P, Liu B,etal. Design,synthesis and herbicidal activities of novel 2-cyanoacrylates containing isoxazole moieties[J].J Agr Food Chem,2010,58(5):2685-2689.
[2]Upadhyay A, Gopal M, Srivastava C,etal. Isoxazole derivatives as a potential insecticide for managing Callosobruchus chinensis[J].J Pest Sci,2010,35(4):464-469.
[3]Sun R F, Li Y Q, Xiong L X,etal. Design,synthesis and insecticidal evaluation of new benzoylureas containing isoxazoline and isoxazole group[J].J Agr Food Chem,2011,59(9):4851-4859.
[4]Miyake T, Yagasaki Y, Nakashima K,etal. Potential fungicidal activity of 3-(substituted oxy)-t-methylisoxazoles[J].J Pest Sci,2013,38(3):96-104.
[5] Miyake T, Yagasaki Y, Kagabu S. Potential new fungicides:N-acyl-5-methyl-3(2H)-isoxazolone derivatives[J].J Pest Sci,2012,37(1):89-94.
[6]李俊凱,徐漢虹,譚堂峰,等. 乙酰水楊酸與殺菌劑的藕合物合成及生物活性[J].農藥學學報,2008,10(2):196-199.
[7]馮菊紅,丁濤,榮霞,等. 1,3,5-三嗪衍生物的合成及殺菌活性[J].武漢工程大學學報(自然科學版),2013,35(4):35-38.
[8]余勇,王凱,巨修練. 6-氯吡啶-3-亞甲基取代雜環化合物的合成[J].合成化學,2008,16(3):277-281.
[9]韓新才,張懿月,嚴慶慶,等. 在草坪褐斑病新殺菌劑毒力測定中安全助溶溶劑的篩選[J].農藥,2014,53(11):842-844.
[10]覃兆海,毛淑芬,梁曉梅. 惡霉靈互變異構現象研究[J]. 波譜學雜志,2000,17(2):143-147.
[11]Shao R L, Zhi C X, Zhu Y Q,etal. Highly regioselectiveO- andN-acylation of 5-methyl-3-hydroxyisoxazole[J].Chin Chem Lett,1992,3(3):175-176.
[12]Janin Y L, Huel C, Flad G,etal. Methyl orthocarboxylates as methylating agents of heterocycles[J].Eur J Org Chem,2002,(11):1763-1769.
[13]邵瑞鏈,職承信. 3-羥基異惡唑的O-和N-酰化及其區域選擇性研究II.3-羥基-5-甲基異惡唑O-和N-酰化產物的選擇性合成[J].化學學報,1993,51(12):1203-1208.
收稿日期:2016-01-05
基金項目:湖北省教育廳科學技術研究計劃優秀中青年人才項目(Q20091505)
作者簡介:馮菊紅(1977-),女,漢族,湖北襄陽人,博士,主要從事藥物化學研究。 E-mail: jhfeng@wit.edu.cn 通信聯系人: 巨修練,教授, Tel. 027-87194980, E-mail: xiulianju2008@yahoo.com.cn
中圖分類號:O626; O621.3
文獻標志碼:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.07.15323
Synthesis and Antifungal Activities of Novel 1,3,5-Triazine Derivatives Containing Isoxazole Ring
FENG Ju-hong,DING Tao,RONG Xia,GONG Xin,JU Xiu-lian*
(Key Laboratory for Green Chemical Process of Ministry of Education,School of Chemical Engineering and Pharmacy, Wuhan Institute of Technology, Wuhan 430074, China)
Abstract:Seventeen novel 1,3,5-triazine derivatives(3a~3q) containing isoxazole ring were synthesized by the substitution reaction of cyanuric chloride with substituted amines and hymexazol, respectively. The structures were characterized by1H NMR and ESI-MS. Antifungal activities tests showed that inhibition rate of 2-[(5-methylisoxazol-3-yl)oxy]-4-(2-chlorophenyl)-6-chloro-1,3,5-triazine(3l) against Sclerotinia sclerotiorum was 65% at 300 μg·mL-1。
Keywords:cyanuric chloride; isoxazole; triazine derivative; synthesis; antifungicidal activity

