當歸紅芪超濾膜提取物對過氧化氫致PC12細胞凋亡的影響
朱貝貝,劉萍萍,李淑玲,劉凱,,李應東,
1.甘肅中醫藥大學中西醫結合研究所,甘肅 蘭州 730000;2.甘肅中醫藥大學附屬醫院省級重點實驗室,甘肅 蘭州 730000
當歸紅芪超濾膜提取物對過氧化氫致PC12細胞凋亡的影響
朱貝貝1,劉萍萍2,李淑玲1,劉凱1,2,李應東1,2
1.甘肅中醫藥大學中西醫結合研究所,甘肅 蘭州 730000;2.甘肅中醫藥大學附屬醫院省級重點實驗室,甘肅 蘭州 730000
目的觀察當歸紅芪超濾膜提取物對過氧化氫(H2O2)致PC12細胞凋亡的影響,探討其作用機制。方法H2O2誘導PC12細胞凋亡,構建氧化損傷神經細胞凋亡模型。實驗分為正常對照組、模型組及中藥低、中、高劑量組,中藥各組給予不同劑量當歸紅芪超濾膜提取物。流式細胞術檢測細胞凋亡率,激光共聚焦顯微鏡檢測細胞線粒體膜電位變化,Western blot檢測Bax、Bcl-2和cleaved Caspase-3的蛋白表達。結果與模型組比較,中藥各劑量組細胞凋亡率明顯降低,線粒體膜電位升高,Bax、cleaved Caspase-3蛋白表達均減弱,Bcl-2表達增強,Bcl-2/Bax比值升高(P<0.05)。結論當歸紅芪超濾膜提取物具有抗H2O2誘導的PC12細胞凋亡的作用。
當歸紅芪超濾膜提取物;過氧化氫;PC12細胞;凋亡
當歸紅芪超濾膜提取物(ultra-filtration extract from Angelica Sinensis Radix and Hedysari Radix,UFE-AH)具有抗自由基、抗氧化損傷等功效[1-4]。過氧化氫(H2O2)是活性氧族(ROS)的主要成分之一,能夠損傷生物膜和線粒體,是建立細胞氧化應激損傷模型、誘導細胞凋亡一種比較常用的誘導劑。本研究以PC12細胞株為研究對象,采用H2O2誘導PC12細胞凋亡,不同濃度UFE-AH進行干預,通過檢測細胞凋亡率和線粒體跨膜電位及 Bcl-2、Bax、cleaved Caspase-3蛋白表達,觀察UFE-AH對H2O2致PC12細胞凋亡的影響,探討其作用機制。
1 實驗材料
1.1 細胞株和藥物
PC12細胞,中國科學院上海細胞庫。PC12細胞常規培養,完全培養基(DMEM培養基,10%胎牛血清,青霉素 100 U/mL,鏈霉素 100 mg/mL),置于37 ℃、5%CO2培養箱中,每隔36 h換液,細胞貼壁生長至 80%密度時,0.25%胰蛋白酶消化傳代。UFE-AH,甘肅中醫藥大學科研實驗中心和甘肅省膜科學研究院聯合制備,藥物成分為多糖39.9%、皂苷3.5%、其他56.6%,高效液相檢測指紋圖譜進行質控:樣品用50%甲醇溶解,微波助溶,Inertsil ODS-SP G8色譜柱(5 μm,4.6 mm×150 mm),檢測波長275 nm,甲醇-0.1%磷酸水溶液,梯度洗脫(0~20 min,3∶97;20~40 min,20∶80;40~50 min,60∶40;50~60 min,90∶10)[5-6]。
1.2 試劑
30%H2O2溶液,天津富宇試劑有限公司;胎牛血清、DMEM高糖培養基,賽默飛世爾生物化學制品有限公司;鏈霉素、青霉素,華北制藥股份有限公司;磷酸緩沖液配制粉,北京中杉金橋生物技術有限公司;1∶250胰蛋白酶,GIBCO公司;AnnexinV-FITC/PI雙染細胞凋亡檢測試劑盒,德國Miltenyi生物有限公司;二甲基亞砜、MTT試劑、羅丹明123染液、兔抗 Bax多克隆抗體、兔抗 Bcl-2多克隆抗體、兔抗Caspase-3多克隆抗體,美國Sigma公司;辣根過氧化酶標記羊抗兔IgG,武漢博士德生物工程有限公司;PVDP膜,加拿大BBI公司。
1.3 儀器
BB16UVCO2培養箱(德國 Heraeus公司),Infinite200 PRO序列多功能酶標儀(Tecan奧地利有限責任公司),PowerPac Universal型電泳儀、Mini Protean 3 Cell小型電泳槽、小型Trans-Blot轉印槽(美國Bio-Rad公司);AIPhalmager 2200型凝膠成像分析系統(美國AIPha公司),DYCP3lD型電泳槽、DYY-12型電腦三恒多用電泳儀(北京六一儀器廠),XL型流式細胞儀(美國Coulter公司),FV1000激光共聚焦顯微鏡(日本Olympus公司)。
2 實驗方法
2.1 過氧化氫誘導 PC12細胞凋亡劑量及作用時間選擇
選取對數生長期PC12細胞,接種于96孔板中,完全培養基中加入0、50、100、200、300、400 μmol/L H2O2,置于細胞培養箱中培養3、6、12、24 h,MTT法檢測各組細胞活力,確定本實驗 H2O2誘導 PC12細胞凋亡的時間及濃度。
2.2 當歸紅芪超濾膜提取物劑量選擇
取對數生長期的PC12細胞,接種于96孔板中,完全培養基中加入0、0.19、0.38、0.75、1.5、3.0g/L UFE-AH,置于細胞培養箱中培養24 h,MTT法檢測各組細胞活力,確定本實驗UFE-AH的劑量。
2.3 分組、造模及給藥
H2O2誘導PC12細胞凋亡,構建氧化損傷神經細胞凋亡模型。實驗分為正常對照組(正常培養 PC12細胞)、模型組(培養基中加200 μmol/L H2O2)和中藥低、中、高低劑量組。中藥低、中、高低劑量組分別加入0.38、0.75、1.50g/L的UFE-AH,培養6 h。
2.4 流式細胞術檢測細胞凋亡
吸棄舊培養基,加PBS 2mL沖洗后吸棄;消化收集細胞懸液至EP管,1000 r/min離心5 min;吸棄上清液,加生理鹽水1mL吹勻成細胞懸液;1000 r/min離心5 min后加緩沖液;加AnnexinV-FITC 5 μL,避光孵育10 min,加碘化丙啶10 μL避光染色5 min,流式細胞儀進行檢測。
2.5 激光共聚焦顯微鏡檢測細胞線粒體膜電位
取生長狀態良好的對數生長期PC12細胞,將其接種于共聚焦專用培養皿中,小心吸棄舊培養基,PBS沖洗3次,吸棄;每孔加入配制好的RH123染料10 μL(終濃度為10 mg/L),避光染色15 min;PBS沖洗3次,吸棄;鏡下觀察細胞內熒光強度,激發波長488~505 nm,發射波長530 nm,每組選6個樣本,每個樣本隨機取3個視野觀測拍照,應用Image Pro-Plus 6.0軟件分析細胞內熒光積分光密度(IOD)值/熒光區域面積(Area)。
2.6 Western blot檢測 Bcl-2、Bax和 cleaved Caspase-3蛋白表達
預冷PBS洗滌細胞,加蛋白裂解液提取細胞蛋白質(需在冰上進行操作);用考馬斯亮藍測定蛋白濃度,決定上樣量;取樣品適量至EP管,加上樣緩沖液混勻,沸水中煮10 min使蛋白變性;根據蛋白測定濃度,每孔加樣 20 μL,加 Marker作為對照,經SDS-PAGE電泳并轉PVDF膜;脫脂奶粉(5%)封閉1 h后,加TBST置搖床漂洗4次,每次5 min;分別加10 μL Bcl-2、Bax、cleaved Caspase-3抗體,37 ℃孵育20 min,4 ℃冰箱過夜;次日37 ℃孵育20 min,加TBST漂洗4次,每次5 min;以β-actin作內標,加2 μL辣根過氧化物酶標記羊抗兔IgG,37 ℃孵育60 min;加TBST漂洗4次,每次5 min;加ECL發光試劑孵育,在暗室將膜在感光膠片上曝光、顯像,掃描進行灰度分析,實驗重復4次。用Bcl-2、Bax、cleaved Caspase-3與β-actin灰度比值表示細胞內相關蛋白的含量。
3 統計學方法
采用SPSSS19.0統計軟件進行分析。實驗數據以
4 結果
4.1 過氧化氫誘導PC12細胞凋亡模型結果
與0 μmol//L H2O2組比較,50、1000、200、3000、4000 μmol/L H2OO2組細胞活力下降,且細胞活力下降與H2O2的濃度呈一定相關性,200 μmol/LL H2O2PC12細胞活力下降明顯,差異有統計學意義(P<0.05);與0 μmol/L H2O2組比較,H2OO2作用6 h時細胞活力下降明顯,差異有統計學意義(P<0.05)。故確定 H22O2濃度為200 μmmol/L作用時間6 h構建PPC12細胞凋亡模型。
4.2 當歸紅芪超濾膜提取物對PC12細胞增殖的影響
與0g/L UUFE-AH比較,0.19、0.338、0.75、1.5、3.00g/L UFE-AAH對PC122細胞增殖有促進作用,在0.338~1.50g/L及作用時間224 h內存在一定量效和時效關系,0.38g/LUFE-AH作用PC12細胞18 h、0.75 gg/L UFFE-AH作用PPC12細胞12 h、1.5g/LL UFE-AH作用PCC12細胞6 h均有明顯的促增殖效應,差異有統計學意義(P<0.055)。
4.3 當歸紅芪超濾膜提取物對過氧化氫損傷PC1122細胞凋亡的影響
與正常對照組比較,模型組早期凋亡細胞(D4象限細胞)百分率明顯上升(P<0.05),正常細胞(D3象限細胞)百分率明顯下降(P<0.05);與模型組比較,中藥中、高劑量組正常細胞(D3象限細胞)百分率明顯上升,早期凋亡細胞(D4象限細胞)百分率明顯下降,差異有統計學意義(P<0.055)。結果見表1、圖1。
表1 各組細胞凋亡率比較(±s,%)

表1 各組細胞凋亡率比較(±s,%)
注:與正常對照組比較,#P<0.05;與模型組比較,*P <0.05(下同)
別 n 劑量/(g/L) 正組常細胞 早期凋亡細胞照組 4正常對94.03±3.623.11±2.03模型組中藥低劑中藥中劑中藥高劑4量組 4量組 4量組 4 81. 0.38 85. 0.75 87. 1.50 89. 51±4.51#12±3.77 51±3.98*37±4.12*11.91±2.41#10.37±2.26 7.91±1.92*6.72±2.01*
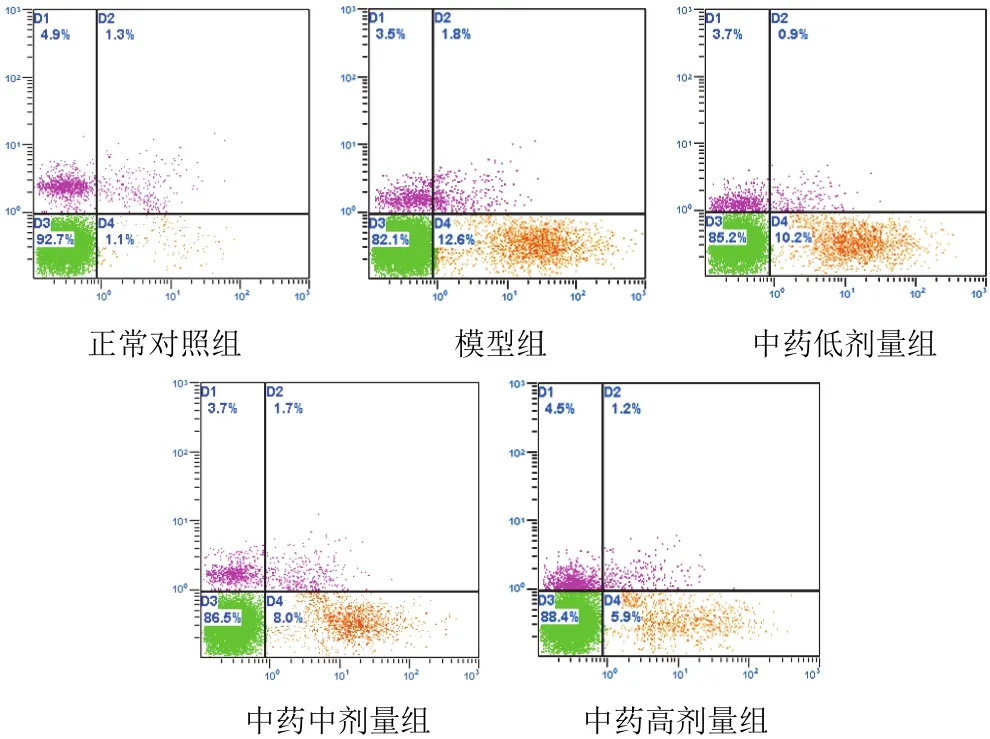
圖1 各組細胞凋亡流式細胞圖
4.4 當歸紅芪超濾膜提取物對過氧化氫損傷PC1122細胞線粒體膜電位的影響
與正常對照組比較,模型組PC122細胞內熒光強度、細胞線粒體膜電位明顯下降,差異有統計學意義(P<0.05);與模型組比較,中藥低、中、高劑量組PCC12細胞內熒光強度、細胞線粒體膜電位明顯上升,差異有統計學意義(P<0.05)。結果見表2、圖2。
表2 各組細胞線粒體膜電位水平比較(±s)

表2 各組細胞線粒體膜電位水平比較(±s)
別 n 劑量/(g/L)組IODD/Area正常對照組 1839.455±5.21模型組中藥低劑中藥中劑中藥高劑18量組 18量組 18量組 18 0.38 0.75 1.50 10.35 14.87 22.54 32.17 ±3.45#±4.61*±4.27*±5.46*

圖2 各組細胞線粒體膜電位熒光圖(×4000)
4.5 當歸紅芪超濾膜提取物對過氧化氫損傷PC1122細胞Bcl-2、Bax和cleaved CCaspase-3蛋白表達的影響
與正常對照組比較,模型組PC122細胞中Baxx、cleeaved Caspasee-3蛋白表達量明顯增加,Bcl-2蛋白表達量明顯下降,Bcl-2/Bax比值降低,差異有統計學意義(P<0.055);與模型組比較,中藥低、中、高劑量組PC12細胞BBax、cleavedCaspase-3蛋白表達量顯著降低,Bcl-2蛋白表達量顯著增加,Bcll-2/Bax比值顯著升高,差異有統計學意義(P<0.05)。結果見表3、圖3。
表3 各組細胞Bcl-2、Bax及cleaved Cas pase-3蛋白表達比較(±s)
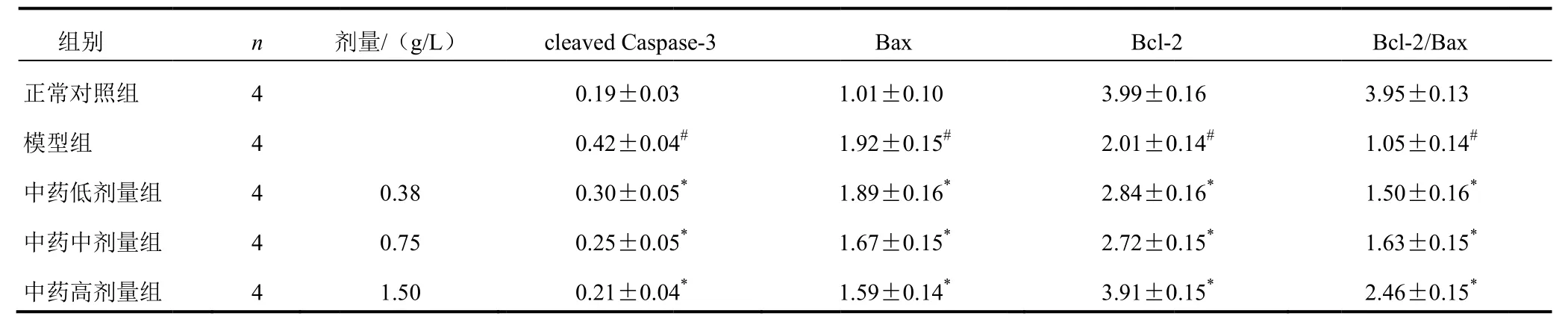
表3 各組細胞Bcl-2、Bax及cleaved Cas pase-3蛋白表達比較(±s)
組別n 劑劑量/(g/L)cleaved Caspa se-3正常對照組Bax Bcl-2Bcl-2/Bax 4 0.19±0.031.01±0.103.99±0.163.95±0.13模型組中藥低劑量組中藥中劑量組中藥高劑量組4 4 4 4 4# 0.38 0.75 1.50 0.42±0.04 0.30±0.05 0.25±0.05 0.21±0.04 * 5* 4* 1.92±0.15#1.89±0.16*1.67±0.15*1.59±0.14*2.01±0 2.84±0 2.72±0 3.91±0 .14#.16*.15*.15*1.05±0.14#1.50±0.16*1.63±0.15*2.46±0.15*

圖3 各組細胞Bcl-2、Bax和cl eaved Caspase-3蛋白表達免疫印跡電泳圖
5 討論
生理狀狀態下,機體的的氧化水平與抗氧化水平保持著動態平衡,對機體不構成傷害。然而,當機體處于特定的環境境因素、壓力或或者疾病狀態下,這種平衡被破壞,機體內氧化和抗氧化水平失衡,導致大量ROS在細胞中堆堆積,不能被及時清除,會造成組織器器官的損傷,從而引起疾病的發發生,稱氧化化應激。H2OO2是強氧化劑,屬于外源性的ROS,當將其作為一種膜通透性的ROS被加入細胞培培養體系后,,可直接破壞細胞或線粒體膜性結構,從而引起細胞的的凋亡。線粒體在調節凋亡的的過程中起著關鍵作用。細胞凋亡過程中許多重要事件的發生都都與線粒體密切相關,包括Caspases激激活因子的釋放放,如細胞色素C、電子傳遞鏈的改變,線粒體膜電位位的喪失,細胞內氧化還還原狀的改變,Bccl-2家族促進和抑制凋亡蛋白的參與等[7]。Caspase-3是是細胞凋亡的的重要組成部部分,是凋亡途徑下游進行底物酶解的關鍵蛋白酶,正常情況下,Caspase-3以無活性的的蛋白酶原原形式存在在(即pro-Caspasee 3),當受到信號刺激后,酶解為活性酶碎片(即cleaaved Caspase3),cleavedd Caspase 3的的表達量可以反映出細胞的凋亡水平,而Bcl-2蛋白屬于抗凋亡蛋白,可通過調控谷胱甘肽等的的水平調控核核內氧化還原平衡以達到控制Caspase的活性抑制凋亡的作用[8-10]。在線粒體凋亡通通路中,Bcl-2家族的抗凋凋亡與促凋亡蛋白通過形成異異源二聚體并定位于線粒體外膜上發揮作作用,對維持線粒體膜的完完整性、維持持正常的線粒體跨跨膜電位、抑制制線粒體膜間間隙蛋白細胞色素C的釋放有重要要意義,Bcl--2/Bax比值降低細胞趨向凋亡,Bcl-2/Baxx比值升高細胞趨向存活[11]。本研究應用200 μmol/LH2O2作用PPC12細胞6 h成功構建氧化損傷神經細胞凋亡模型,研究結果顯示,H2O2作用PC C12細胞6 h可明顯造成細胞線粒體膜電位的異常,誘誘導Bax、cleeaved Caspase-3高表達,進而引發凋亡的的發生。應用UFE-AH干預H2O2誘導的PC12細胞凋亡結果顯示,UFE-AH通過改善H2O2損傷的PC12細胞線粒體膜電位異常,降低Bax、cleeaved Caspase-3的的表達,升高Bcl-2的表達,抑制H2OO2誘導的PC12細胞凋亡。
針對神經細胞的損傷,,中醫多從補補腎入手,依據填精益髓的理論展開研究,本研究依據精血同源理論,從氣血論治神經細胞損損傷修復,選方依據益氣養血名方當歸補血湯。紅芪為為豆科植物多多序巖黃芪的的干燥根,與黃芪功功效相當。現現代藥理研究顯示,其具具有良良好的抗自由基、抗氧化、、抗腫瘤及提提高免疫力等等作用[12]。當歸乃臨床最常用的的補益藥之一,現代藥理研究表明,其具有抗氧化、抗抗衰老、抗腫瘤、抗輻射射、提高免疫力等功效[13]。UFE-AH是當歸、紅芪按1∶5比比例混合,利用膜超濾技術,有效去除除藥物中雜質質,保保留藥物有效成分,研究顯示具有抗自自由基、抗氧化損傷、抗衰老、抗輻射、促進血管新生生等功效[14-17]。當歸為血中氣藥,具有活血補血之功,紅芪有益氣升陽之力,二藥合用補氣生血之力強,氣血旺則精生,精生則髓長。線粒體是細胞產生能量的的場所,中醫氣血理論與其密切相關。本研研究結果顯示示,當UFE-AH對對神經細胞線粒體功能有有積極調控作作用,可以對抗H22O2對PC12細胞線粒體膜結構與功能能的破壞,防治其誘導的細胞凋亡。本研究結果提示益益氣養血中藥有助助于氧化應激損傷神經細胞的康復。
[1] 李應東,趙信科,,劉凱.當歸紅芪超超濾物對急性心肌肌梗死大鼠 SOD、MMDA、LDH1及HSP70的影響[J].中華中醫藥雜志,2011,26(10):2430-2433.
[2] LI Y D, MA Y H, ZHAO J X, et al. Protection of ul t ra-f il t ration extract f rom Danggui Buxue Decoction in cardiomyocytes of neonatal rats and its mechanism[J]. ChinJ Integr Med,20011,17(11):854-859.
[3] 馬燕花,李應東,趙健雄,等.當歸紅芪超濾物對氧化損傷乳鼠心肌細胞的保護作用及其機制[J].中草藥,2010,41(4):602-607.
[4] 李應東,趙信科,李子佳,等.當歸紅芪超濾物對急性心肌梗死大鼠的保護作用及對熱休克蛋白 70表達的影響[J].第三軍醫大學學報,2011,33(1):92-94.
[5] 樊秦,李應東,舒暢,等.超濾膜分離純化當歸補血湯的研究[J].中成藥,2010,32(8):1438-1440.
[6] 顧麗娟,劉凱,孫少伯,等.當歸紅芪超濾物對過氧化氫致內皮細胞凋亡中熱休克蛋白 70及內皮型一氧化氮合酶表達的影響[J].中國中醫藥信息雜志,2015,22(4):51-54.
[7] 陳鄑先,許彩明,潘華珍.線粒體與細胞凋亡[J].解剖學報,2000,31(3):285-287.
[8] ROMANO G, BRIGUORI C, QUINTAVALLE C, et al. Contrast agents and renal cel l apoptosis[J]. Eur Heart J,2008,29(20):2569-2576.
[9] PARRISH A B, FREEL C D, KORNBLUTH S. Cel lular mechanisms cont rol ling caspase activation and function[J]. Cold Spring Harb Perspect Biol,2013,5:a008672.
[10] SATO T, MACHIDA T, TAKAHASHI S, et al. Fas-mediatedapoptosome formation is dependent on reactive oxygen species derived f rom mitochondrial permeabil ity transition in Jurkat cel ls[J]. J Immunol,2004,173(1):285-296.
[11] HOWELLS C C, BAUMANN W T, SAMUELS D C. The Bcl-2-associated death promoter (BAD) lowers the threshold at which the Bcl-2-interacting domain death agonist (BID) t riggers mitochondria disintegration[J]. J Biol Chem,2011,271(1):114-123.
[12] 楊林,譚玉玲.中藥紅芪研究現狀[J].中外醫療,2010,15(5):120-121.[13] 李曦,張麗宏,王曉曉,等.當歸化學成分及藥理作用研究進展[J].中藥材,2013,36(6):1023-1028.
[14] 李應東,王博雯,周倩倩,等.當歸紅芪超濾物對自然衰老大鼠抗氧化作用機制的研究[J].時珍國醫國藥,2012,23(6):1439-1441.
[15] 劉野,李應東.當歸紅芪超濾膜提取物含藥血清對輻射心肌成纖維細胞SOD和羥脯氨酸的影響[J].甘肅中醫學院學報,2010,27(3):1-3.
[16] 劉凱.當歸紅芪合劑超濾膜提取物 ECV-304細胞血管內皮生長因子mRNA表達的影響[J].中國中醫藥信息雜志,2010,17(3):36-38.
[17] 安耀榮,李應東,劉凱.當歸紅芪合劑超濾膜提取物對ECV-304細胞增殖周期的影響[J].中成藥,2009,31(6):937-940.
Effects of Ultra-filtration Extract from Angelica Sinensis Radix and Hedysari Radix on PC12 Cell Apoptosis Induced by H2O2
ZHU Bei-bei1, LIU Ping-ping2, LI Shu-ling1, LIU Kai1,2, LI Ying-dong1,2
(1. Gansu University of Chinese Medicine, Lanzhou 730000, China; 2. Provincial Level Key Lab, Affiliated Hospital of Gansu University of Chinese Medicine, Lanzhou 730000, China)
Ob jectiveTo observe the effects of ultrafiltration extract from Angelica Sinensis Radix and Hedysari Radix on PC12 cell apoptosis induced by H2O2; To discuss its mechanism of action.MethodsH2O2was used in the incubation of PC12 cells to establish the oxidative damage nerve cell apoptosis model. The experiment was divided into normal control group, model group, and three different dosages (0.375, 0.75, 1.5g/L) of ultra-filtration extracted from Angelica Sinensis Radix and Hedysari Radix after modeling for interference. Rate of cell apoptosis was detected by flow cytometry; mitochondrial membrane potential was measured by laser scanning confocal microscopy; the protein expressions of cleaved Caspase-3, Bax and Bcl-2 were detected by Western blot.ResultsCompared with the model group, rates of cell apoptosis in the different dosage groups decreased significantly; membrane potential of mitochondria increased; the protein expressions of cleaved Caspase-3 and Bax decreased; the expression of Bcl-2 increased; the ratio of Bcl-2 and Bax increased (P<0.05).ConclusionThe ultra-filtration extracted from Angelica Sinensis Radix and Hedysari Radix can inhibit PC12 cell apoptosis induced by H2O2.
ultra-filtration extract from Angelica Sinensis Radix and Hedysari Radix; H2O2; PC12 cells; apoptosis
10.3969/j.issn.1005-5304.2016.06.018
R285.5
A
1005-5304(2016)06-0068-05
2015-09-02)
(
2015-10-12;編輯:華強)
國家自然科學基金(81160478);甘肅省高等院校研究生導師科研項目(BH2011-043)
李應東,E-mai l:lydj412@163.com

