愛必妥聯合FOLFOX化療治療晚期結腸癌的療效分析
趙微 于佩瑤 金霞
愛必妥聯合FOLFOX化療治療晚期結腸癌的療效分析
趙微 于佩瑤 金霞
目的探討晚期結腸癌治療中愛必妥聯合FOLFOX化療的臨床療效和不良反應。方法選取KRAS野生型晚期轉移性結腸癌患者90例,根據患者情況均分為3組,分別為無愛必妥的對照組(FOLFOX化療)、單周方案組(愛必妥單周給藥聯合FOLFOX化療)、雙周方案組(愛必妥雙周給藥聯合FOLFOX化療),觀察3組患者臨床效果及毒副反應。結果對照組、單周方案組、雙周方案組客觀緩解率分別為16.67%、40.00%、33.33%,疾病控制率分別為66.67%、83.33%、80.00%;對照組、單周方案組、雙周方案組痤瘡樣皮疹發生率為0、86.67%、80.00%,愛必妥聯合化療組痤瘡樣皮疹發生率與對照組差異有統計學意義(P<0.05),且愛必妥單周及雙周給藥聯合化療組痤瘡樣皮疹發生率差異無統計學意義(P>0.05);其余各項毒副反應與對照組差異無統計學意義(P>0.05)。結論愛必妥聯合FOLFOX方案治療晚期結腸癌的近期療效顯著,毒副反應可耐受。
愛必妥;FOLFOX化療;晚期結腸癌
目前,在晚期結腸癌的臨床治療中,化療仍是主要的治療手段,其中FOLFOX方案是晚期結腸癌的一線化療方案,但因腫瘤耐藥性,常導致治療失敗[1]。愛必妥又稱為“西妥昔單抗”,是一種人鼠嵌合性IgG1型單克隆抗體,靶點為表皮生長因子受體(EGFR),有研究報道顯示,愛必妥可對EGFR高表達進行有效抑制,進而實現對腫瘤的抑制。經過臨床實踐證實,在化療中聯合應用靶向藥物,可有效延長患者的生存時間[2]。鑒于此,本研究通過隨機對照試驗,觀察愛必妥聯合FOLFOX化療的臨床療效和不良反應,并將有關情況報告如下。
1 資料與方法
1.1 一般資料選取大連醫科大學附屬第一醫院2013-01—2014-12晚期轉移性結腸癌患者90例,所有患者均經病理組織學檢測確診。其中女34例,男56例;患者年齡為35~75歲,平均年齡為(58.54±2.64)歲;其中53例為中分化腺癌,28例為高分化腺癌,2例為黏液腺癌,7例為低分化腺癌。所有患者均經過K-ras基因檢測,為野生型。并通過CT對腫瘤病灶進行客觀的評估;另對患者肝腎功能、血尿常規等進行檢測,均未發現異常現象;所有患者KPS評分≥60分,且預計生存期時間在3個月及以上。根據患者實際情況,將其分為3組,分別為無愛必妥的對照組、單周方案組、雙周方案組。
1.2 治療方法對照組:僅用FOLFOX方案化療:奧沙利鉑100 mg/m2靜滴>2 h,d1;亞葉酸鈣400 mg/m2靜滴,d1;氟尿嘧啶2 400 mg/m2持續靜脈泵入46~48 h。14 d為1個周期,化療不超過12個周期。化療前均給予托烷司瓊5 mg靜滴。
治療組:各組FOLFOX方案用藥與對照組相同。愛必妥先于化療藥物前使用,兩者相隔1 h以上。在給予愛必妥前,首先需肌注苯海拉明20 mg、靜脈推注地塞米松5 mg。
單周方案組:愛必妥首次400 mg/m2,第2周始250 mg/m2持續靜滴120 min,1次/周,使用16~22次,平均使用20次。
雙周方案組:愛必妥500 mg/m2,每2周1次,使用6~12次,平均使用10次。
1.3 觀察指標3組患者均需要接受4周期以上的化療,若在化療期間病情進展,經證實為PD的患者即停止治療。在患者治療的過程中,每周均行血常規檢查,每個周期都需要對患者的肝腎功能、心電圖等進行檢查。在4個周期中接受腹部B超、盆腔B超等常規檢查項目,必要情況下,可安排患者接受MRI、CT以及全身骨掃描等檢查。在復查入組之后,再根據患者腫瘤變化情況進行療效判定。
1.4 判斷標準
1.4.1 療效標準根據實體瘤的療效評價標準(RECIST)所擬定的關于抗腫瘤藥物臨床近期療效評價標準[3]作為本研究判斷標準。完全緩解(CR):觀測患者腫瘤變化情況,已經完全消失,且臨床癥狀已基本上得到了有效緩解;部分緩解(PR):患者的腫瘤腫塊已經有了非常顯著的縮小,縮小面積超過了一半以上,并未出現其他新病灶;穩定(SD):患者的腫瘤腫塊已經有了明顯縮小,縮小面積不足一半,或者增大面積未超過1/4,且無其他新病灶;進展(PD):患者的腫瘤腫塊面積出現了顯著增加,并且病灶增大超過了1/4,或者有新病灶出現。客觀緩解率=(PR+CR)/總例數×100%;疾病控制率=(SD+PR+CR)/總例數×100%。
1.4.2 毒副反應包括患者胃腸道反應、骨髓抑制、痤瘡樣皮疹、肝功能損害、神經毒性等。
1.5 統計學處理運用SPSS 20.0統計學軟件分析,計數資料采用χ2檢驗。若P<0.05,即表示差異有統計學意義。
2 結果
2.1 一般資料比較3組患者一般資料比較,差異均無統計學意義(P=0.068 1),具有可比性。
2.2 3組患者臨床治療效果比較(表1)無愛必妥的對照組客觀緩解率為16.67%,疾病控制率為66.67%;單周方案組客觀緩解率為40.00%,疾病控制率為83.33%;雙周方案組客觀緩解率為33.33%,疾病控制率為80.00%。根據比較結果來看,愛必妥聯合化療的兩組患者,客觀緩解率與疾病控制率均高于對照組(P=0.021 6);單周方案組與雙周方案組兩項指標對比差異無統計學意義(P=0.092 4)。
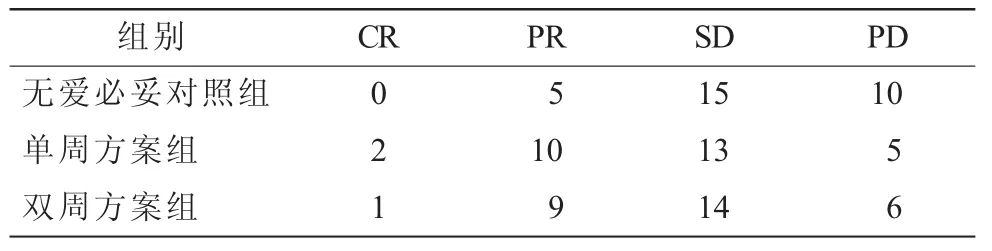
表1 3組患者臨床治療效果比較(n=30)
2.3 3組患者臨床毒副反應比較(表2)兩組愛必妥聯合化療組均有痤瘡樣皮疹病例發生,與對照組比較差異有統計學意義(P=0.030 8),且兩組愛必妥聯合化療組痤瘡樣皮疹發生率對比差異無統計學意義(χ2=3.502 9,P=0.071 3),兩組皮疹多為1~2級,級皮疹發病率較低(均<10%),經治療后均得到了有效改善,未影響后續治療。其余各項毒副反應與對照組比較,差異無統計學意義(χ2=5.618 7,P=0.066 9)。
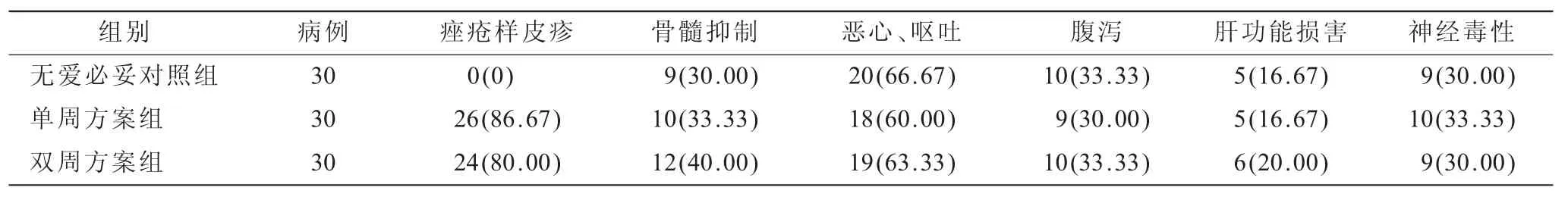
表2 3組患者臨床毒副反應比較[n(%)]
3 討論
近年來伴隨著人們膳食結構和經濟發展的影響,結腸癌發病率逐年增加。因結腸癌早期具有非常強的隱蔽性,大部分的患者不能早期發現、及時就診[4]。約25%的結腸癌患者在初診時已有潛在轉移,約有50%患者會在病程中出現轉移[5]。而目前晚期結腸癌的治療仍是以化療為主的綜合治療,但化療的有效率無法達到預期。現在分子靶向藥物治療為腫瘤患者提供了新的治療途徑,以EGFR為靶點的治療藥物是目前癌癥研究領域中的一個熱點問題[6]。EGFR在相當一部分腫瘤中都有不同程度的表達,90%以上結腸癌患者的EGFR為陽性[7]。愛必妥(Cetuximab,C225)作為IgG1單克隆抗體,可以特異性地與EGFR結合,阻斷其與內源性配體的結合,從而阻斷整個下游信號途徑的傳導而發揮抗腫瘤作用,在晚期結腸癌等的臨床治療中取得了令人鼓舞的療效[8]。K-ras基因是一個編碼EGFR信號轉導通路Ras蛋白的基因[9]。在K-ras野生型結腸癌中,該蛋白受到嚴格調控,僅在特定的刺激下(如EGFR信號)發生活化。因此,EGFR靶向藥物愛必妥能有效阻斷腫瘤下游信號的傳導[10]。研究顯示,K-ras基因野生型的患者能從愛必妥聯合化療中獲得更好的療效,而突變型的患者無法獲益。
為進一步指導臨床治療,本研究采用隨機對照研究,共入組經組織病理學證實的結腸癌患者90例,且均經K-ras基因檢測為野生型,其中60例患者采用兩種不同的愛必妥用法聯合FOLFOX方案進行化療,另外選取30例患者為對照組,單用FOLFOX方案進行化療,觀察比較3組患者接受治療后的近期療效和不良反應,并對研究結果進行了統計分析。結果顯示,愛必妥單周及雙周給藥聯合化療的治療方案較單純化療組取得的效果顯著(P<0.05)。愛必妥副作用主要為痤瘡樣皮疹,本研究中,愛必妥聯合用藥組均出現了較大范圍的痤瘡樣皮疹,但多為1~2級,3~4級嚴重皮疹發病率較低,經有效治療后未影響臨床用藥,在臨床試驗中顯示了可以接受的毒性。且兩組愛必妥聯合用藥組痤瘡樣皮疹的發生率對比差異無統計學意義(P>0.05),這表明改變愛必妥用藥方案,并不會致使痤瘡樣皮疹發生率變化。同時,研究顯示痤瘡樣皮疹可能與療效有關。本臨床研究中其他用藥后毒副反應:骨髓抑制、腹瀉、惡心嘔吐、肝功能損害以及神經毒性等,大多比較輕微,3組患者都以Ⅰ~Ⅱ度為主,Ⅲ~Ⅳ度較少見。
由此可知,在K-ras基因表達狀態為野生型的晚期結腸癌患者的臨床治療中,通過愛必妥靶向藥物聯合FOLFOX方案化療,無論是單周方案還是雙周方案,均可較好的實現對病情的控制,且療效安全,故值得推廣。
[1]劉漢山,吳國嶺.愛必妥聯合放療治療中晚期食管癌臨床觀察及生活質量分析[J].武警醫學院學報,2010,19(5):367-370.
[2]曾進龍,王志超,張海良,等.FOLFIRI化療方案及其與西妥昔單抗聯用治療晚期結腸癌分析[J].臨床醫學工程,2012,19(11):1929-1930.
[3]王曉紅,黃穎.比較單用FOLFIRI化療方案及其與西妥昔單抗聯用治療晚期結腸癌的療效[J].中國臨床藥理學雜志,2011,27(12):972-975.
[4]郭桂芳,夏良平,徐瑞華,等.西妥昔單抗聯合化療治療晚期結直腸癌的生存分析及KRAS對療效的影響[J].中山大學學報:醫學科學版,2011,31(5):637-643.
[6]周陳西,劉孟娟,王增,等.西妥昔單抗聯合化療方案治療晚期結直腸癌的臨床療效[J].中國臨床藥學雜志,2012,16(2):99-102.
[7]呂瑤,石燕,王治寬,等.貝伐珠單抗聯合FOLFOX方案優化治療晚期結腸癌的療效觀察[J].癌癥進展,2014,11(6):593-596.
[8]茅慧,石燕,戴廣海.西妥昔單抗聯合FOLFOX4方案一線治療轉移性結直腸癌的臨床觀察[J].臨床腫瘤學雜志,2012,17(4):356-359.
[9]王華,蔡蘇玲.西妥昔單抗聯合化療治療轉移性結直腸癌的臨床觀察[J].醫藥前沿,2014,3(24):128-129.
[10]王秀麗,劉春玲,李曉琴.西妥昔單抗聯合化療治療轉移性結直腸癌的臨床觀察[J].腫瘤預防與治療,2010,23(4):286-290.
Objective To explore the clinical effects and adverse effects of Erbitux w ith FOLFOX chemotherapy to treat advanced colon cancer.Methods 90 sufferers w ith KRAS w ild type advanced colon cancer were selected and divided into three groups:control group w ithout Erbitux(FOLFOX chemotherapy),one-week schema group(one-week Erbitux w ith FOLFOX chemotherapy),and two-week schema group(two-week Erbitux with FOLFOX chemotherapy).The clinical effects and adverse effects of the three groups were observed.Results The objective rem ission rate of the control group,the one-week schema group and the two-week schema group was respectively 16.67%,40.00%,and 33.33%,the disease control rate 66.67%,83.33%,and 80.00%,the acneiform rash incidence rate 0,86.67%,and 80.00%.The acneiform rash incidence rate between the Erbitux w ith FOLFOX chemotherapy groups and the control group had differences of statistical significance(P<0.05),but the acneiform rash incidence rate between the one-week schema group and two-week schema group had no difference of statistical significance(P>0.05),while the toxic and side effects had no difference of statistical significance(P>0.05).Conclusion Erbitux w ith FOLFOX chemotherapy has obvious short-term curative effects to treat advanced colon cancer,w ith tolerated toxic and side effects.
Erbitux;FOLFOX chemotherapy;Advanced colon cancer
2015-04-21)
1005-619X(2016)01-0008-03
10.13517/j.cnki.ccm.2016.01.004
116011大連機車醫院(趙微,金霞);116011大連醫科大學附屬第一醫院(于佩瑤)
金霞

