HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷體外對膀胱癌EJ細胞殺傷作用的研究
張 沖,劉麗春,郭利君,王 磊
(甘肅省人民醫院,甘肅 蘭州 730000)
?
HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷體外對膀胱癌EJ細胞殺傷作用的研究
張沖,劉麗春,郭利君*,王磊
(甘肅省人民醫院,甘肅 蘭州 730000)
摘要:目的 本實驗將鼠源性免疫球蛋白G1(以下簡稱HMFG1)與β-葡萄糖苷酶連接,研究HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷在體外特異性殺傷人膀胱癌細胞(以下簡稱EJ細胞)的作用,探討HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷用于膀胱癌治療的前景。方法 將不同濃度的苦杏仁苷加入HMFG1-β-葡萄糖苷酶偶聯物、HMFG1單抗、HMFG1單抗加β-葡萄糖苷酶中,作用于EJ細胞,采用四氮噻唑藍比色法(以下簡稱MTT法)與水溶性四唑鹽比色法(以下簡稱WST-8法)進行實驗。結果 在不同方法下,不同苦杏仁苷濃度的HMFG1-β-葡萄糖苷酶偶聯物對EJ細胞的殺傷活性吸光度值與其他組比較,差異有統計學意義(P<0.01);在不同方法下,各組對EJ細胞的抑制率比較,差異無統計學意義(P>0.05)。偶聯物在250 mmol·l-1濃度下,MTT法IC50為2.12 mmol·l-1、WST-8法IC50為1.17 mmol·l-1。結論 本實驗證明HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷具有明顯特異性殺傷EJ細胞的作用,HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷可能成為治療膀胱癌的有效策略,可以進入動物實驗進行進一步驗證。
關鍵詞:HMFG1-β-葡萄糖苷酶偶聯物;苦杏仁苷;EJ細胞
苦杏仁苷(amygdalin)在自然界中主要存在于苦杏、苦扁桃、油桃、枇杷、蘋果、黑櫻桃等果仁和葉子當中,1920年美國首次將苦杏仁苷用于治療腫瘤。苦杏仁苷產生的氰化物雖然能殺傷腫瘤細胞,但缺乏特異性,對機體可造成嚴重的系統毒性[1]。為了發揮苦杏仁苷的抗腫瘤作用,本實驗將HMFG1(鼠源性免疫球蛋白G1)與β-葡萄糖苷酶連接,使酶與抗體偶聯為一體。采用MTT(四氮噻唑藍比色法)[2]與WST-8法(水溶性四唑鹽比色法)研究HMFG1-β-葡萄糖苷酶偶聯物兼有抗原MUC1結合活性及水解苦杏仁苷的β-葡萄糖苷酶活性,對EJ細胞(人膀胱癌細胞)有特異性殺傷作用,為治療膀胱癌、降低復發率、控制術后轉移提供進一步的實驗基礎,現介紹如下。
1 材料與方法
1.1試劑與儀器
EJ細胞購于中科院上海細胞庫;RPMI-1640(Roswell Park Memorial Institute)培養基(美國Gibco公司);新生小牛血清(蘭州榮曄生物科技有限責任公司);胰蛋白酶粉末(美國Gibco BRL公司);MTT(美國Fluka公司);HMFG1-β-葡萄糖苷酶偶聯物、CCK-8試劑盒(同仁化學研究所);苦杏仁苷(美國波士頓生物技術公司)。儀器:CO2細胞培養箱(型號:shellab 2306);酶標儀(ELX800型);細胞培養瓶、96孔培養板(丹麥NuNc公司);倒置顯微鏡(日本Olympus產品)。
HMFG1-β-葡萄糖苷酶偶聯物的制備:本實驗選用異型雙功能交聯劑間-馬來酰亞胺基苯甲酸N-羥基琥珀酰亞胺酯(MBS)。MBS具有兩個不同的選擇性反應基團,N-羥基琥珀酰亞胺酯可專一地與蛋白質分子中的氨基結合,馬來酰亞胺可與蛋白質中的巰基反應,再通過還原劑2-亞胺基四氫噻吩(2-IT)與單抗反應,在抗體中引入了巰基,使先與β-葡萄糖苷酶的氨基結合了的MBS只能同巰基化的抗體結合,避免了連接反應中抗體與抗體、酶與酶之間的自身聚合,提高了交聯反應的效率。
1.2方法
1.2.1MTT法 分為:(1)HMFG1單抗-β-葡萄糖苷酶偶聯物組;(2)HMFG1單抗加β-葡萄糖苷酶組;(3)HMFG1單抗組。準備苦杏仁苷溶液,濃度分別為1 mmol·l-1,5 mmol·l-1,10 mmol·l-1,15 mmol·l-1。將對數生長的EJ細胞接種于96孔板(1×105/孔),待細胞貼壁后[3-4]去除培養基,分別加入以上3組藥物,終濃度為250 mmol·l-1,不加藥組為陰性對照組,并以不加細胞只加培養基作為空白進行調零。繼續培養2小時,然后用無血清RPM-1640培養基洗3次,再在3組中加入4個濃度的苦杏仁苷,每個濃度設3個復孔,繼續培養24小時。然后加入MTT 20 μl/孔(濃度5 mg/ml),培養4小時,吸去上清液,加入DMSO 150 μl/孔,充分震蕩10分鐘,放入酶標儀,在490 nm下測定各孔吸光度值(A),取平均值,按公式計算細胞抑制率:細胞抑制率=(1-A實驗組/A對照組)×100%,求出細胞生長抑制50%時的苦杏仁苷濃度,即IC50值,并進行比較。
1.2.2WST-8法 分為:(1)HMFG1單抗-β-葡萄糖苷酶偶聯物組;(2)HMFG1單抗加β-葡萄糖苷酶組;(3)HMFG1單抗組。準備苦杏仁苷溶液,濃度分別為 1 mmol·l-1,5 mmol·l-1,10 mmol·l-1,15 mmol·l-1。將對數生長的EJ細胞接種于96孔板(1×105/孔),37℃,5%CO2培養箱培養12小時,待細胞貼壁后,分別加入以上3組藥物,終濃度為250 mmol·l-1,不加藥組作為陰性對照組,并以不加細胞只加培養基作為空白進行調零。繼續培養2小時,然后用無血清RPM-1640培養基洗3次,再在3組中加入4個濃度的苦杏仁苷溶液,每個濃度設3個復孔,繼續培養24小時。然后加入CCK-8 10 μl/孔,培養4小時,充分震蕩10分鐘,放入酶標儀,在450 nm波長下測定各孔吸光度值(A)。計算IC50值同上,之后進行比較。
1.3數據統計
數據采用SPSS15.0軟件統計[5],組間比較采用方差分析,IC50的計算用Probit分析,兩方法比較采用非參數兩相關樣本Wlicoxon統計分析。P<0.05為差異有統計學意義。
2 結果
由結果可以看出,采用不同方法,結果均顯示HMFG1-β-葡萄糖苷酶偶聯物組有較強的細胞抑制作用,對苦杏仁苷呈劑量依賴性。偶聯物組與其他各組間的吸光度值比較,有顯著性差異(P<0.01)。在不同方法下,各組對EJ細胞的抑制率比較,無顯著性差異(P>0.05)。經計算,藥物劑量曲線[6]顯示,MTT法IC50為2.12 mmol·l-1,WST-8法IC50為1.17 mmol·l-1,見表1~3。
3 討論
膀胱癌是國內男性泌尿生殖系統腫瘤中最常見的惡性腫瘤,據中國癌癥基金會腫瘤數據庫統計顯示,膀胱癌的發生約占所有惡性腫瘤的5%,并呈逐年上升趨勢。在膀胱癌中,90%以上為移行細胞癌,膀胱癌術后極易復發,復發率為80%,其中10%進展為較高分級。為治療以及降低術后復發率,通常采用膀胱灌注藥物局部化療,但用化療藥物進行膀胱灌注時也能被機體吸收,造成全身毒性反應,且治療效果并不理想。這就需要研制出一種新的、特異性高的藥物,能夠在早期識別并靶向殺傷膀胱腫瘤細胞,降低術后復發率,且對正常組織細胞無毒性作用或毒性作用很小,減輕患者痛苦,提高其生存質量[7]。
從天然產物中提取的苦杏仁苷本身毒性很低,但經β-葡萄糖苷酶水解后能產生氰化物,且有極強的細胞毒性。正常細胞中存在硫氰酸酶,可將一部分氰化物轉化為無毒的硫氰酸鹽,而腫瘤細胞無硫氰酸酶,所以對腫瘤細胞的作用更明顯[8]。HMFG1-β-葡萄糖苷酶偶聯物就是一種針對腫瘤細胞特異性高表達的MUC1黏蛋白,且符合(Antibody Directed Enzyme Prodrug Therapy,ADEPT)理念[9]的前體藥物。本實驗采用MTT法與WST-8法測定不同濃度的苦杏仁苷與偶聯物聯合共同作用于膀胱癌EJ細胞24小時后的抑制率,結果顯示,1 mmol·l-1、5 mmol·l-1、10 mmol·l-1、15 mmol·l-1的苦杏仁苷溶液與HMFG1-β-葡萄糖苷酶偶聯物聯合共同作用后,表現出明顯的抑制效應,與其他各組比較,差異有統計學意義(P<0.01),并且隨著苦杏仁苷濃度的加大而增加,呈現劑量依賴性。MTT法IC50為2.12 mmol·l-1、WST-8法IC50為1.17 mmol·l-1,從而證明HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷具有特異性殺傷EJ細胞活性的作用,提示HMFG1-β-葡萄糖苷酶偶聯物聯合苦杏仁苷可能是治療膀胱癌、進行早期干預、降低復發率、進行個體化治療、改善預后、控制術后轉移的有效策略,值得進一步研究。
表1 MTT法不同組EJ細胞特異性殺滅活性吸光度值(±s)
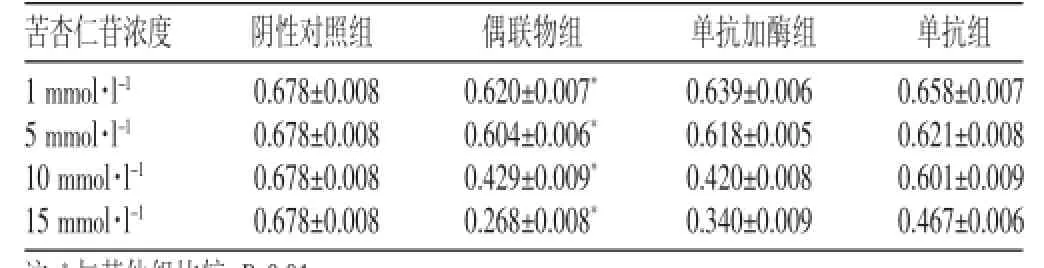
表1 MTT法不同組EJ細胞特異性殺滅活性吸光度值(±s)
注:*與其他組比較,P<0.01
苦杏仁苷濃度1 mmol·l-15 mmol·l-110 mmol·l-115 mmol·l-1單抗加酶組0.639±0.006 0.618±0.005 0.420±0.008 0.340±0.009陰性對照組0.678±0.008 0.678±0.008 0.678±0.008 0.678±0.008偶聯物組0.620±0.007*0.604±0.006*0.429±0.009*0.268±0.008*單抗組0.658±0.007 0.621±0.008 0.601±0.009 0.467±0.006
表2 WST-8法不同組EJ細胞特異性殺滅活性吸光度值(±s)
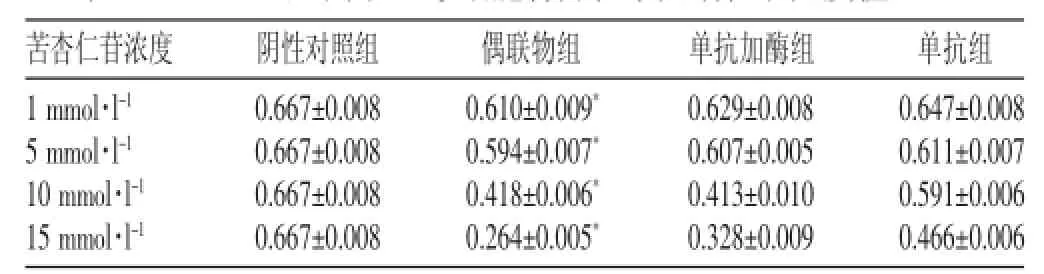
表2 WST-8法不同組EJ細胞特異性殺滅活性吸光度值(±s)
注:*與其他組比較,P<0.01
單抗加酶組0.629±0.008 0.607±0.005 0.413±0.010 0.328±0.009苦杏仁苷濃度1 mmol·l-15 mmol·l-110 mmol·l-115 mmol·l-1陰性對照組0.667±0.008 0.667±0.008 0.667±0.008 0.667±0.008偶聯物組0.610±0.009*0.594±0.007*0.418±0.006*0.264±0.005*單抗組0.647±0.008 0.611±0.007 0.591±0.006 0.466±0.006

表3 MTT法與WST-8法不同組對EJ細胞的抑制率比較(%)
參考文獻:
[1]沈映君.中藥藥理學[M].2版.北京:人民衛生出版社,2011.
[2]方蓉,李芳秋,武建國,等.MTT比色法的條件探討[J].臨床檢驗雜志,2003,21(1):34-35.
[3]張卓然.實用細胞培養技術[M].北京:人民衛生出版社,2001.
[4]葉蘭萍,徐華,茍海濤,等.重離子對人肝癌細胞凋亡及bcl-2/bax基因表達的研究[J].蘭州大學學報:醫學版,2006,32(2):1-3.
[5]胡志潔.SPSS 11.5軟件在正交試驗設計中的應用[J].醫學信息,2007, 20(5):737-740.
[6]劉桂芬.醫學統計學[M].2版.北京:中國協和醫科大學出版社,2007.
[7]Kaufman D S,Shiply W U,Feldman A S.Bladder cancer[J].Lancet,2009,373(9686):239-249.
[8]許寧俠.苦杏仁苷的研究進展[J].內蒙古中醫藥,2012(9):66-67.
[9]Schellmann N,Deckert P M,Bachran D,et al.Targeted enzyme prodrug therapies[J].Mini-Rev in Medic Chem,2010,10(10):887-904.
(*通訊作者:郭利君)■
中圖分類號:G642.423
文獻標識碼:B
文章編號:1671-1246(2016)12-0146-02
基金項目:甘肅省科技廳自然基金項目(0710RJZA008)

