鄧恩桉下胚軸不定芽再生體系建立的影響因素
陸榮生,韓美麗,梁志強,覃建林
(廣西農業科學院 植物保護研究所/廣西作物病蟲害生物學重點實驗室,廣西 南寧 530007)
?
鄧恩桉下胚軸不定芽再生體系建立的影響因素
陸榮生,韓美麗,梁志強,覃建林
(廣西農業科學院 植物保護研究所/廣西作物病蟲害生物學重點實驗室,廣西 南寧 530007)
摘要:以鄧恩桉種子萌發的實生苗下胚軸為材料,研究了不同激素種類與濃度及多胺對下胚軸經愈傷組織階段產生不定芽過程的影響,以建立一種下胚軸不定芽再生快繁體系。結果表明,以MS為基本培養基,在培養基中添加2,4-D 1.0~1.5 mg/L可誘導鄧恩桉下胚軸產生高質量的愈傷組織;愈傷組織增殖的適宜培養基為MS+TDZ 0.5~1.0 mg/L,愈傷分化產生不定芽的適合培養基為MS+TDZ 1.0 mg/L+腐胺15~25 mg/L,愈傷不定芽分化率達77.1%~79.2%,且外植體褐化率得以降低。愈傷組織塊移入分化培養基初期,3~7 d暗培養可使愈傷不定芽分化率提高到82.8%以上。
關鍵詞:鄧恩桉;下胚軸;不定芽;愈傷;分化
鄧恩桉是一個重要的耐寒桉樹品種,可以耐受-5 ℃左右的低溫,因此它的推廣對于桉樹種植由南向北的推廣具有較大的促進作用[1]。鄧恩桉推廣種植中的主要問題是苗木供應量不能滿足生產需求。由于鄧恩桉生長周期長,開花所需時間達13年之久,且結實率低,難以獲得大量種子,目前國內的實生苗生產造林用種主要從國外購進,加上扦插苗生根困難,這2種因素嚴重制約了鄧恩桉的推廣種植。因此,積極開展鄧恩桉組織培養研究,是解決造林中種苗供需矛盾的有效途徑。
自1996年起,國內外已有數起鄧恩桉組培快繁技術研究報道[2-5],在愈傷培養基篩選、繼代及生根苗獲得方面取得了一定的進展,但仍存在一些問題。多數研究采用大齡實生苗腋芽增殖方式進行快繁,所取得的不定芽增殖系數較低,通常30 d為繼代周期下只有3.5倍左右;以器官形成愈傷分化產生不定芽過程中,愈傷組織再分化不定芽百分率較低,同時繼代過程存在較為嚴重的褐化現象,從而導致外植體死亡率高,間接造成有效分化率低。
針對上述問題,本文采用鄧恩桉種子萌發無菌實生苗下胚軸為研究材料,從誘導下胚軸產生愈傷組織、提高愈傷分化不定芽百分比、減輕外植體褐化現象3個方面為切入點,以最大限度地提高愈傷分化不定芽百分率,建立一種鄧恩桉下胚軸分化不定芽的組培快繁再生技術體系。
1材料與方法
1.1材料
取鄧恩桉種子15 d苗齡的實生苗,種子購自廣西林科院。
1.2試驗方法
1.2.1鄧恩桉無菌實生苗的獲得鄧恩桉種子消毒方法:清水沖洗60 min→無菌水浸泡4 h→70%酒精浸泡30 s→10% NaClO3消毒30 min→無菌水洗3次。消毒后的種子放于MS固體培養基中黑暗培養,萌發后待用。
1.2.2不同種類、濃度激素對下胚軸愈傷形成的影響取15 d苗齡的鄧恩桉無菌苗下胚軸,切成0.5 cm長的片段,放置于添加不同濃度二氯苯氧乙酸(2,4-D)、奈乙酸(NAA)、吲哚乙酸(IAA)的培養基上,每個處理接種16個外植體,3次重復。黑暗下培養7 d后移入光下培養至第25天,調查外植體愈傷發生率。
1.2.3不同種類、濃度激素組合對愈傷組織繼代增殖的影響將1.2.2誘導出的愈傷組織切下,放置于添加不同濃度苯基噻二唑基脲(TDZ)、6-芐基腺嘌呤(6-BA)、6-呋喃甲基腺嘌呤(KT)的培養基上,光下培養25 d后,調查愈傷組織恢復生長率、愈傷增殖量、愈傷褐化率。
1.2.4不同種類、濃度多胺化合物與TDZ結合對愈傷分化不定芽的影響將愈傷組織塊轉入添加不同種類、濃度多胺化合物,并添加TDZ 1.0 mg/L的分化培養基上,光下培養25 d后,觀察不定芽發生率與外植體褐化率。
1.2.5暗培養時間對愈傷組織分化過程中不定芽發生與褐化現象的影響將愈傷組織轉入繼代分化培養基上,先在黑暗中培養1、3、5、7、9、11 d,然后光下培養至第25天,觀察外植體不定芽的發生率、褐化率。
以上研究內容均以改良MS為基本培養基,每天光照16 h,培養溫度26~28 ℃。
愈傷誘導率(%)=產生愈傷組織的外植體數/接種的外植體數×100%
不定芽誘導率(%)=產生不定芽的外植體數/接種的外植體數×100%
愈傷褐化率(%)=褐化的愈傷組織數/接種愈傷組織總個數×100%
愈傷恢復生長率(%)=恢復生長的愈傷組織數/接種愈傷組織總個數×100%
愈傷組織增長量(mm)=繼代培養25 d后愈傷組織直徑-接種當天愈傷組織直徑
數據處理采用方差分析及Duncan’s新復極差測驗。
2結果與分析
2.1不同種類、濃度激素對愈傷組織形成的影響
將下胚軸切段水平放置于添加不同種類與濃度激素的培養基上培養7 d時,可以看到外植體切口處有輕微膨大,10~15 d左右可觀察到部分下胚軸切口處開始形成淡黃色愈傷組織;隨著培養時間的延長,切口處的愈傷不斷長大。至20 d左右時,愈傷組織發生達高峰(圖1),具體結果見表1。

圖1 鄧恩桉下胚軸切口形成的愈傷組織
從表1可看出,添加不同濃度2,4-D、NAA、IAA的培養基對下胚軸愈傷誘導效果不同,添加2,4-D的各處理愈傷誘導率均高于添加NAA與IAA的各處理。在添加2,4-D的各處理中,M3、M4愈傷發生率最高,分別達到89.6%、91.7%,極顯著高于另外3個處理及對照,所形成的愈傷組織為淡黃色,質地較為緊密。當2,4-D濃度為2.0 mg/L時,所形成的愈傷較為疏松,不能用于繼代轉移。
添加NAA的不同處理愈傷誘導率較低,其中M7、M8處理的愈傷誘導率分別僅達45.8%、52.1%,愈傷組織為白色粉末狀,質地緊密。添加IAA的處理愈傷誘導率最高為22.9%,且隨著愈傷長大,外植體褐化嚴重,以致死亡。
因此綜合考慮各種因素,在培養基中添加1.0~1.5 mg/L 2,4-D,有利于鄧恩桉下胚軸愈傷組織的高效發生。
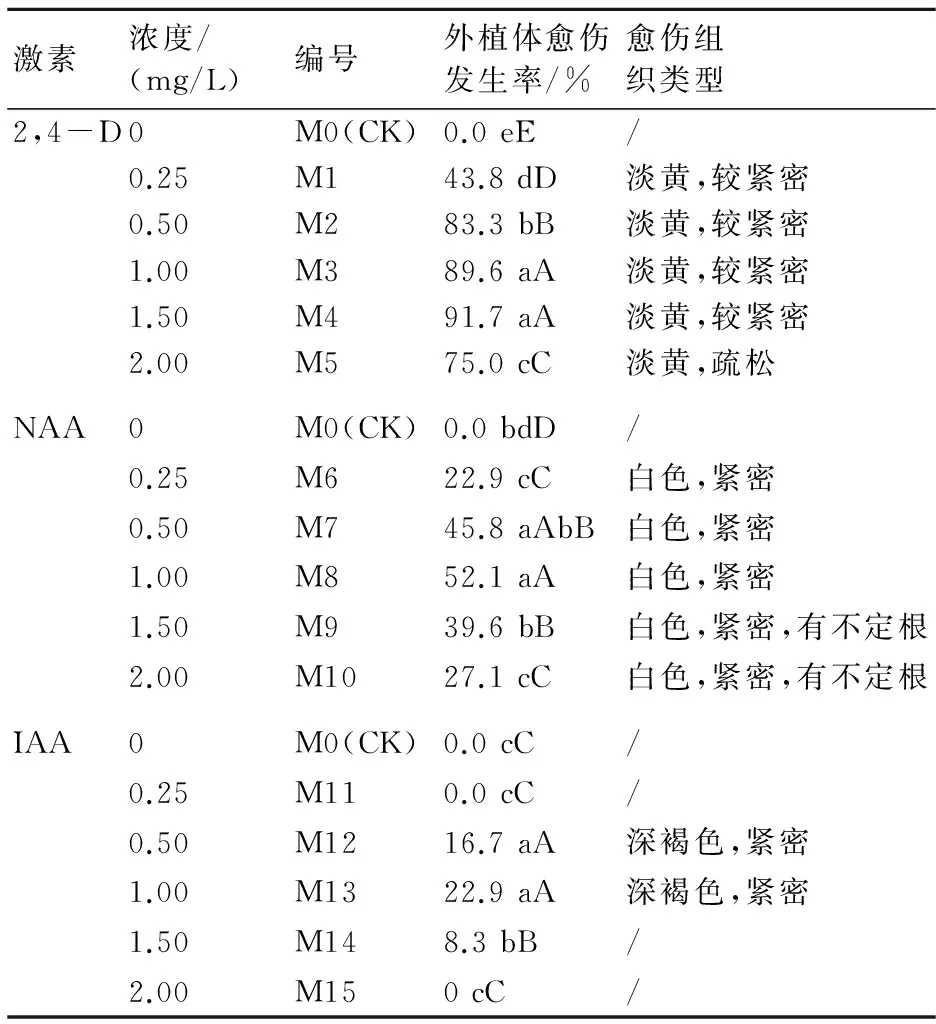
表1 不同種類、濃度激素對下胚軸愈傷組織誘導的影響
注:不同大、小寫字母分別表示在P<0.01、P<0.05上的差異顯著性。下同。
2.2不同種類、濃度激素組合對愈傷繼代增殖的影響
將下胚軸上誘導產生的淡黃色愈傷組織繼代于添加不同濃度TDZ、6-BA、KT的愈傷繼代增殖培養基中,以觀察不同種類、濃度細胞分裂素對愈傷恢復生長與增殖生長的影響。
從表2可看出,在添加6-BA的處理中,愈傷組織生長最初為淡黃色,至20 d左右變為黃褐色(圖2-A)。各處理中,6-BA 1.0 mg/L處理愈傷恢復生長率與愈傷組織增長量最高,分別達45.8%、3.2 mm,但愈傷褐化率也達37.5%。其他處理愈傷褐化率也在33.3%~58.3%之間。添加KT的各處理愈傷恢復生長率與愈傷組織增長量均較低,且褐化率在35.4%~60.4%之間。
在添加不同TDZ濃度的處理中,多數外植體愈傷組織發育至外部顏色為潤紅色,且具有分化成芽能力的愈傷組織(圖2-B)。TDZ濃度0.5、1.0 mg/L的處理愈傷恢復生長率與愈傷組織增長量在所有處理中最高,愈傷恢復生長率分別達87.5%、91.7%,愈傷組織增長量分別達5.1、5.5 mm,明顯高于對照及其他處理。
通過比較發現,在添加TDZ 0.5~1.0 mg/L的培養基中愈傷組織能得到較好的增殖。

圖2 鄧恩桉愈傷組織在添加TDZ、6-BA對愈傷繼代增殖的影響

激素濃度/(mg/L)編號愈傷恢復生長率/%外植體褐化率/%愈傷增長量/mmTDZ0M0(CK)0.0dD100.0aA/0.25M147.9cC23.3bB4.10.50M287.5aA10.4cC5.11.00M391.7aA8.3cC5.51.50M462.5bB25.0bB5.62.00M552.1cC28.8bB4.76-BA0M0(CK)0.0dD100.0aA/0.25M635.4bB33.3dD1.50.50M741.7abAB37.5dD2.81.00M845.8aA37.5dD3.21.50M933.3bB47.9cC2.22.00M1016.7cC58.3bB0KT0M0(CK)0.0cC100.0aA/0.25M1114.6bB35.4dD1.50.50M1229.3aA45.8cC2.21.00M1333.8aA43.8cC2.01.50M149.6bB50.0bcBC1.42.00M150.0cC60.4bB0
注:M0(CK)培養基為MS+2,4-D 0.5 mg/L。
2.3不同種類、濃度多胺對愈傷分化不定芽的影響
腐胺、亞精胺是2種常用的多胺。試驗中在添加TDZ 1.0 mg/L的培養基中分別加入不同濃度的腐胺、亞精胺,觀察其對愈傷分化不定芽的影響,不定芽分化過程見圖3。
從表3可以看出,腐胺加入濃度為15、25 mg/L的愈傷分化不定芽的百分率最高,分別達77.1%、79.2%,顯著高于對照和其他處理,褐化率分別為16.7%、14.6%,顯著低于對照及其他處理。其他3個處理愈傷分化不定芽的百分率在45.8%~60.4%之間,同時褐化率也較高。
亞精胺加入濃度25、35、50 mg/L的愈傷不定芽分化率分別為62.5%、66.7%、60.4%,高于對照及其他處理,3個處理之間無顯著差異,這3個處理褐化率在25.0%~33.3%之間。
綜上所述,愈傷組織在含1.0 mg/L TDZ,并添加15~25 mg/L腐胺的MS培養基中培養,可獲得較高的不定芽發生率,且愈傷褐化率也明顯下降。
2.4暗培養與鹽濃度對不定芽形成的影響
將已具備不定芽分化能力的紅色愈傷組織塊移入前面選出的分化培養基中,在不同時間的暗培養后,移入光下培養,接種25 d后調查不定芽發生情況。
從表4可以看出,一定時間的暗培養時間可促進愈傷分化不定芽百分率的提高,并有助于減輕外植體的褐化程度,其中暗培養時間為3、5、7 d處理的不定芽分化率提高幅最大,不定芽分化率分別為85.6%、87.5%、82.8%,外植體褐化率也分別降至12.5%、8.3%、6.3%。當暗培養時間為9~11 d時,褐化率雖然較低,但愈傷分化率急劇下降。因此,暗培養時間以3~7 d為宜,時間過長,不利于愈傷分化率的提高。

多胺濃度/(mg/L)愈傷分化不定芽百分率/%外植體褐化率/%腐胺022.9dD25.0bB545.8cC31.3aA1577.1aA16.7cC2579.2aA14.6cC3560.4bB27.1bB5054.2bcBC39.6aA亞精胺025.0cC27.1bB537.5bcBC37.5aA1547.9bBc22.9cC2562.5aA25.0cC3566.7aA31.3bB5060.4aA33.3bB

表4 不同暗培養天數對愈傷組織不定芽分化率的影響
注:所用分化培養基為MS+TDZ 1.0 mg/L+腐胺15.0 mg/L。
3結論與討論
本文以鄧恩桉種子萌發的15 d苗齡實生苗下胚軸為材料,研究了不同激素種類與濃度及多胺對下胚軸經愈傷組織階段產生不定芽的影響,結果表明:以MS為基本培養基,培養基中添加1.0~1.5 mg/L的2,4-D可誘導鄧恩桉下胚軸產生高質量的愈傷組織。愈傷組織增殖的適合培養基為:MS+TDZ 0.5~1.0 mg/L,在添加TDZ的情況下,愈傷組織褐化率也較對照與其他激素低。將在TDZ培養基上增殖獲取的愈傷組織移入MS+TDZ 1.0 mg/L+腐胺15~25 mg/L的分化培養基中,愈傷不定芽分化率達77.1%~79.2%,愈傷褐化率進一步減輕。愈傷組織塊移入分化培養基初期,3~7 d暗培養可使愈傷不定芽分化率提高到82.8%以上。
2,4-D、NAA是誘導桉樹愈傷組織形成過程中的2種常用激素。國內外有關不同激素對誘導桉樹愈傷組織的影響報道主要集中在不同濃度的2,4-D、IBA、NAA對桉樹愈傷組織誘導的影響[6-7]。3種激素中以2,4-D對愈傷組織的誘導效果最好,在2,4-D濃度為1.0~1.5 mg/L時,愈傷組織誘導率達89.6%~91.7%,這與前人報道的2,4-D可以促進幼嫩組織產生愈傷組織的結果一致。
作為一種新型植物生長調節劑,TDZ具有很強的細胞分裂素活性,近年在植物組織培養中應用較多[8-10],但在桉樹組織培養中應用還很少[11]。在本試驗中,TDZ的添加對愈傷組織增殖與分化具有較好的效果,且褐化率低于添加6-BA與KT的處理,這說明TDZ對于植物傷口愈合反應與細胞的恢復性生長也有一定的幫助,這與有關報道TDZ增加花生幼苗中IAA與色胺酸含量一致[12]。
腐胺又名丁二胺,是生物體內促進細胞生長的重要物質之一。它能直接參與生物體內的多種生理活動,是生物體生長和細胞代謝所必需的痕量生物活性物質,具有促進細胞分裂分化及促進DNA、蛋白質等大分子物質合成的作用。陳小飛等研究發現,在石刁柏離體培養過程中觀察到石刁柏繼代培養基中添加一定濃度的外源腐胺可保持繼代胚性愈傷組織的胚性,且能有效地降低愈傷組織的褐化率[13]。周亞琦等研究雜種榛的繼代培養條件時發現,培養基中添加多胺對組培苗莖段增殖具有良好的效果[14];程云清等在平榛莖段不定芽誘導與快速繁殖研究發現,多胺與亞精胺同時加入可提高不定芽增殖率并加快生長。筆者的研究發現,15~25 mg/L的腐胺與TDZ 1.0 mg/L結合使用,可以極大地促進鄧恩桉愈傷分化不定芽的比率,這對于愈傷組織較難分化的物種具有重要意義。
植物愈傷組織繼代培養時,由于材料切割經常會發生褐變現象,進而引起接種塊褐化死亡。減輕褐化方法主要有材料培養初期暗培養、改變基本培養基鹽濃度及添加防褐劑等[15-16]。本文主要就暗培養對鄧恩桉愈傷分化不定芽的影響進行了研究。結果表明,一定時間的暗培養不僅促進了愈傷組織不定芽分化能力的提高,而且對外植體褐化作用有一定的抑制,但暗培養時間過長時,愈傷分化不定芽比例下降,這可能是暗培養時間過長導致愈傷生長過快,從而影響了鄧恩桉的形態建成有關。
本研究為以鄧恩桉種子下胚軸為材料的快速繁殖工廠化育苗提供了技術基礎,同時所建立的再生體系也為通過轉基因技術進行鄧恩桉遺傳改良的研究創建了良好的再生條件。
參考文獻:
[1] 劉彥偉,馬玲,衡保清,等.漢中市耐寒桉樹引種繁殖試驗[J].陜西林業科技,2014(4):11-14.
[2] 王以紅,吳幼媚,蔡玲,等.鄧恩桉莖段離體培養再生植株的研究[J].林業科技開發,2007,21(6):49-52.
[3] 管朝旭,施彬,曾德賢,等.鄧恩桉組培技術研究[J].桉樹科技,2012,29(4):21-28.
[4] 燕麗萍,夏陽,毛秀紅,等.鄧恩桉的組織培養[J].林業科學,2011,47(5):157-161.
[5] 饒紅欣,彭信海,陳靈,等.鄧恩桉組織培養體系的建立與優化[J].桉樹科技,2008,25(2):1-6.
[6] Diwakar A, Kumar A, Reddy M S. Shoot organogenesis in elite clones ofEucalyptustereticornis[J]. Plant Cell Tissue and Organ Culture, 2010, 102(1): 45-52.
[7] Andrade G, Shah R, Johansson S, et al. Somatic Embryogenesis as a tool for forest tree improvement: a case- study inEucalyptusglobulus[J]. BMC Proc, 2011, 5(7): 128-129.
[8] Amjad M, Abdin M Z. Interactive effect of light, temperature and TDZ on the regeneration potential of leaf discs ofFragaria×ananassaDuch[J]. In Vitro Cellular & Developmental Biology-Plant, 2007, 43(6): 576-584.
[9] 于樹宏,張嫡群,楊雙革.TDZ和CPPU在虎杖組織培養中的應用[J].熱帶亞熱帶植物學報,2010,18(3):13-17.
[10] 張宇. TDZ 在林業科研與生產上的應用探討[J].林業科技情報,2015,47(2):12-13.
[11] S Zhihui, M Tzitzikas, K Raemakers, et al. Effect of TDZ on plant regeneration from mature seeds in pea (Pisumsativum)[J]. In Vitro Cellular & Developmental Biology-Plant, 2009, 45(1): 776-782.
[12] 范春節,王象軍,裘珍飛,等.TDZ對尾細桉葉片離體再生的影響[J].熱帶農業科學,2015,35(9):37-41.
[13] 陳小飛,蕭浪濤,魯旭東,等.外源腐胺對石刁柏愈傷組織胚性能力的影響[J].植物生理學通訊,2007,43(3):461-464.
[14] 周亞琦,梁麗松,黃綿佳,等.平歐雜種榛的繼代培養條件優化研究[J].中國農學通報,2013,29(1):17-23.
[15] 劉劍鋒,程云清,陳智文,等.平歐雜交榛組織培養與快速繁殖技術研究[J].園藝學報,2009,36(3):409-414.
[16] 李菲菲,易春,李青峰,等.蘭花組織培養的褐化現象及控制研究進展[J].南方園藝,2014,25(4):50-52.
[17] 郭艷,楊海玲.植物組織培養中的褐化現象及解決途徑[J].山西農業科學,2009,37(7):14-16,31.
(責任編輯:曾小軍)
Factors Affecting System Establishment of Adventitious Bud Regeneration from Hypocotyls ofEucalyptusdunnii
LU Rong-sheng, HAN Mei-li, LIANG Zhi-qiang, QIN Jian-lin
(Institute of Plant Protection, Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pests, Nanning 530007, China)
Abstract:The hypocotyls from 10-day-old aseptic seedling, were used as explants to investigate the influence of callus formation and adventitious buds differentiation in media adding different types of hormone and ploy-amine, in order to establish a rapid propagation regeneration system of hypocotyls by adventitious bud. The results showed that high quality callus were obtained from hypocotyls in medium with basal MS salt contained 2,4-D 1.0~1.5 mg/L. The medium with basal MS salt adding TDZ 0.5~1.0 mg/L, were most suitable for callus proliferation. The optimal medium for adventitious buds differentiation, was basal MS salt supplemented TDZ 1.0 mg/L and putrescine 15~25 mg/L, and 77.1%~79.2% of adventitious buds differentiation rate were achieved in this medium, meanwhile browning rate of explants were alleviated. Darkness culture for 3~7 d at the early stage of callus subculture, could make adventitious buds differentiation rate increase to 82.8%.
Key words:Eucalyptusdunnii; Hypocotyls; Adventitious bud; Callus; Differentiation
收稿日期:2015-11-18
基金項目:廣西自然科學基金資助項目(2013GXNSFAA019074);廣西作物病蟲害生物學重點實驗室資助項目(13-051-47-KF-3)。
作者簡介:陸榮生(1962─),男,高級工程師,主要從事植物組織培養及遺傳轉化研究。
中圖分類號:Q813.12
文獻標志碼:A
文章編號:1001-8581(2016)06-0031-05

