陽春砂基于轉錄組的萜類合酶基因挖掘及一個單萜合酶基因的克隆
鄧可,楊錦芬,王騰,王虹,王煥,蘇金鋒,詹若挺
(1.廣州中醫藥大學中藥資源科學與工程研究中心,嶺南中藥資源教育部重點實驗室,國家中成藥工程技術研究中心南藥研發實驗室,廣東廣州 510006;2.廣州中醫藥大學中藥學院,廣東廣州 510006)
?
陽春砂基于轉錄組的萜類合酶基因挖掘及一個單萜合酶基因的克隆
鄧可1,楊錦芬1,王騰1,王虹1,王煥1,蘇金鋒2,詹若挺1
(1.廣州中醫藥大學中藥資源科學與工程研究中心,嶺南中藥資源教育部重點實驗室,國家中成藥工程技術研究中心南藥研發實驗室,廣東廣州510006;2.廣州中醫藥大學中藥學院,廣東廣州510006)
摘要:【目的】深入挖掘陽春砂轉錄組中揮發性萜類合酶相關基因,為全面認識陽春砂揮發性萜類代謝途徑和分子調控模式奠定基礎。【方法】整理前期工作獲得的陽春砂2個轉錄組的數據,篩選已注釋的及利用本地blast方法再注釋的萜類合成途徑的unigene;并通過對部分候選unigene的表達量與揮發性萜類化合物含量的相關性分析及生物信息學分析,進一步篩選出相關基因;采用PCR及重組載體構建的方法克隆其中一個單萜合酶基因,并對其編碼蛋白序列進行分析。【結果】篩選得到10個揮發性萜類合成上游途徑相關unigene及11個下游萜類合酶基因;相關性分析證明候選基因與陽春砂主要揮發性萜類有較強相關性;并成功克隆得到AvTPS1基因,其序列包含1 803 bp的開放閱讀框,編碼600個氨基酸;其編碼蛋白含有單萜合酶蛋白特有的DDXXD、RRX8W和NSE/DTE等保守基序,N端含有一段葉綠體轉運肽;系統進化分析表明AvTPS1屬于TPS-b亞家族。【結論】結合轉錄組、表達譜數據的深入挖掘和與揮發性萜類化合物數據的關聯,有效篩選出了陽春砂多個值得后續研究的萜類合酶基因;其中對AvTPS1的克隆及生物信息學分析為后續功能鑒定提供了基礎。
關鍵詞:陽春砂;轉錄組;萜類合酶基因;基因克隆
砂仁是芳香化濕類中藥,也是我國“四大南藥”之一,其性溫,味辛,具有化濕開胃、溫脾止瀉、理氣安胎等功效[1]。陽春砂Amomum villosum Lour.是砂仁的主流品種,廣東陽春所產的道地藥材陽春砂品質最佳[2-3]。揮發油是陽春砂芳香化濕、行氣止痛的主要物質基礎。道地藥材陽春砂果實揮發油中含有豐富的揮發性萜類,主要由單萜、倍半萜及其衍生物組成,如乙酸龍腦酯、樟腦、龍腦、芳樟醇和雙環大根香葉烯等,其中乙酸龍腦酯含量最高,具有顯著的藥理活性[4-7]。因此,揮發性萜類化合物在陽春砂藥效方面發揮著重要作用。
植物萜類的合成途徑主要分4個階段[8]:首先是異戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)及其雙鍵異構體二甲基丙烯焦磷酸(dimethylally pyrophosphate,DMAPP)的合成。其合成途徑主要有2條,即細胞質中的甲羥戊酸(mevalonate pathway,MVA)途徑和質體中的脫氧木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphatepathway,DXP)途徑[9 -11]。IPP和DMAPP在異戊烯基轉移酶(isoprenyl transferases)作用下經頭對尾或頭對頭融合形成不同長度的異戊二烯焦磷酸鏈。之后經萜類合酶,也稱萜環化酶(terpenoid synthases/cyclases,TPS)催化環化和重排生成萜骨架。最后,細胞中內質網上的一些酶如P450單加氧酶等對萜骨架進行羥基化、甲基化等修飾。最終萜類產物的種類、產量和比例都受到多個關鍵酶的調控。對陽春砂藥效成分揮發性萜類生物合成途徑及相關酶基因進行研究,將為全面深入認識陽春砂揮發性萜類代謝途徑和分子調控機制奠定基礎。
本課題組前期已獲得2個陽春砂轉錄組及相應多個表達譜[12-13]。本研究將通過各類生物信息學方法對轉錄組及表達譜數據進行整理,初步篩選出部分陽春砂揮發性萜類代謝途徑相關基因;并通過關聯陽春砂基因表達譜數據和對應樣品揮發性萜類含量變化數據,更全面地發掘萜類合酶基因。另一方面,也對篩選所得的其中1個萜類合酶基因進行克隆,并分析其編碼蛋白序列,為進一步的基因功能鑒定和應用于陽春砂揮發性萜類代謝工程的研究奠定基礎,現報道如下。
1 材料與方法
1.1植物材料所用陽春砂材料種植于廣州中醫藥大學大學城校區時珍山,移栽自廣東陽春,經廣州中醫藥大學楊錦芬研究員鑒定為陽春砂Aomomum villosum Lour.。
1.2主要試劑植物RNA提取試劑盒購自艾德萊生物有限公司;第一鏈cDNA合成試劑盒及pLB平末端克隆載體購自天根生化科技有限公司;高保真PrimeSTAR酶、ExTaq酶和其他PCR所需試劑、電泳所需Marker、感受態細胞及純化回收試劑盒均購自大連寶生物有限公司;引物合成和基因測序由廣州華大基因有限公司完成。
1.3轉錄組數據分析本課題組前期已獲得陽春砂果實發育不同時期的轉錄組(命名為AvD)和茉莉酸甲酯(MeJA)誘導的轉錄組(AvM)數據,統計KEGG注釋數據中揮發性萜類相關通路的unigene并篩選代表基因(基因長度≥700 bp,表達量較高)。結合陽春砂中含有的主要揮發性萜類成分相關的生物合成途徑中的酶基因,在美國國立生物技術信息中心(NCBI)中查找并下載其他物種中已鑒定的揮發性萜類合酶氨基酸序列,作為探針序列,通過本地BLAST軟件blast-2.2.30+在2個陽春砂轉錄組數據中進行blastp比對,對unigene進行再注釋,以相似度≥40%、比對長度≥100、比對分數≥100、基因長度≥1 000 bp為條件篩選出候選unigene。利用本地BLAST軟件進行blastn比對,關聯2個轉錄組間的unigene。
1.4相關性分析采用SPSS 17.0統計軟件的Pearson算法對課題組前期獲得的MeJA誘導實驗中陽春砂揮發性萜類含量數據[13]及轉錄組AvM中候選基因的表達量進行雙變量線性相關系數計算;所得相關系數利用R語言軟件包中的pheatmap軟件繪制熱圖,熱圖繪制由廣州基迪奧生物科技有限公司協助完成。
1.5AvTPS1的克隆陽春砂葉片總RNA的提取參照艾德萊EASYspin Plus植物RNA提取試劑盒說明書進行。取1 μg總RNA按照天根cDNA第1鏈合成說明書進行cDNA第1鏈的合成。從轉錄組數據中提取候選AvTPS1核酸序列,根據ORFfinder預測所得開放閱讀框,使用Primer Premier 5軟件在5’端與3’端非編碼區設計引物AvF1:5’-TT TTATCCCACATTTCAC-3’與AvR1:5’-GCTCCATG TAGATAGATTATC-3’,使用高保真PrimeSTAR酶通過2輪PCR從陽春砂cDNA中克隆基因編碼區全長。PCR第1輪反應程序為:95℃變性10 s,53.5℃退火15 s,72℃延伸10 s,35個循環;取第1輪PCR產物進行第2輪擴大PCR:95℃變性10 s,53.5℃退火15 s,72℃延伸10 s,40個循環,72℃延伸5min。擴增產物用10 g/L瓊脂糖凝膠電泳檢測,回收純化后連接到pLB平末端克隆載體上,轉化感受態大腸桿菌,進行抗性篩選,挑取陽性克隆單菌落用于檢測和測序。
1.6生物信息學分析運用在線工具ORFfinder進行ORF預測;使用NCBI在線工具進行blastp比對查找并下載同源相似性較高的相似序列信息;使用本地軟件ClustalX 2.1進行多序列比對;利用Mega 5.1軟件的Neighbor-Joining算法繪制系統發育樹進行遺傳進化分析。使用在線工具ProtParam對蛋白理化性質進行預測;ChloroP 1.1 Server和TargetP 1.1 Server進行亞細胞定位;ProtScale的Kyte & Doolittle算法進行親疏水性分析。使用SWISS-MODEL Workspace在線數據庫對編碼蛋白進行同源建模。
2 結果與分析
2.1陽春砂揮發性萜類合成上游途徑關鍵基因的轉錄組分析DXP途徑和MVA途徑中的關鍵酶——1-去氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphatesynthase,DXS)、1-去氧-D-木酮糖-5 -磷酸還原異構酶(1 -deoxy -D -xylulose-5-phosphate reductoisomerase,DXR)和3-羥基-3-甲基戊二酰輔酶A還原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR),以及異戊烯基轉移酶中催化合成香葉基焦磷酸(GPP)與法呢基二磷酸(FPP)的香葉基二磷酸合酶(geranyl diphosphate synthase,GPPS)和法呢基二磷酸合酶(farnesyl diphosphate synthase,FPPS)是本研究重點關注的萜類合成上游途徑關鍵酶。萜類相關的unigene在經MeJA誘導的轉錄組AvM中較未經誘導的轉錄組AvD中得到更多的注釋[13],因此對該部分轉錄組AvM的數據進行重點展示。揮發性萜類合成上游途徑在KEGG數據庫中對應到萜類骨架生物合成途徑(terpenoid backbone biosynthesis,ko00900),該通路共注釋21個酶基因共160個unigene;其中注釋到7個HMGR,10 個DXR,30個DXS,3個GPPS和1個FPPS unigene。本研究對篩選長度最長、表達量較高的10個unigene進行展示并重命名,結果見表1。
其中,本研究中篩選得到的AvHMGR1、AvDXR1 和AvDXS1(Unigene0057019、Unigene0056545和Unigene0077967),與課題組前期通過同源克隆3個關鍵基因AvHMGR(FJ455511.1)、AvDXR (FJ459894.1)和AvDXS(FJ455512.1)[14-17],序列相似度分別達到99.95%、99.88%和99.57%;推測這3個unigene即對應前期克隆所得的上述3個關鍵基因。從2個轉錄組數據推測,陽春砂基因組中有多個HMGR、DXR和DXS基因,尤其是DXS,在轉錄組AvD中注釋到60個unigene[12],結合前期研究發現的AvDXS在多種器官中的高表達量[15],更可確認其具有看家基因的特性。
2.2陽春砂揮發性萜類合酶基因的轉錄組分析
2.2.1已注釋揮發性萜類合酶相關基因的整理萜類合酶基因(TPS)為揮發性萜類合成下游途徑的關鍵酶基因,對應到KEGG數據庫中的單萜生物合成途徑(monoterpenoid biosynthesis,ko00902)及倍半萜生物合成途徑(sesquiterpenoid and triterpenoid biosynthesis,ko00909)2個通路中。其中轉錄組AvD僅在單萜通路中注釋到1個unigene,而經MeJA誘導轉錄組AvM在單萜合成通路中共注釋3個單萜合酶基因(12個unigene),在倍半萜及三萜生物合成途徑中注釋到2個三萜合酶基因(13個unigene),但并未注釋到倍半萜合成相關酶基因,故不在本文中贅述。綜合2個陽春砂轉錄組,被直接注釋到的3個單萜酶基因分別是月桂烯/羅勒烯合酶(myrcene/ocimene synthase,MS/OS,下簡稱MS)、芳樟醇合酶[(3S)-linalool synthase,LIS]和新薄荷醇脫氫酶[(+)-neomenthol dehydrogenase,NDS]基因,其中LIS與NDS為轉錄組AvM中首次被注釋到的單萜合酶基因;篩選得長度最長、表達量較高的10個unigene,結果表2。
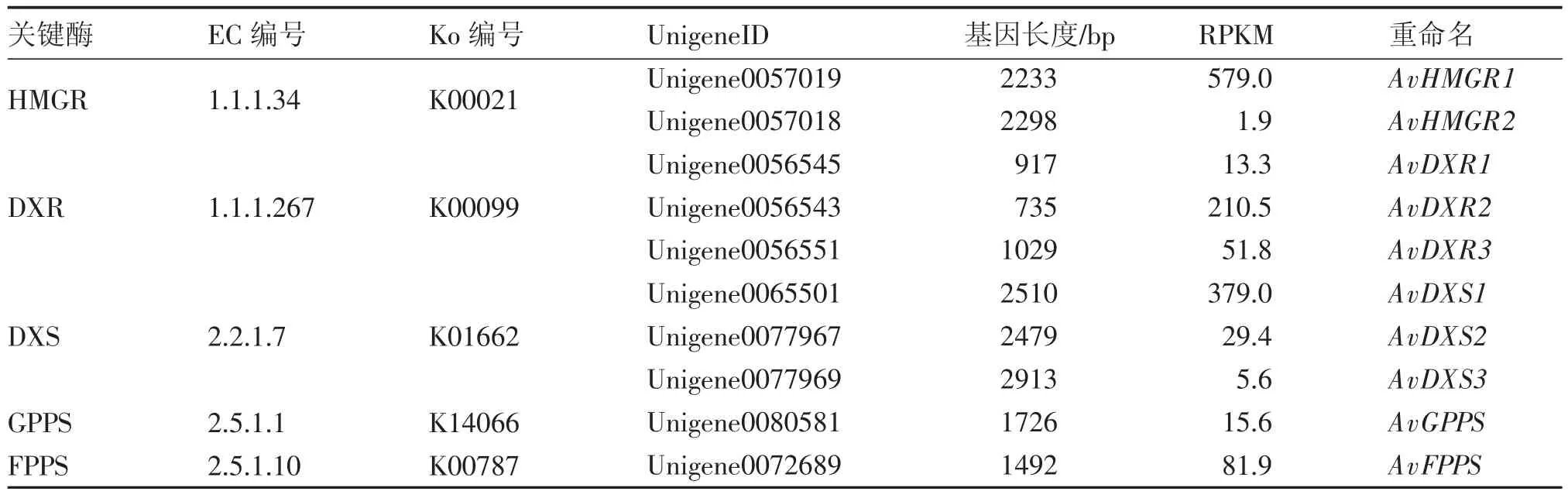
表1 已注釋的陽春砂萜類骨架合成通路候選基因整理Table 1 Data of the annotated candidate genes involved in terpenoid backbone biosynthesis pathway of A.villosum
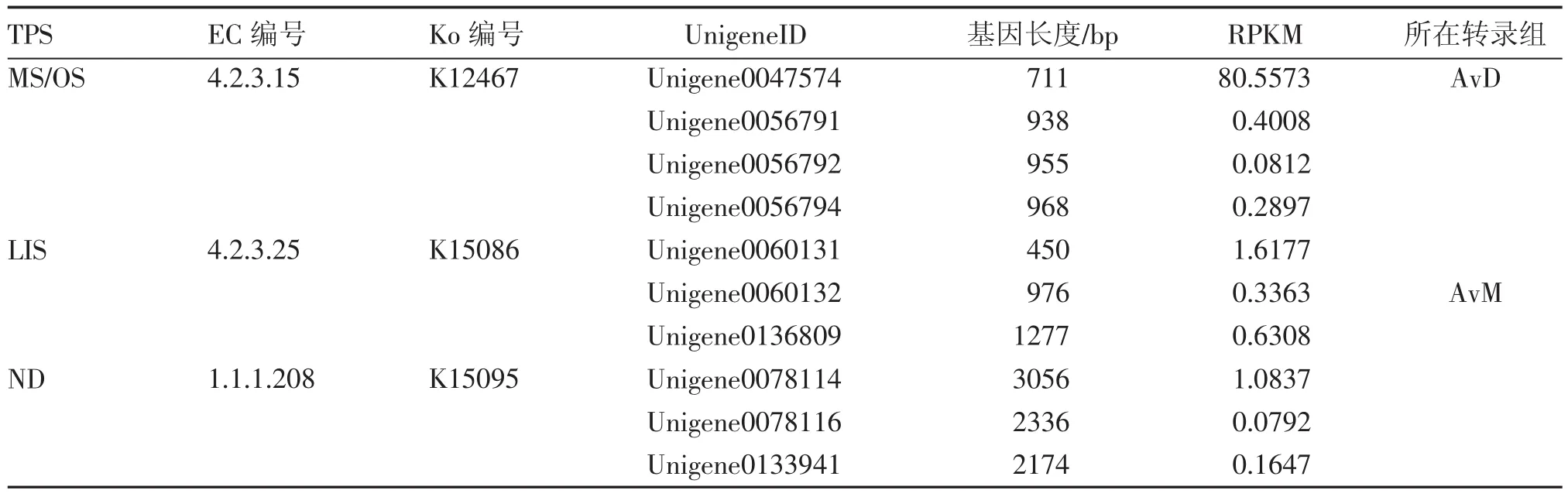
表2 已注釋的陽春砂單萜合成通路候選基因整理Table 2 Data of the annotated candidate genes involed in monoterpenoid biosynthesis pathway of A.villosum
2.2.2本地blast再注釋揮發性萜類合酶相關基因的整理根據本課題組對陽春砂果實揮發性萜類的測定結果[13],陽春砂種子團及果皮中含量較高的單萜有乙酸龍腦酯、樟腦、龍腦、芳樟醇、β-蒎烯、α-蒎烯、月桂烯和松油醇等;倍半萜類則以雙環大根香葉烯為主。其中芳樟醇及月桂烯合酶相關基因已被注釋(表2),本部分主要關注其他7個化合物對應的合酶基因,包括龍腦基二磷酸合酶[(+)-bornyl diphosphate synthase,BDS]、β-蒎烯合酶[(-)-beta-pinene synthase,BPS]、α-蒎烯合酶[(-)-alpha-pinene synthase,APS]、松油烯合酶(1,8-cineole synthase,TPS-Cin)和雙環大根香葉烯合酶(bicyclogermacrene synthase,BGS)5個合酶基因。從NCBI下載上述基因序列(具體序列信息詳見表3),以這些序列作為探針,在轉錄組AvD 和AvM中進行本地blast再注釋,篩選出5個合酶(包括4個單萜合酶及1個倍半萜合酶)基因共17 個unigene,轉錄組信息及比對結果如表4所示。
2.2.3候選AvTPS的確定將2.2.1和2.2.2所得的來源于不同轉錄組卻被同一單萜合酶基因注釋上的unigene進行blastn關聯比對,部分來自于不同轉錄組被注釋的unigene具有極高的相似度,當相似度達到99%以上、比對分數大于1 000時,認為這些來源于不同轉錄組的相似unigene對應陽春砂中的同一基因(表4)。綜合上述結果,對篩選到的揮發性萜類合酶下游基因(AvTPS)進行重命名,確定其代表unigene(表5),以測序長度較長的轉錄組AvDunigene作為AvTPS的核酸序列參考,以檢測部位及組別較多的轉錄組AvMunigene作為AvTPS的表達量參考以供后續分析使用。
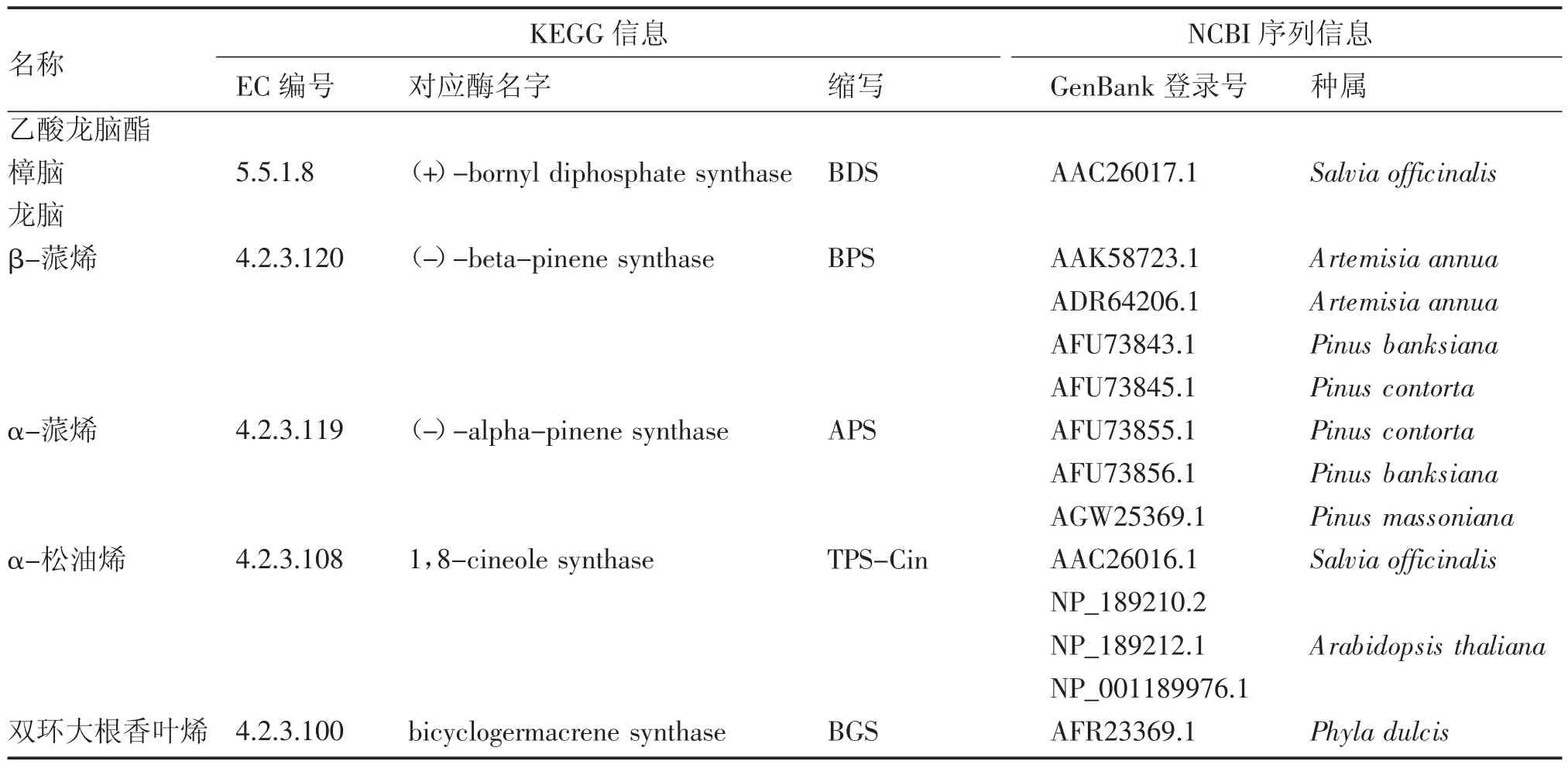
表3 陽春砂主要成分相關酶序列下載信息Table 3 Information of enzymes related to main volatile terpenes in A.villosum
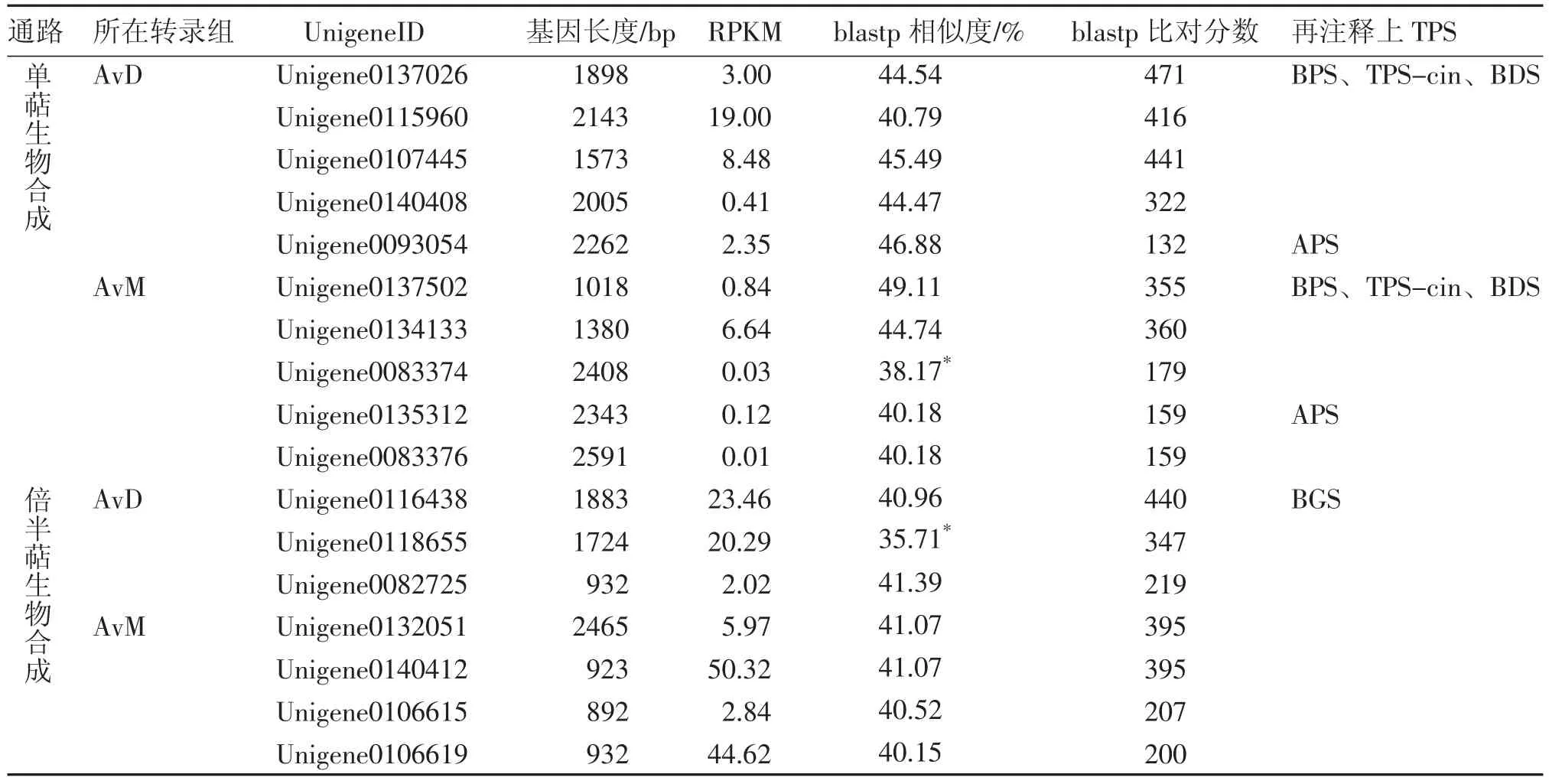
表4 再注釋的陽春砂揮發性萜類合酶候選基因整理Table 4 Data of the reannotated candidate genes of volatile terpene synthase of A.villosum
2.3候選基因表達量與主要揮發性萜類含量相關性分析提取上述2.1和2.2篩選所得春砂的主要揮發性萜類成分含量進行相關分析,計算得到的Pearson相關系數如圖1所示,其中AvTPS3和AvTPS4的代表unigene由于在考察組別均未能測得表達量,故不參與分析。圖1結果顯示:大部分陽春砂候選基因與除了α-蒎烯外的陽春砂主要揮發性萜類均表現出相關系數絕對值大于0.6的較強相關性,表明篩選得到的這些陽春砂候選基因有較大可能參與揮發性萜類的合成過程。
圖1顯示:基因表達量與化合物含量的相關模式大體分為2種:第1種是與芳樟醇、β-蒎烯等陽春砂果皮中主要成分正相關,與乙酸龍腦酯、樟腦、雙環大根香葉烯等種子團中的主要成分[13]負相關;第2種則與種子團中成分正相關,與果皮主要成分負相關。在上游候選基因的相關分析中(圖1-a),與單萜合成直接相關的DXP途徑的關鍵基因AvDXR和AvDXS基本與陽春砂果皮中的主要成分正相關,而與種子團中主要成分負相關;而AvDXS1則與MVA途徑的關鍵基因AvHMGR一樣呈現第2種相關模式;不僅印證了陽春砂內含有多個DXS基因的猜想,同時體現出,這2個途徑在陽春砂果實不同部位中參與不同有效成分的合成。而在TPS候選基因的相關性分析(圖1-b)顯示:不同的AvTPS基因呈現出不一樣的相關模式,如果根據相關模式劃分,則相同模式的AvTPS5與AvTPS9、或AvTPS6與AvTPS11可能含有相似功能。
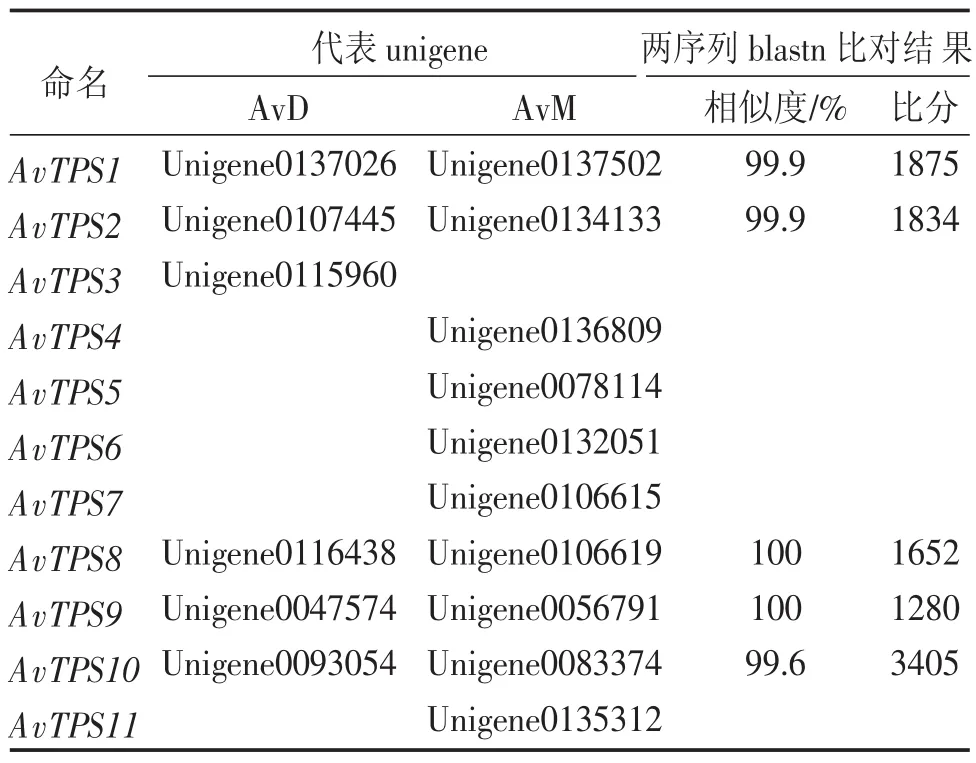
表5 AvTPS的命名與代表unigene的確定Table 5 AvTPS name and the candidate unigenes data
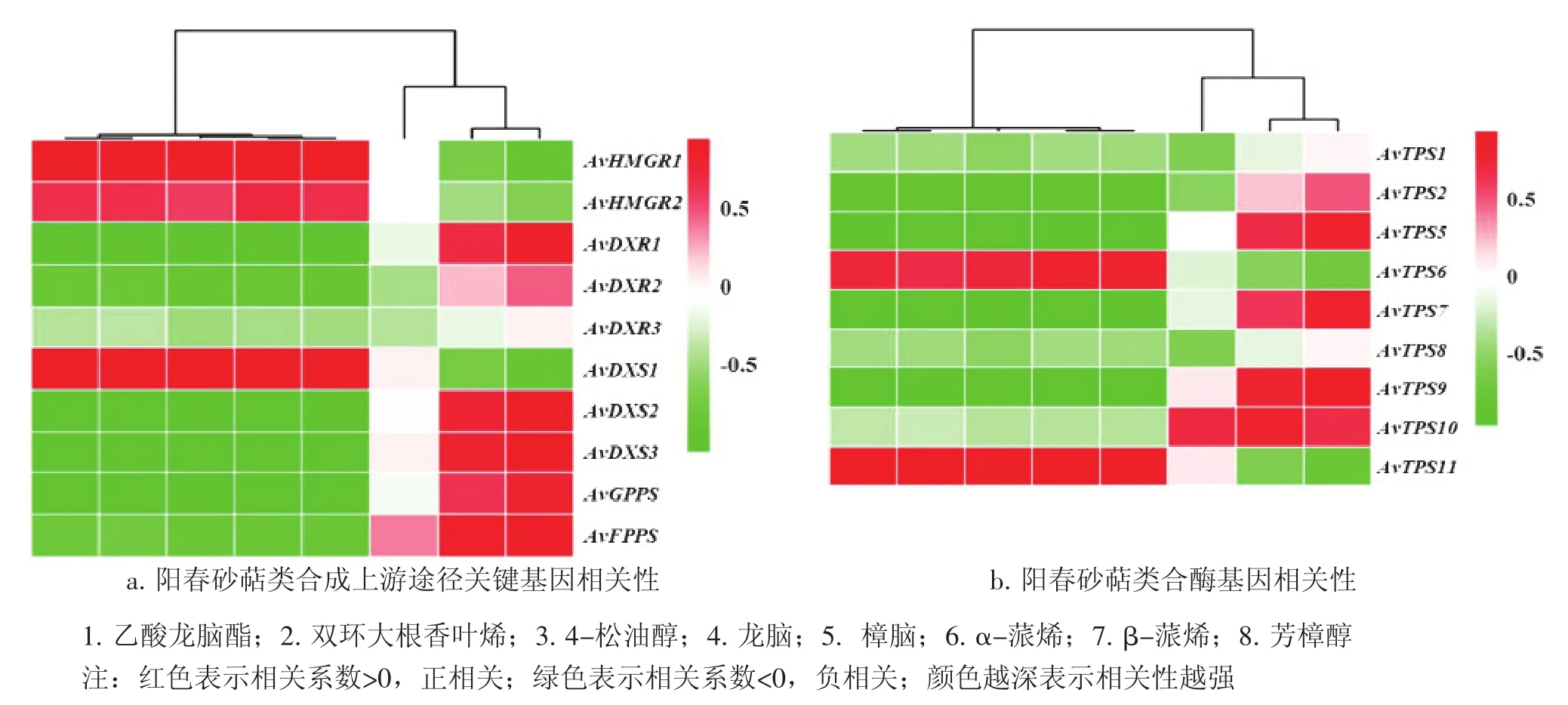
圖1 候選基因表達量與主要揮發性萜類含量相關系數熱圖Figure 1 Heat map of the correlation coefficient of candidate unigenes expression levels and main volatile terpene contents
2.4AvTPS1克隆及編碼蛋白序列分析根據AvTPS1(轉錄組Unigene0137026)的核苷酸序列設計引物,以陽春砂葉片cDNA為模板,克隆AvTPS1含全長ORF DNA片段;測序結果顯示:克隆所得的AvTPS1全長cDNA共1 881 bp,開放閱讀框為1 803 bp,編碼600個氨基酸,所得氨基酸序列與Unigene0137026的預測氨基酸序列一致。
AvTPS1編碼蛋白(以下簡稱AvTPS1)預測分子量為68.92 kDa,等電點為5.56,分子式為C3086H4776N840O914S21,與已有的TPS蛋白序列性質相似。經ChloroP及TargetP預測,AvTPS1編碼蛋白N端含有一段葉綠體轉運信號肽,信號肽的剪切位點在42號位;而AvTPS1多肽鏈中親水區域大于疏水區域,預測該蛋白屬于親水性蛋白。利用SWISS-MODEL Workspace對AvTPS1進行同源建模,與來源于留蘭香(Menthaspicata)的4S-檸檬烯合酶[20]及來源于鼠尾草(Salvia officinalis)的(+)-龍腦基二磷酸合酶[21]同源相似性分別為41.26%及42.96%,具有相似的蛋白結構與功能區。
取AvTPS1序列進行NCBI blastp比對,比對上大量單萜或倍半萜合酶基因,其中與姜花葉綠體單萜合酶基因同源相似度最高,達到87%;選取相似度大于50%的序列進行多序列比對分析,發現AvTPS1氨基酸序列中含有多個已知萜類合酶序列的保守模體(conserved motifs),如RRX8W、RXR、DDXXD和NSE/DTE[即(N,D)D(l,I,V)X(S,T)XXXE],如圖2所示。其中,天冬氨酸富集區DDXXD和NSE/DTE這2個保守區,通過與金屬離子(如Mg2+和Mn2+)的絡合來結合催化底物(GPP等),是單萜、倍半萜以及二萜合成酶所屬的離子化依賴的萜類合酶共有的功能結構域[22-23];精氨酸保守區RRX8W能通過異構作用間接催化生成環狀萜類[20];而RXR區域則可能參與萜品烯的催化反應[24]。這些保守模體的分析,更提示AvTPS1極有可能參與揮發性萜類的合成。
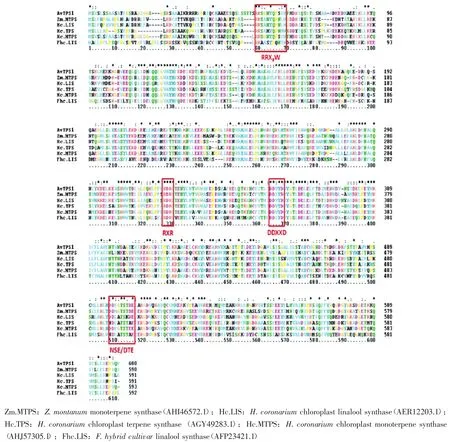
圖2 AvTPS1相似序列比對及功能結構域展示Figure 2 Similar sequence alignment and functional domain of AvTPS1
將AvTPS1與已發表的植物萜類合酶氨基酸序列構建系統進化樹,結果見圖3。圖3中涉及的TPS亞家族的劃分參照Chen等[25]在2011年劃分的新標準,分為TPS-a~TPS-h 7個亞家族,其中TPS-h亞家族未在圖中展示。圖3顯示:單萜及倍半萜合酶多集中于TPS-b、a、g和d 4個亞家族;而AvTPS1所在的TPS-b亞家族不僅是被子植物中顯花植物特有的家族,也是單萜合酶基因特有的亞家族,該家族的單萜合酶主要用于催化環狀單萜的合成[18,25]。
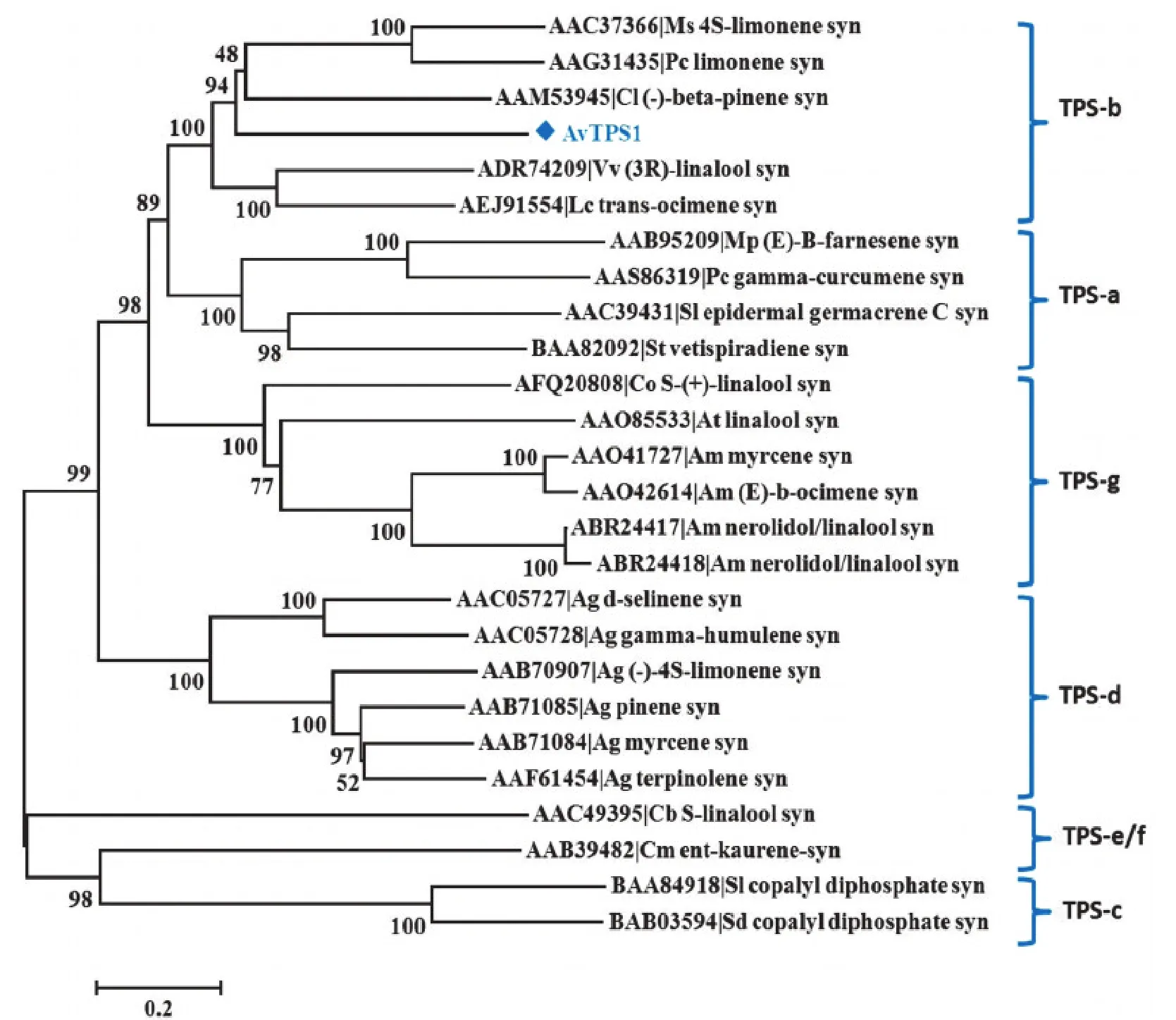
圖3 AvTPS1與其他已知萜類合酶(TPS)的系統進化樹分析Figure 3 Phylogenetic analysis of AvTPS1 and other known terpene synthases
3 討論
本研究對陽春砂轉錄組中陽春砂揮發性萜類合成途徑相關基因進行了深入挖掘,對已注釋到的揮發性萜類合成相關KEGG通路中的unigene進行了提取和篩選,共獲得10個上游途徑候選unigene 和11個下游途徑合酶候選unigene,對已注釋基因的挖掘是目前在無參轉錄組中尋找目的基因的最常用方法[26]。但在陽春砂轉錄組中,僅被注釋上3個下游的單萜合酶基因,同時還存在大量的未注釋基因,這些未被注釋的unigene可能包含陽春砂中特異表達的功能基因[27]。所以利用本地blast反向比對的方法對陽春砂轉錄組中的基因進行再注釋,得到多個萜類合酶相關的17個再注釋unigene,后續的相關性分析和生物信息學分析也證明了這些unigene與萜類合成相關,從而驗證了該方法的有效性。
在進行本地blast再注釋的過程中發現,不同的探針序列會對相同的unigene進行注釋,如表4 中Unigene0137026、Unigene0107445等unigene能同時被BDS、BPS、TPS-cin注釋上。推測原因有二:①是由于TPS酶和底物多樣性的特點[28],很多萜類合酶能催化生成多種產物,如從鼠尾草中分離的龍腦基二磷酸合酶,除了生成(+)-龍腦基焦磷酸外,還能生成大量的(+)-α-蒎烯,(+)-莰烯和(±)-檸檬烯,同時具有龍腦二磷酸合酶和蒎烯合酶的功能[29]。②被子植物TPS的系統發育和譜系分化與植物自然分類系統聯系更密切,相同物種來源的TPS相似性遠高于功能相同而來源不同的TPS,所以基于序列相似性的查找僅可以判斷其是否萜類合酶,卻不能預測其產物[18-19],需要進一步實驗功能驗證。萜類合酶基因在植物中多以基因家族的形式存在[30],所以在unigene間關聯比對時,發現篩選得到的候選基因中存在不少序列相似的unigene,這些unigene可能是一個基因家族中的不同成員,是同一萜類合酶的不同剪接,在陽春砂中行使相似的功能。
本研究中無論是基因表達量與揮發性萜類含量的相關性分析,還是對克隆基因AvTPS1的生物信息學分析,均只是功能預測;但基因表達與化合物的生成中間還要經過蛋白、激素等多方面調控,并非簡單的線性相關關系,還須對候選基因進行基于原核或真核的表達功能的功能鑒定。本課題組后續將克隆本研究篩選到的其他AvTPS,并通過基于原核和真核表達系統的功能鑒定,進一步確認AvTPS的催化功能及其在揮發性萜類合成過程中的作用。
參考文獻:
[1]國家藥典委員會.中華人民共和國藥典(一部)[M].北京:中國醫藥科技出版社,2015.
[2]丁平,劉軍民,徐鴻華.商品砂仁的質量評析[J].中國中藥雜志,2002,27(10):786.
[3]陳蔚文,徐鴻華.嶺南道地藥材研究[M].廣州:廣東科技出版社,2007.
[4]余競光,孫蘭,周立東,等.中藥砂仁化學成分研究[J].中國中藥雜志,1997,22(4):39.
[5]丁平,杜景峰,魏剛,等.砂仁與長序砂仁揮發油化學成分的研究[J].中國藥學雜志,2001,36(4):19.
[6]吳曉松,李曉光,肖飛.砂仁揮發油中乙酸龍腦酯鎮痛抗炎作用的研究[J].中藥材,2004,27(6):438.
[7]胡玉蘭,張忠義,林敬明.中藥砂仁的化學成分和藥理活性研究進展[J].中藥材,2005,28(1):72.
[8]Kumari S,Priya P,Misra G .Structural and biochemical perspectives in plant isoprenoid biosynthesis[J].Phytochem Rev,2013,12(2):255.
[9]張長波,孫紅霞,鞏中軍,等.植物萜類化合物的天然合成途徑及其相關合酶[J].植物生理學通訊,2007,43(4):779.
[10]Rohmer M.From molecular fossils of bacterial hopanoids to the formation of isoprene units:discovery and elucidation of the methylerythritol phosphate pathway[J].Lipids,2008,43(12):1095.
[11]Bouwmeester H J.Engineering the essence of plants[J].Nat Biotechnol,2006,24(11):1359.
[12]于安民.基于RNA-Seq的陽春砂果實發育過程中糖和萜類代謝的研究[D].廣州:廣州中醫藥大學,2014.
[13]王煥,楊錦芬,鄧可,等.茉莉酸甲酯影響陽春砂揮發性萜類代謝和基因轉錄[J].世界科學技術—中醫藥現代化,2014 (7):1528.
[14]楊錦芬.陽春砂萜類成分生物合成上游功能基因的克隆及表達分析[D].廣州:廣州中醫藥大學,2008.
[15]Yang J,Adhikari M N,Liu H,et al.Characterization and functional analysis of the genes encoding 1-deoxy-D-xylulose-5 -phosphate reductoisomerase and 1 -deoxy -D -xylulose -5 -phosphate synthase,the two enzymes in the MEP pathway,from Amomum villosum Lour.[J].Mol Biol Rep,2012,39(8):8287.
[16]魏潔書.基于陽春砂HMGR和DXR基因的萜類化合物生物合成調控研究[D].廣州:廣州中醫藥大學,2013.
[17]魏潔書,楊錦芬,凌敏,等.茉莉酸甲酯調控陽春砂HMGR、DXR和DXS基因表達[J].廣州中醫藥大學學報,2013,30 (1):88.
[18]Bohlmann J,Meyer -Gauen G,Croteau R.Plant terpenoid synthases:molecular biology and phylogenetic analysis[J].Proc Natl Acad Sci U S A,1998,95(8):4126.
[19]徐應文,呂季娟,吳衛,等.植物單萜合酶研究進展[J].生態學報,2009,29(6):3188.
[20]Hyatt D C,Youn B,Zhao Y,et al.Structure of limonene synthase,a simple model for terpenoid cyclase catalysis[J].Proc Natl Acad Sci U S A,2007,104(13):5360.
[21]Whittington D A,Wise M L,Urbansky M,et al.Bornyl diphosphate synthase:structure and strategy for carbocation manipulation by a terpenoid cyclase[J].Proc Natl Acad Sci U S A,2002,99(24):15375.
[22]Christianson D W.Structural biology and chemistry of the terpenoid cyclases[J].Chem Rev,2006,106(8):3412.
[23]Oldfield E,Lin F Y.Terpene biosynthesis:modularity rules [J].Angew Chem Int Ed Engl,2012,51(5):1124.
[24]Aubourg S,Lecharny A,Bohlmann J.Genomic analysis of the terpenoid synthase(AtTPS)gene family of Arabidopsis thaliana [J].Mol Genet Genomics,2002,267(6):730.
[25]Chen F,Tholl D,Bohlmann J,et al.The family of terpene synthases in plants:a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom[J].Plant J,2011,66(1):212.
[26]郭溆.基于轉錄組測序的石斛生物堿和人參皂苷生物合成相關基因的發掘、克隆及鑒定[D].北京:北京協和醫學院,2013.
[27]Galata M,Sarker L S,Mahmoud S S.Transcriptome profiling,and cloning and characterization of the main monoterpene synthases of Coriandrum sativum L[J].Phytochemistry,2014,102:64.
[28]Tholl D.Terpene synthases and the regulation,diversity and biological roles of terpene metabolism[J].Curr Opin Plant Biol,2006,9(3):297.
[29]Wise M L,Savage T J,Katahira E,et al.Monoterpene synthases from common sage(Salvia officinalis).cDNA isolation,characterization,and functional expression of(+)-sabinene synthase,1,8-cineole synthase,and(+)-bornyl diphosphate synthase[J].J Biol Chem,1998,273(24):14891.
[30]李路路,王歡,孫明,等.岷江百合單萜合酶基因克隆與表達分析[J].福建農林大學學報(自然科學版),2014(4):397.
【責任編輯:黃玲】
Mining of Genes Involved in Terpenoid Synthases Based on Transcriptome Analysis and Cloning of Monoterpene Synthase from Amomum villosum Lour.
DENG Ke1,YANG Jinfen1,WANG Teng1,WANG Hong1,WANG Huan1,SU Jinfeng2,ZHAN Ruoting1
(1.Research Center of Chinese Medicinal Resource Science and Engineering,Ministry of Education Key Laboratory of Chinese Medicinal Resources from Lingnan,Joint Laboratory of National Engineering Research Center for the Pharmaceutics of Traditional Chinese Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China;2.School of Chinese Herbal Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China)
Abstract:Objective To dig out the related volatile terpene synthase genes from transcriptome of Amomum villosum Lour.,so as to lay the foundation for comprehensive understanding of volatile terpenoid biosynthesispathway and molecular regulation mode.Methods Based on the obtained results of the two transcriptome of Amomum villosum Lour.,we screened out the unigenes involved in volatile terpenoid biosynthesis pathway which had been annotated or was reannotated by blast method.After analyzing the correlation of the expression of partial candidate unigenes with the contents of volatile terpenoids and their bioinformatics,we selected out the relative unigenes.One monoterpene synthase gene of them was cloned by polymerase chain reaction(PCR)and recombinant vector construction methods,and then the protein coding sequences of the monoterpene synthase gene were analyzed.Results Ten candidate terpenoid biosynthesis upstream pathway unigenes and 11 candidate downstream pathway genes were obtained from the transcriptome of Amomum villosum Lour..The data proved that the expression of the candidate genes had a strong relationship with main volatile terpenes of Amomum villosum Lour..AvTPS1 had been cloned successfully,which contained 1 803 bp open reading frame(ORF),encoding 600 amino acids.The encoded protein of AvTPS1 contained the specific conservative sequences DDXXD,RRX8W and NSE/DTE which were special for terpene synthase protein,and N-terminal of the encoded protein had a chloroplast transit peptide.Phylogenetic analysis showed that AvTPS1 belonged to the subfamily of TPS-b terpene synthase.Conclusion Based on the results of transcriptome and gene expression profile of Amomum villosum Lour.,and on the correlation of gene expression profile with the content of volatile terpenoids,we found out several valuable candidate terpene synthases genes from Amomum villosum Lour..And the analysis results of clone and bioinformatics of AvTPS1 will supply evidence for the future study of gene function characterization.
Key words:Amomum villosum Lour.;transcriptome;terpene synthases gene;gene clone
中圖分類號:R284.1
文獻標志碼:A
文章編號:1007-3213(2016)03 - 0395 - 09
DOI:10.13359/j.cnki.gzxbtcm.2016.03.026
收稿日期:2015-12-21
作者簡介:鄧可(1991-),女,碩士研究生;E-mail:745074686@qq.com
通訊作者:楊錦芬(1978-),女,研究員;E-mail:yangif@gzucm.edu.cn
基金項目:國家自然科學基金青年科學基金項目(編號:81303163);廣東省高等學校優秀青年教師培養計劃項目(編號:Yq2013042);廣州中醫藥大學青年英才培養項目(編號:AAC414124A08)

