地塞米松對哮喘小鼠CD4+ CD25+調節性T細胞及IL-4 TGF-β水平的影響*
馬祥 劉洪 李群英 梁宗安
(1.成都市第一人民醫院呼吸內科,四川 成都 610041;2.四川大學華西醫院呼吸內科, 四川 成都 610041)
·論著·
地塞米松對哮喘小鼠CD4+CD25+調節性T細胞及IL-4 TGF-β水平的影響*
馬祥1劉洪1李群英1梁宗安2
(1.成都市第一人民醫院呼吸內科,四川 成都 610041;2.四川大學華西醫院呼吸內科, 四川 成都 610041)
【摘要】目的探討地塞米松對哮喘小鼠CD4+、CD25+調節性T細胞( regulatory T cells,Treg) 及IL-4、TGF-β水平的影響。方法30只雄性BALB/c小鼠隨機分為正常對照組、哮喘組及地塞米松組3組各10只;利用雞卵白蛋白腹腔注射、霧化吸入制備哮喘模型;使用流式細胞儀分別檢測各組小鼠脾臟單個核細胞CD4+、CD25+Treg細胞占CD4+T細胞的百分比;使用Western Blot方法分析IL-4在小鼠肺組織中的表達情況;使用酶聯免疫吸附試驗方法檢測各組小鼠血清中TGF-β的水平。結果哮喘組小鼠脾單個核細胞CD4+、CD25+Treg細胞百分比及TGF-β水平較正常對照組降低(均P<0.05),哮喘組IL-4水平較正常對照組增高(P<0.05),地塞米松組與正常對照組比較,差異無統計學意義(P>0.05)。 結論哮喘小鼠CD4+、CD25+Treg數量的減少,功能的下降,可能參與了哮喘的發病過程,地塞米松可能通過上調CD4+、CD25+Treg比例,調節T細胞亞群失衡來發揮抗炎作用。
【關鍵詞】哮喘; CD4+、CD25+、調節性 T 細胞; IL-4; TGF-β; 小鼠
支氣管哮喘是一種以慢性氣道炎性為特點的變態反應性疾病,其發病過程由多種炎性細胞參與。目前研究認為,Th2細胞表達過度所致的Th1/Th2細胞失衡是哮喘發病的免疫學基礎[1],機體的免疫功能紊亂導致炎性損傷,這類炎性損傷反復進行、發生,在哮喘的發病機制中發揮重要作用。近年來,隨著關于哮喘發病機制的深入研究,研究者們發現,哮喘的臨床表現和治療反應并不能完全用Th1/Th2 平衡理論來解釋。調節性T 細胞( regulatory T cell,Treg細胞) 是CD4+T細胞的一組亞型,主要對免疫功能起負調節作用,從而加強免疫耐受,以維持內環境的穩定。CD4+、CD25+Treg是CD4+調節性T細胞的一種類型,構成了大多數的Treg細胞群。研究顯示,CD4+、CD25+Treg可能參與了哮喘的發病過程,關于其如何參與、介導哮喘的發生,是目前研究的熱點。有研究認為,分泌抑制性細胞因子TGF-β、抑制Th2 細胞活化、抑制Th2類細胞因子的產生可能是CD4+、CD25+Treg抑制哮喘發生的主要方式[2]。本研究以哮喘小鼠為對象,分析哮喘小鼠體內CD4+、CD25+Treg、Th2類細胞因子IL-4、TGF-β的表達情況及地塞米松干預對其的影響。
1材料與方法
1.1實驗動物健康雄性BALB/c小鼠(體重20g左右,8周齡,清潔級2級,四川大學華西臨床醫學院動物實驗中心提供)30只,隨機分成正常對照組、哮喘組及地塞米松組3組,每組分別10只。
1.2儀器與試劑主要實驗儀器:低溫高速離心機(德國Heraeus公司);超聲霧化器(德國Boehringger Ingelhei);蛋白濃度分析儀(美國BIO-RAD公司);CYTOMICS- FC500流式細胞儀(美國 BACK MAN COULTER 公司)。主要實驗試劑:雞卵蛋白(美國 Sigma 公司); 氫氧化鋁(天津三廠); 小鼠淋巴細胞分離液(天津TDB生物技術發展中心);Anti-Mouse CD4 PE-Cy5、Anti-Mouse CD25 PE及相應同型對照(美國eBioscience公司);山羊抗兔IgG(購于北京中杉金橋生物公司);兔抗大鼠IgG(武漢博士德生物工程有限公司)。
1.3動物模型制備 參照J.C. Kips[4]和Matthew E等[5]提出的方法并適當調整來制備哮喘模型。正常對照組:分別在第1、8、14天腹腔注射生理鹽水0.5ml,第15天開始將小鼠置于密閉空間內,霧化吸入生理鹽水,1天1次,1次30分鐘,連續7天;哮喘組:分別在第1、8、14天腹腔注射預先制備的抗原液0.5 ml(含20μg 卵白蛋白、2.25 mg 氫氧化鋁)以致敏,第15天開始將小鼠置于密閉空間內,予1%卵白蛋白(OVA)霧化吸入激發,連續7天。地塞米松組:同樣使用腹腔注射抗原液使小鼠致敏,但在霧化吸入卵白蛋白前30分鐘腹腔注射地塞米松(2.5mg/kg)。
1.4分離脾單個核細胞在最后一次激發結束后,通過引頸的方式處死小鼠,取出脾臟,將其剪成多個小塊,放在細胞篩上進行研磨、過濾,制備脾單個核細胞懸液,并調節細胞濃度為106個細胞/ml,最后使用流式細胞儀檢測各組CD4+、CD25+Treg占CD4+T細胞的百分率。
1.5肺病理切片的制備取出小鼠的左肺,使用10%中性甲醛固定24小時后,再進行常規脫水、透明、浸蠟、包埋、切片,在HE染色后使用顯微鏡觀察各組小鼠肺組織形態、結構。
1.6Western Blot分析肺組織IL-4的表達采用Western Blot方法分析IL-4在小鼠肺組織中的表達及分布情況,蛋白條帶的灰度使用Quantity One軟件測定。
1.7血清TGF-β水平測定采用ELISA雙抗體夾心法測定TGF-β,按照試劑盒操作說明書進行檢測。

2結果
2.1各組小鼠肺組織病理檢測結果正常對照組:小鼠肺組織支氣管粘膜上皮、肌層完好,周圍無炎性細胞浸潤,支氣管管腔規則,形態基本正常(圖1);哮喘組:在小鼠肺組織血管及氣管周圍,有大量淋巴細胞、嗜酸性細胞等炎性細胞浸潤,粘膜上皮存在不同程度的壞死、脫落(圖2)。
圖1正常對照組肺組織病理切片 HE× 400
Figure 1Pathological section of lung tissue in Normal control group,HE× 400

圖2哮喘組肺組織病理切片 HE×400
Figure 2Pathological section of lung tissue in asthma group HE× 400
2.2各組小鼠脾單個核細胞CD4+、CD25+Treg百分率比較哮喘組小鼠脾單個核細CD4+、CD25+Treg百分率較正常對照組、地塞米松組降低(均P<0.05);地塞米松組CD4+、CD25+Treg百分率較哮喘組升高(均P<0.05);地塞米松組CD4+、CD25+Treg百分率低于正常對照組,但組間差異無統計學意義(P>0.05,表1)。
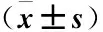
Table 1The percentage of CD4+and CD25+Treg in spleen mononuclear cells of mice

組別nCD4+、CD25+/CD4+(×10-2)正常對照組105.16±0.38①哮喘組102.06±0.52地塞米松組104.98±0.67①②
注:與哮喘組比較 ①P<0.05;與正常對照組比較, ②P>0.05
2.3Western Blot分析各組小鼠肺組織IL-4表達情況哮喘組小鼠IL-4表達強于正常對照組及地塞米松組(P<0.05),正常對照組與地塞米松組之間差異無統計學意義(P>0.05,表2,圖3)。
表2 各組小鼠肺組織IL-4表達情況比較±s)
注:與哮喘組比較,①P<0.05
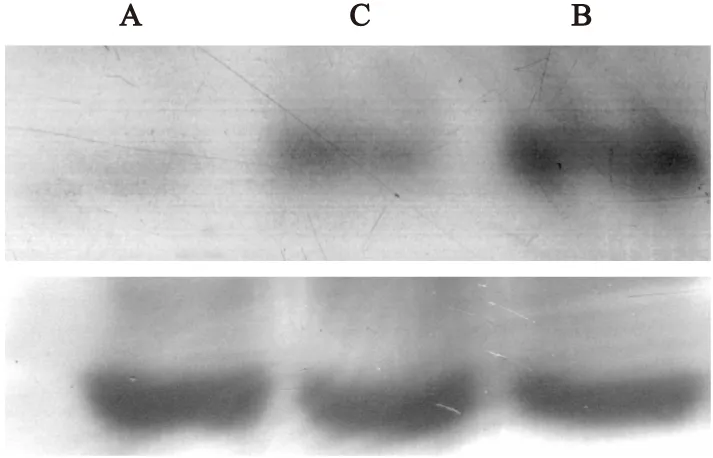
圖3IL-4及β-actin的蛋白表達情況
Figure 3Expression of IL-4 and β-actin protein
注:A.正常對照組;B.哮喘組;C.地塞米松組
2.4血清TGF-β水平情況哮喘組TGF-β水平較正常對照組、地塞米松組減少(均P<0.05);地塞米松組TGF-β水平較正常對照組稍低,但組間差異無統計學意義(P>0.05)。
2.5相關性分析CD4+、CD25+/CD4+與血清TGF-β水平呈明顯正相關(r為0.526,P<0.05);CD4+、CD25+/CD4+與IL-4水平呈負相關(r為-0.258,P<0.05);IL-4水平與TGF-β呈負相關(r為-0.316,P<0.05)。
3討論
CD4+輔助性 T細胞(CD4 helper cells,Th)在機體適應性免疫應答中發揮著至關重要的作用,它是機體T細胞的重要功能群體。Th細胞分為Th1和Th2細胞兩大類。Th1 細胞主要介導細胞免疫,分泌INF-γ、TNF-β和IL-2等細胞因子。Th2細胞可以分泌IL-4、IL-5、IL-13等細胞因子,誘導嗜酸性粒細胞募集和激活,并促進黏液的大量分泌、氣道高反應( airway hyperreactivity,AHR),從而促使炎癥發生發展。研究表明,Th1 細胞和 Th2 細胞都是重要的效應細胞,同時二者又相互抑制[5]。在關于哮喘的發病機制研究中,多年來的研究認為,在哮喘的發病過程中,Th1/Th2 功能失調扮演著重要角色。研究顯示,在哮喘患者體內存在Th細胞亞群之間的失衡狀態,表現為在哮喘急性發作期患者,其外周血中Th1 細胞數量顯著降低,而同時Th2細胞數量顯著增高,Th1/ Th2 比值明顯下降。Th2細胞在哮喘發生中發揮重要作用,與其產生的細胞因子IL-4是密不可分的[6]。IL-4主要由Th2細胞產生,能刺激和活化B細胞,因此又稱為B細胞刺激因子。IL-4 是具有多種功能的、強大的炎性介質,它在機體免疫反應中起著非常重要的作用。臨床研究顯示,IL-4對哮喘具有正向調節作用,可導致呼吸道炎癥的發生,在兒童哮喘的發生中發揮重要作用。在本研究中,哮喘組小鼠肺組織中IL-4表達水平較正常對照組顯著增加,該結果與國內外大多數研究結果相一致,支持在哮喘的發生過程中存在著Th2類細胞的增多、IL-4細胞因子的過度表達,從而促進炎癥的發生。在糖皮質激素與IL-4的相關性研究中,研究發現糖皮質激素能降低外周T的活化及IL-4的表達[7];也有人認為糖皮質激素對IL-4的表達沒有影響,甚至出現IL-4表達的增加[8]。在本研究中,地塞米松干預后的小鼠IL-4水平較哮喘組明顯降低,提示地塞米松可能抑制Th2類細胞及其細胞因子的產生,從而實現抗炎的作用。
盡管多數研究認為,Th2細胞的增多、比例占優勢與哮喘發生密切相關,但是也有研究顯示,Th1 型免疫反應同樣能誘導、加重哮喘,一些以Th2細胞反應為主的感染也并沒有加重過敏性炎癥,甚至呈現相反的作用。因此,研究者們推測,Th1/Th2 細胞失衡可能只是哮喘的表面現象,在其發生、發展的過程中可能還有其他機制參與進來。有研究發現,其它的CD4+T細胞(包括 Th1 細胞、Th17 細胞和調節性T細胞等)及其細胞因子,在哮喘發病中也發揮了重要作用。
Treg是一類以免疫無能性、免疫抑制性為主要特征[9]的T細胞亞群。Treg細胞對高水平的IL-2 單獨刺激無反應,也不分泌IL-2,對抗CD3單抗、抗CD3 單抗和抗CD28 單抗的聯合作用也呈現無應答的狀態,表現為免疫無能性。同時CD4+、CD25+Treg一旦被激活以后,它可以抑制CD4+、CD25+T、CD8+T、Th1、Th2等細胞的增殖與活化,這種現象被定義為免疫抑制性。Treg細胞的免疫抑制活性是非特異性的,可通過多種方式實現:通過細胞之間直接接觸產生抑制;通過分泌IL-10、TGF-β對局部免疫反應產生抑制。目前研究認為,Treg細胞能發揮其免疫抑制功能,與細胞因子IL-2、IL-10、TGF-β的產生密不可分;一方面,Treg細胞會分泌IL-10、TGF-β細胞因子,這些細胞因子是抑制性細胞因子,能幫助Treg細胞發揮其抑制功能;另一方面,Treg細胞的擴增、免疫抑制功能發揮,與TGF-β信號密切相關。有研究顯示,如果用抗IL-10、抗TGF-β單抗去封閉IL-10、TGF-β,那么CD4+、CD25+Treg細胞的抑制功能將會明顯降低[10]。
一些動物實驗及臨床研究顯示,在一些嚴重的超敏反應、自身免疫疾病,如哮喘、過敏反應等[11],CD4+、CD25+Treg細胞數量的變化、功能的異常常常會參與其中,并且可能是導致疾病發生的重要原因。有研究表明[12],哮喘患者的支氣管肺泡灌洗液、外周血單核細胞中,CD4+、CD25+Treg的比率明顯低于對照組,從而認為,哮喘患者Treg受損。然而也有研究表示,哮喘等過敏性疾病患者體內CD4+、CD25+Treg的數量正常,甚至顯著增加,但是這些Treg不能發揮其免疫抑制功能,存在功能缺陷。近年來的研究也發現,Treg可能會抑制Th2 反應,實現維持氣道內的免疫耐受[13]。Taylor等[14]推測 Treg 細胞可能通過分泌IL-10及TGF-β,抑制 Th2 細胞產生IL- 4、IL-5和IL-13,抑制嗜酸性粒細胞、嗜堿性粒細胞以及肥大細胞的致炎作用,從而實現其免疫抑制性,抑制變態反應性疾病的發生、發展。隨著對哮喘發病機制的深入研究,Treg 細胞和Th2細胞二者的關系成為了研究者們關注的熱點。近年來有研究者發現,在哮喘發病過程中,可能存在著Treg/Th2比例失衡的機制[15,16]。一方面,在炎癥反應中,Treg 細胞可以轉化為Th2促炎癥細胞;另一方面,在過敏性炎癥中,大量活化增殖的Th2 細胞,競爭性地與IL-2結合,使得Treg 細胞不能與IL-2有效結合,從而誘導Treg 細胞的凋亡[17]。 在本研究中,哮喘組小鼠CD4+、CD25+Treg占CD4+百分率及TGF-β明顯降低,提示哮喘組小鼠體內CD4+、CD25+Treg數量及其分泌的細胞因子減少,同時TGF-β的減少可能會減弱CD4+、CD25+Treg對Th2細胞抑制作用的減弱,致Th2類細胞因子IL-4表達的明顯增加,導致Treg/Th2 比例失衡,從而促進炎癥的發生,導致哮喘的發作。而地塞米松干預后,CD4+、CD25+Treg百分率及TGF-β增加、IL-4表達降低,促進Treg/Th2平衡,減輕炎癥,提示地塞米松可能通過上調調節性T細胞、促進Treg/Th2平衡以實現其強大的抗炎作用。
4結論
哮喘小鼠CD4+、CD25+Treg數量及相關細胞因子TGF-β水平明顯降低,TH2類細胞因子IL-4水平明顯升高,提示CD4+、CD25+Treg及Treg/Th2可能參與了哮喘的發生、發展過程;地塞米松可能通過調節哮喘患者體內CD4+、CD25+Treg數量及調節Treg/Th2平衡發揮抗炎作用。但是CD4+、CD25+Treg介導哮喘發生的具體機制還需要進一步研究。隨著對哮喘發病機制的深入研究,相信會有更多的細胞群和細胞因子被揭示,這將為哮喘的預防及治療提供新的方向。
【參考文獻】
[1]Larché M,Robinson DS,Kay AB. The role of T lymphocytes in the pathogenesis of asthm[J].Allergy Clin Immunol,2003,111( 3) : 450-464.
[2]Lloyd CM,Hawrylowicz CM. Regulatory T cells in asthma[J] . Immunity,2009,31( 3) : 438-449.
[3]Kips JC, Tournoy KG, Pauwels RA. New anti-asthma therapies: suppression of the effect of interleukin(IL)-4 and IL-5[J]. Eur Respir J, 2001, 17: 499-506.
[4]Matthew EP, Charles GI, Yvonne MW. Janssen-Heininger Rapid Activation of Nuclear Factor-κB in Airway Epithelium in a Murine Model of Allergic Airway Inflammation[J]. American Journal of Pathology, 2002, 160: 1325-1334.
[5]Van Oosterhout AJM, Motta AC. Th1/ Th2 paradigm:not seeing the forest for the trees[J]. Eur Respir J, 2005, 25 :591-593.
[6]Sang-Heon Cho, Luminita AS, Stephen TH,etal. Increased Interleukin-4, Interleukin-5, and Interferon- γ in Airway CD4+and CD8+T Cells in Atopic Asthma[J]. American Journal of Respiratory and Critical Care Medicine,2005,171: 224-230.
[7]Wu Z, Macphee IA, Oliveira DB. Reactive oxygen species in the initiation of IL-4 driven autoimmunity as a potential therapeutic target[J]. Curr Pharm Des, 2004, 10(8) :899-913.
[8]A Sahid El-Radhi, Claire L Hogg,etal. Effect of oral glucocorticoid treatment on serum inflammatory markers in acute asthma[J]. Arch Dis Child, 2000, 83:158-162.
[9]McGuik P,Higgins SC,Mills KH. The role of regulatory T cells in respiratory infections and allergy and asthma[J].Curr Allergy Asthma Rep,2010,10( 1):21-28.
[10] Langier S,Sade K,Kivity S. Regulatory T cells in allergic asthma [ J] . Isr Med Assoc J,2012, 14( 3) :180-183.
[11] Lin W, Truong N, Grossma WJ,etal. Allergic dysregulation and hyperimmunoglobulinemia E in Foxp3 mutant mice[J]. J Allergy Clin Immunol, 2005,116(5):1106-1115.
[12] Y Zu, CR Li, YJ Zheng,etal. The role of CD4+CD25+regulatory T cells in the pathogenesis of asthma in children. Zhonghua Yi Xue Za Zhi, 2006, 86(1):35-38.
[13] Choi IS. Immune tolerance by induced regulatory T cells in asthma [J] . Allergy Asthma Immunol Res,2012,4(3):113-115.
[14] Taylor PA,Noelle RJ,Blazar BR. CD4+CD25+immune regulatory Tcells are required for induction of tolerance to alloantigen via costimulatory blockade[J] . J Exp Med,2001,193( 11) : 1311-1318.
[15] Chapoval S,Dasgupta P,Dorsey NJ,etal. Regulation of the T helper cell type 2( Th2) /T regulatory cell( Treg) balance by IL-4 and STAT6[J].J Leukoc Biol,2010,87( 6) : 1011-1018.
[16] Hadeiba H, Locksley RM. Lung CD4+CD25+regulatory T cells suppress type 2 immune responses but not bronchial hyperreactivity[J] . J Immunol, 2003, 170(6):5502-5510.
[17] Pandiyan P,Zheng L,Ishihara S,etal. CD4+CD25+Foxp3+regulatory T cells induce cytokine deprivation mediated apoptosis of effector CD4+T cells[J] . Nat Immunol,2007,8( 12) : 1353-1362.
Effect of dexamethasone on CD4+CD25+regulatory T cells and the expression of IL-4 and TGF-βin asthmatic mice
MA Xiang1,LIU Hong1,LI Qun ying1,et al
(1.DepartmentofRespiratory,TheFirstPeople′sHospitalofChengdu,Chengdu610041,China; 2.DepartmentofRespiratorydiseases,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
【Abstract】ObjectiveTo discuss the effect of dexamethasone on CD4+CD25+ regulatory T cells(Treg) and the expression of IL-4 and TGF-βin asthmatic mice. MethodsThirty male BALB/c mice were randomly assigned to the control group,the asthma group and the dexamethasone group.Tissues of left lung were obtained from mice to observe pathological changes.Flow cytometry was used to detect the percentage of CD4+CD25+Treg in CD4+T cells.The expression of IL-4 from lungs were detected by Western Blot. The levels of serum TGF-β were detected by ELISA. ResultsThe percentage of CD4+CD25+Treg and TGF-β in asthma group decreased significantly(P<0.05) .The expression of IL-4 in asthma group increased significantly(P<0.05). Difference was not significant be-tween the control group and the dexamethasone group(P>0.05) . ConclusionThe number of CD4+CD25+Treg in asthmatic mice reduced and the function also declined. They are involved in the pathogenesis of asthma. Dexamethasone may had anti-inflammatory effect through the up regulation of CD4+CD25+Treg and regulatory T cell subsets imbalance.
【Key words】Asthma; CD4+CD25+regulatory T cells; IL-4; TGF-β; Mice
基金項目:國家自然科學基金(30871119)
【中圖分類號】R-33
【文獻標志碼】A
doi:10.3969/j.issn.1672-3511.2016.07.
(收稿日期:2015-12-02; 編輯: 母存培)

