人鼻咽癌多藥耐藥細胞株CNE2/ADM的建立及生物學特性研究*
戢太陽,劉 嬌,王燕秋,張仲林△
1.成都醫(yī)學院 基礎醫(yī)學院(成都 610500);2.成都醫(yī)學院 藥學院(成都 610083)
人鼻咽癌多藥耐藥細胞株CNE2/ADM的建立及生物學特性研究*
戢太陽1,劉嬌2,王燕秋2,張仲林2△
1.成都醫(yī)學院 基礎醫(yī)學院(成都610500);2.成都醫(yī)學院 藥學院(成都610083)
【摘要】目的建立人鼻咽癌多藥耐藥細胞株CNE2/ADM,并研究其生物學特性。方法以人鼻咽癌細胞株CNE2為親本細胞,采用阿霉素(ADM)濃度梯度遞增法誘導建立多藥耐藥細胞株CNE2/ADM。通過觀察細胞形態(tài)學變化,藥物敏感性試驗,測定生長曲線、群體倍增時間、細胞周期及P-糖蛋白(P-gp)功能和表達情況,評價CNE2/ADM的生物學特性。結果與CNE2細胞相比,CNE2/ADM耐藥細胞異形明顯,并對ADM在內(nèi)的4種化療藥物產(chǎn)生了耐藥性,增殖速度減慢,群體倍增時間延長(P<0.05),G0/G1期細胞增多,S期、G2/M期細胞減少(P<0.05),P-gp的藥物泵出功能增強、表達水平升高。結論成功建立了人鼻咽癌多藥耐藥細胞株CNE2/ADM,其具有典型的多藥耐藥表型,可作為進一步研究鼻咽癌多藥耐藥機制及篩選逆轉劑較為理想的細胞模型。
【關鍵詞】鼻咽腫瘤;多藥耐藥;阿霉素;細胞株
鼻咽癌是我國華南地區(qū)發(fā)病率較高的頭頸部惡性腫瘤,目前臨床上對其治療多采用放療加化療的綜合治療模式,化療在鼻咽癌病人尤其晚期病例中占有重要地位。然而,鼻咽癌細胞多藥耐藥性(multidrug resistance,MDR)的產(chǎn)生常導致臨床化療失敗[1-4],MDR已成為當前腫瘤治療中急需攻克的難題。體外建立穩(wěn)定的多藥耐藥細胞株對于揭示MDR機理及篩選MDR逆轉劑具有重要的理論和實踐意義[5-6]。本研究參考國內(nèi)外文獻,結合腫瘤多藥耐藥細胞模型培養(yǎng)及鑒定的標準設計實驗,采用藥物濃度梯度遞增法建立人鼻咽癌多藥耐藥細胞株CNE2/ADM,并對其相關生物學特性進行評價,現(xiàn)報道如下。
1材料與方法
1.1材料
人鼻咽癌低分化鱗癌細胞株CNE2購自中國科學院上海細胞庫。阿霉素購自大連美侖生物技術有限公司,順鉑購自江蘇豪森藥業(yè)股份有限公司,5-氟尿嘧啶購自天津金耀藥業(yè)有限公司,長春新堿購自廣東嶺南制藥有限公司。RPMI1640培養(yǎng)基、胰蛋白酶、青鏈霉素雙抗溶液購自HyClone公司。胎牛血清購自Gibco公司。四甲基偶氮唑鹽(MTT)購自Amresco公司。BCA蛋白定量試劑盒、細胞周期檢測試劑盒購自碧云天公司。羅丹明123(Rhodmine123,Rho123)染色試劑盒、ECL化學發(fā)光試劑購自凱基公司。兔抗人P-gp多克隆抗體、小鼠抗人β-actin單克隆抗體購自SANTA CRUZ公司,辣根過氧化物酶(HRP)標記的羊抗兔或鼠二抗購自CST 公司。
1.2方法
1.2.1細胞培養(yǎng)及耐藥細胞株CNE2/ADM的建立CNE2細胞在含10%胎牛血清及青、鏈霉素各100 U/mL的RPMI1640培養(yǎng)基中于37 ℃、5%CO2飽和濕度的培養(yǎng)箱中培養(yǎng)。采用藥物濃度梯度遞增法誘導建立CNE2/ADM細胞,取對數(shù)生長期CNE2細胞,以 2 nmol/mL的阿霉素濃度為首次加藥濃度,作用細胞24 h后,更換無藥的新鮮培養(yǎng)基培養(yǎng),待細胞穩(wěn)定生長并傳代后,提高阿霉素的濃度繼續(xù)誘導。如此反復換液、傳代,逐步提高阿霉素濃度間歇誘導,歷時約6個月,最終獲得對阿霉素的耐藥倍數(shù)超過親本細胞10倍以上的耐藥細胞株,命名為CNE2/ADM。倒置顯微鏡下觀察耐藥細胞和親本細胞的形態(tài)學差異并拍照。
1.2.2MTT法檢測藥物敏感性取對數(shù)生長期的CNE2及CNE2/ADM細胞,調(diào)整密度為5×104個/mL,以每孔100 μL接種于96孔板,培養(yǎng)過夜。待細胞貼壁后,加入不同濃度的化療藥物,每個濃度設3個復孔,另設不加藥物的對照孔。培養(yǎng)48 h后,每孔加入MTT(5 mg/mL) 20 μL,繼續(xù)孵育4 h后,棄去培養(yǎng)液,每孔加入DMSO 150 μL,低速振蕩10 min溶解結晶,用酶標儀檢測492 nm波長處各孔吸光度D(λ)值。按公式計算細胞生長抑制率、IC50和耐藥指數(shù)。抑制率=[1-加藥孔D(λ)值/對照孔D(λ)值]×100%;取各濃度平均抑制率與相應的對數(shù)濃度進行線性回歸,獲得對數(shù)濃度對細胞抑制率的標準曲線,求出半數(shù)抑制濃度(IC50);耐藥指數(shù)(RI)= IC50(耐藥細胞)/ IC50(親本細胞)。
1.2.3細胞生長曲線和倍增時間測定分別取500 μL密度為2×104個/mL的CNE2及CNE2/ADM細胞懸液接種于24孔板常規(guī)培養(yǎng)。每隔24 h取3孔細胞用胰酶消化后收集,進行細胞計數(shù),連續(xù)計數(shù)7 d。以時間為橫軸,細胞數(shù)目為縱軸繪制細胞生長曲線。按照Patterson公式計算細胞在對數(shù)生長期的群體倍增時間td,td=t×lg2/(lgNt-lgN0),t代表培養(yǎng)時間,N0及Nt分別代表起始接種時和培養(yǎng)到t時的細胞數(shù)。
1.2.4流式細胞術檢測細胞周期分別取1 mL 密度為106個/mL的CNE2及CNE2/ADM細胞懸液,420×g,離心5 min后棄上清,70%冰乙醇固定,4 ℃放置過夜,離心去上清,PBS清洗兩次,加入碘化丙啶(PI)染液,37 ℃避光溫浴30 min后,用流式細胞儀在激發(fā)波長488 nm處檢測,并用CFlow Sampler Analysis 軟件進行細胞DNA含量分析。
1.2.5Rho 123外排實驗檢測P-gp的轉運功能分別取1 mL 密度為106個/mL的CNE2及CNE2/ADM細胞懸液,420×g,離心5 min后棄上清,重懸于1mL Rho123濃度為1 μg/mL的培養(yǎng)基中,37 ℃,5%CO2飽和濕度溫箱中孵育30 min,420×g, 離心5 min后棄上清,冷PBS清洗兩次,重懸于培養(yǎng)基中,再次孵育10 min,420×g,離心5 min后重懸于0.5 mL冷PBS液中,流式細胞儀(激發(fā)波長488 nm,發(fā)射波長530 nm)檢測細胞內(nèi)Rho123的熒光強度。
1.2.6Western blot 檢測P-gp的表達分別收集CNE2和CNE2/ADM細胞,加入RIPA裂解液于冰上裂解30 min,于4 ℃,13 800×g,離心15 min,收集上清液,BCA法測定蛋白濃度。取50 μg/泳道進行SDS-PAGE電泳,PVDF膜200 mA濕轉2 h,5%脫脂牛奶室溫封閉1 h,加入兔抗人P-gp多克隆抗體,4 ℃孵育過夜,TBST洗膜3次,加入HRP標記的羊抗兔二抗,室溫搖床孵育1 h,洗膜后采用ECL曝光顯影,同時選β-actin作為內(nèi)參。結果采用Quantity-One進行分析。
1.3統(tǒng)計學方法
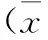
2結果
2.1CNE2/ADM的建立及多藥耐藥特征
本實驗采用藥物濃度梯度遞增法,歷時6個月誘導,建立起CNE2/ADM耐藥細胞株。MTT檢測結果顯示,CNE2/ADM對阿霉素具有顯著耐藥性,耐藥指數(shù)為12.98,其對順鉑,長春新堿和5-氟尿嘧啶亦產(chǎn)生了不同程度的交叉耐藥性(表1)。
2.2細胞形態(tài)及生長曲線、群體倍增時間
光鏡下兩種細胞均貼壁生長,CNE2細胞形態(tài)飽滿,分布均勻,長滿時呈鋪路石樣緊密排列;而CNE2/ADM細胞形態(tài)不一,邊界模糊,核不規(guī)則,胞質(zhì)中顆粒狀物質(zhì)增多,貼壁能力較CNE2減弱,傳代時胰酶消化所用時間減少(圖1)。CNE2/ADM較CNE2細胞生長速度減慢,二者群體倍增時間分別為(28.91±1.12) h和(21.47±2.92) h,CNE2/ADM 細胞的群體倍增時間延長,差異有統(tǒng)計學意義(P=0.015,P<0.05) (圖2)。

表1 CNE2和CNE2/ADM對不同藥物的IC50
注:與CNE2相比,aP=0.002,bP=0.005,cP=0.003,dP=0.006

圖1CNE2和CNE2/ADM在光鏡下的細胞形態(tài)(×200)
注:A: CNE2; B: CNE2/ADM

圖2CNE2和CNE2/ADM的生長曲線
2.3細胞周期分析
細胞周期分析結果顯示,耐藥細胞較親代細胞的細胞周期發(fā)生改變,表現(xiàn)為CNE2/ADM細胞的G0/G1期分布增多,S期、G2/M期分布減少,差異有統(tǒng)計學意義(P<0.05)(圖3、表2)。

表2 CNE2和CNE2/ADM的細胞周期分布
注:與CNE2相比,aP=0.001,bP=0.007,cP=0.004
2.4P-gp轉運功能檢測結果
Rho123外排實驗結果顯示,CNE2/ADM和CNE2細胞內(nèi)Rho123熒光強度分別為(10.68±2.42)×105和(52.34±2.69)×105,CNE2/ADM細胞外排Rho123增多,差異有統(tǒng)計學意義(P=0.002,P<0.01),表明CNE2/ADM細胞P-gp的轉運功能增強。
2.5P-gp蛋白表達水平檢測結果
Western blot結果顯示,在CNE2/ADM和 CNE2細胞中均可見P-gp表達,但CNE2/ADM細胞中P-gp的表達水平明顯高于親本細胞(圖4)。

圖3CNE2和CNE2/ADM的細胞周期分布
注:A: CNE2; B: CNE2/ADM

圖4CNE2和CNE2/ADM中P-gp表達情況
3討論
MDR 是指腫瘤細胞一旦對一種化療藥物產(chǎn)生耐藥性,對其他多種結構和作用機制不同的化療藥物也產(chǎn)生交叉耐藥,致使藥物療效逐漸下降的現(xiàn)象[7],其本質(zhì)上是腫瘤細胞在生存壓力下逐步建立起的一種適應過程[8-9]。體外建立穩(wěn)定的多藥耐藥細胞株是研究MDR產(chǎn)生和逆轉的基礎和前提。藥物濃度梯度遞增法是目前構建腫瘤多藥耐藥細胞株較為常用的的方法,雖然其操作費時、繁瑣,但容易把握、成功率較高,且所構建的細胞模型耐藥性穩(wěn)定,在撤藥后仍能保持較高的耐藥性[10]。多藥耐藥細胞模型構建后的評價方法一般包括:耐藥指數(shù)的檢測、細胞生物指標的檢測及耐藥標志物的檢測[11]。因此,本研究采用阿霉素濃度梯度遞增法誘導建立人鼻咽癌多藥耐藥細胞株CNE2/ADM,并從上述3個方面對其生物學特性進行評價。
藥物敏感性檢測結果顯示,CNE2/ADM不僅對阿霉素產(chǎn)生了耐藥,而且對順鉑,長春新堿和5-氟尿嘧啶這3種結構和作用機制不同的鼻咽癌化療藥物也產(chǎn)生了不同程度的交叉耐藥性,耐藥指數(shù)分別為12.98、4.84、5.54和2.03。Snow等[12]的分度標準認為,耐藥指數(shù)<5屬低度耐藥,5~15之間屬中度耐藥,>15屬高度耐藥。依此標準劃分,CNE2/ADM 細胞對阿霉素和長春新堿均為中度耐藥,而對順鉑和5-氟尿嘧啶則均為低度耐藥。CNE2/ADM在不含阿霉素的培養(yǎng)基中反復傳代2個月后,其對阿霉素的耐藥指數(shù)為11.23,仍基本保持原有的耐藥性。以上表明,CNE2/ADM細胞株耐藥性穩(wěn)定,并具有多藥耐藥的基本特征。另一方面,各項生物指標檢測結果顯示,CNE2/ADM細胞增殖速度減慢,群體倍增時間明顯延長。而目前的研究[13]認為,腫瘤細胞的倍增時間越長,對化療藥物的敏感性越差,這與本實驗的藥物敏感性檢測結果相一致。細胞周期分析表明,CNE2/ADM細胞被阻滯于G0/G1期,說明細胞在建模中經(jīng)阿霉素誘導獲得耐藥后處于慢周期甚至靜息狀態(tài),這可能是耐藥細胞增殖速度減慢的重要原因,此種現(xiàn)象在由阿霉素誘導的胰腺癌[14]和乳腺癌[15]多藥耐藥細胞株中也有發(fā)生,值得進一步深入研究。
P-gp過表達被認為是耐藥細胞最基本或經(jīng)典的標志,也是目前已公認的MDR生物學基礎[16]。P-gp作為一種由多藥耐藥基因mdr1編碼的能量依賴型藥物外排泵,將藥物由細胞內(nèi)泵出到細胞外,介導MDR的產(chǎn)生[17-18]。Rho123外排實驗則是檢測 P-gp 功能的經(jīng)典實驗方法,廣泛用于腫瘤細胞中P-gp 藥物泵出功能分析[19]。Rho-123作為一種親脂性陽離子熒光染料,無細胞毒性,是P-gp的良好底物,其在細胞內(nèi)累積量的減少代表細胞水平P-gp功能的增強[20-21]。本研究對耐藥標志物P-gp的檢測結果顯示,與CNE2細胞相比,CNE2/ADM細胞內(nèi)Rho-123的累積量顯著減少,提示P-gp轉運功能增強, 同時P-gp的表達明顯上調(diào),經(jīng)典的MDR途徑參與了CNE2/ADM耐藥的產(chǎn)生。
綜上,眾多生物學特性檢測結果證實,筆者成功建立了穩(wěn)定的人鼻咽癌多藥耐藥細胞株CNE2/ADM,其具有典型的多藥耐藥表型,可作為進一步研究MDR機制及篩選逆轉劑較為理想的細胞模型。
參考文獻
[1]Sui H,Fan ZZ,Li Q.Signal transduction pathways and transcriptional mechanisms of ABCB1/Pgp-mediated multiple drug resistance in human cancer cells [J].J Int Med Res,2012, 40(2) :426-435.
[2]Yoshizaki T,Ito M,Murono S,etal.Current understanding and management of nasopharyngeal carcinoma[J].Auris Nasus Larynx,2012,39(2):137-144.
[3]冼獻清,謝民強,江剛.鼻咽癌化療現(xiàn)狀及進展[J].臨床耳鼻喉頭頸外科雜志,2013,27(3):164-168.
[4]高健全.鼻咽癌放化綜合治療進展[J].海南醫(yī)學,2012,23(11):123-126.
[5]Zhou Y, Ling XL, Li SW,etal.Establishment of a human hepatoma multidrug resistant cell line in vitro[J].World J Gastroenterol,2010,16(18):2291-2297.
[6]Zhang X,Yashiro M,Qiu H,etal.Establishment and characterization of multidrug-resistant gastric cancer cell lines[J].Anticancer Res,2010,30(3):915-921.
[7]邢風娟,王巖,孟令杰.腫瘤多藥耐藥機制及其相關信號通路的研究進展[J].中國實驗診斷學,2013,17(2):379-382.
[8]Song Y, Zhou X, Bai W,etal.FBW7 increases drug sensitivity to cisplatin in human nasopharyngeal carcinoma by downregulating the expression of multidrug resistance-associated protein[J].Tumour Biol,2015,36(6):4197-4202.
[9]Yoshizaki T, Kondo S, Murono S,etal.Progress and controversy for the role of chemotherapy in nasopharyngeal carcinoma[J].Jpn J Clin Oncol,2015,45(3):244-247.
[10] 張峰,岑娟.腫瘤多藥耐藥模型的建立與評價方法[J].藥物評價研究,2013,36(5):377-381.
[11] 喬婷婷,彭芳.腫瘤多藥耐藥性體外模型的方法與評價[J].醫(yī)學綜述,2015,21(22):4093-4095.
[12] Snow K,Judd W.Characterisation of adriamycin and amsacrine-resistant human leukaemic T cell lines[J].Br J Cancer,1991,63(1):17-18.
[13] Maeno Y,Nakazawa S,Yamamoto N,etal.Osteopontin Participates in Th1-Mediated Host Resistance against Nonlethal Malaria Parasite Plasmodium chabaudi chabaudi Infection in Mice[J].Infection and Immunity,2006,74(4):2423-2427.
[14] 張立陽,趙玉沛,吳元德,等.胰腺癌阿霉素耐藥細胞株SW1990/ADM的建立及其耐藥機理研究[J].中國普外基礎與臨床雜志,2005,12(1):46-50.
[15] 李文靜.人乳腺癌耐藥細胞株的建立及其耐藥機制研究[D].南京:南京醫(yī)科大學,2012.
[16] Mizutani T, Masuda M, Nakai E,etal.Genuine functions of P-glycoprotein (ABCB1)[J].Curr Drug Metab,2008,9(2):167-174.
[17] Krech T,Scheuerer E,Geffers R,etal.ABCB1/MDR1 contributes to the anticancer drug resistant phenotype of IPH-926 human lobular breast cancer cells[J].Cancer Lett,2012,315(2):153-160.
[18] Wang L,Meng Q,Wang C,etal.Dioscin restores the activity of the anticancer agent adriamycin in multidrug-resistant human leukemia K562/adriamycin cells by down-regulating MDR1 via a mechanism involving NF-κB signaling inhibition[J].J Nat Prod,2013,76(5):909-914.
[19] Kelly RJ,Draper D,Chen CC,etal.A pharmacodynamic study of docetaxel in combination with the P-glycoprotein antagonist tariquidar (XR9576) in patients with lung,ovarian,and cervical cancer [J].Clin Cancer Res,2011,17(3): 569-580.
[20] Loetchutinat C,Saengkhae C,Marbeuf-Gueye C,etal.New insights into the P-glycoprotein-mediated effluxes of rhodamines [J].Eur J Biochem,2003,270(3): 476-485.
[21] Tomono T, Otsuka K, Yano K,etal.Recommended Daily Dose of Sesame Lignans Has No Influence on Oral Absorption of P-Glycoprotein Substrates in Rats[J].Biol PharmBull,2015,38(12):1960-1963.
Establishment and Biological Characterization of Human Nasopharyngeal Carcinoma Multidrug-resistant Cell Line CNE2/ADM
JiTaiyang1,LiuJiao2,WangYanqiu2,ZhangZhonglin2△.
1.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610500,China; 2.SchoolofPharmacy,ChengduMedicalCollege,Chengdu610083,China
【Abstract】ObjectiveTo establish a human nasopharyngeal carcinoma (NPC) multidrug-resistance cell line CNE2/ADM and to investigate its biological features. MethodsAdriamycin resistance was induced in human NPC cell line CNE2 by continuous exposure to gradually increasing doses of adriamycin. Drug sensitivity, cell morphology, cell growth curves and the population doubling time, cell cycle distribution, the function and expression level of P-gp were investigated to determine the biological features of CNE2/ADM cell line. Results Compared with CNE2, the CNE2/ADM cell line was with significant heteromorphosis. It showed cross-resistance to four drugs such as adriamycin, the population doubling time was longer(P<0.05) and the cell number of the G0/G1 -phase was increased.Meanwhile, that of the S- phase and G2/M-phase decreased (P<0.05), the function of P-gp was enhanced(P<0.05) and the expression level of P-gp was up-regulated. ConclusionThe MDR cell line CNE2/ADM is established successfully. CNE2/ADM cell line shows the typical multidrug resistance phenotype. It is a good model for exploring the mechanism of MDR and the selection of reversal agents.
【Key words】Nasopharyngeal neoplasm; Multidrug resistance; Adriamycin; Cell line
doi:10.3969/j.issn.1674-2257.2016.02.004
*基金項目:四川省科技廳項目(No:2014JY0019)
通信作者:△張仲林,E-mail:zhlzhang2007@163.com
【中圖分類號】R739.63
【文獻標志碼】A
網(wǎng)絡出版地址:http://www.cnki.net/kcms/detail/51.1705.R.20160406.1554.024.html
·論著·

