三種大鼠急性肺損傷模型的比較*
王 婷,梁華平,柴鑒深,蔡康興,侯鳳艷,范 霞,李 羿△
1.成都醫學院 藥學院 (成都 610083);2. 第三軍醫大學大坪醫院 野戰外科研究所一室,創傷、燒傷與復合傷國家重點實驗室(重慶 400016)
三種大鼠急性肺損傷模型的比較*
王婷1,梁華平2,柴鑒深2,蔡康興2,侯鳳艷2,范霞2,李羿1△
1.成都醫學院 藥學院 (成都610083);2. 第三軍醫大學大坪醫院 野戰外科研究所一室,創傷、燒傷與復合傷國家重點實驗室(重慶400016)
【摘要】目的比較腹腔注射脂多糖(lipopolysaccharide, LPS)、氣管滴注LPS和盲腸結扎穿刺(cecal ligation and puncture,CLP)誘導的3種急性肺損傷模型的差異。方法70只成年SD大鼠隨機分為7組:正常組、腹腔注射LPS組(10 mg/kg,LPS-IP組)及其假手術組(SHAM-1);氣管滴注LPS組(5 mg/kg, LPS-IT組)及其假手術組(SHAM-2);盲腸結扎穿刺組(CLP)及其假手術組(SHAM-3)。于造模后24 h,收集各組大鼠的動脈血用于血氣分析,并通過二喹啉甲酸(bicinchoninic acid,BCA)蛋白測定法、血細胞計數板以及瑞氏-姬姆薩染色分別對肺泡灌洗液中的蛋白含量、細胞總數和類別進行統計,同時利用濕干比和蘇木精-伊紅 (HE)染色法來評價肺組織的損傷程度。結果LPS-IT組和LPS-IP組的肺灌洗液總蛋白濃度、總細胞數均高于正常組和假手術組(P<0.05),濕干比明顯增高(P<0.05),PaO2低于正常組及相應的假手術組(P<0.05);LPS-IT組和LPS-IP組肺組織有明顯病理變化,包括肺水腫和肺泡壁增厚,炎性細胞浸潤。CLP組未見明顯改變。結論在急性肺損傷的3種大鼠模型中,LPS-IT組和LPS-IP組肺損傷較為嚴重,CLP組未見明顯肺損傷。提示腹腔注射LPS及氣管給予LPS更適用于建立急性肺損傷模型以及后續應用藥物的動物實驗。
【關鍵詞】急性肺損傷;盲腸結扎穿刺;腹腔注射;氣管滴注
急性肺損傷(acute lung injury, ALI)由嚴重感染、休克、誤吸等肺內外致病因素引發,臨床主要表現為急性進行性加重的呼吸困難和難治性低氧血癥,嚴重者可發展為急性呼吸窘迫綜合征(acute respiratory distress sydrome, ARDS)[1]。雖然對ALI的相關性研究已持續多年,但其發病率仍居高不下[2],病死率高達30%~40%[3]。建立可靠的動物模型對研究ALI病理改變和發病機制至關重要。ALI動物模型主要包含原發性和繼發性兩種。原發性ALI是向氣管內注射鹽酸、油酸和脂多糖等物質來直接誘導肺部損傷[4-5],而繼發性ALI則是通過引發全身性疾病來誘導肺損傷,包含腹腔注射脂多糖(lipopolysacch-aride,LPS)、盲腸結扎穿刺(cecal ligation and puncture,CLP)等。在眾多模型制備方法中,氣管滴注LPS及腹腔注射LPS由于操作簡單、觀察直觀而被廣泛應用,而由Wechetrman等提出的CLP法因能較好地模擬膿毒癥的發生發展過程也得以普遍應用。本研究針對上述3種肺損傷模型進行系統分析和比較。
1材料與方法
1.1實驗動物與主要儀器
1.1.1動物健康成年SD大鼠70只,雄性,體質量(220±10) g,SPF級,購自第三軍醫大學大坪醫院實驗動物中心,動物合格證號:SYXK(渝)2012-0010。
1.1.2試劑LPS購自美國Sigma公司(0111: B4);蛋白濃度檢測試劑盒購自上海碧云天生物技術有限公司;瑞氏-姬姆薩染色試劑盒購自南京建成科技有限公司;RPMI 1640細胞培養基購自美國Gibco公司。
1.1.3動物分組和模型制備將70只成年SD大鼠隨機分為7組,每組10只:正常組、腹腔注射LPS(LPS-IP)組及其假手術組1(SHAM-1);氣管滴注LPS(LPS-IT)組及其假手術組2(SHAM-2);盲腸結扎穿刺(CLP)組及其假手術組3(SHAM-3)。正常組不進行任何干預。LPS-IP組腹腔注射LPS溶液10 mg/kg(1 mL); SHAM-1組腹腔注射生理鹽水1 mL。LPS-IT組用水合氯醛腹腔注射麻醉后(8%,1 mL),將大鼠固定,分離暴露氣管,插管,經支氣管緩慢滴注內毒素溶液5 mg/kg(100 μL),縫合傷口; SHAM-2組同LSP-IT組插管后,氣管滴注生理鹽水100 μL。CLP組使用水合氯醛腹腔注射麻醉后(8%,1 mL),將大鼠固定,消毒腹部皮膚,腹中線位置處切開,在盲腸1.2 cm處結扎,使用4號針頭進行垂直穿刺,完整縫合傷口; SHAM-3組采用相同的手術方法,暴露盲腸后縫合。本實驗選擇的藥物劑量及時間點根據參照文獻[6-7]及本課題組的預實驗結果確定。在造模24 h后,腹主動脈取血至死,取出完整的肺,結扎右肺,取右肺下葉測量濕干比(W/ D)。其余肺葉用于HE染色。左肺扎入24 G留滯針頭,用預冷無菌生理鹽水1 mL緩慢注入肺內,可見大鼠左肺逐漸變得膨隆, 緩慢回收支氣管肺泡灌洗液(bronchoalvage lavage fluid ,BALF), 再將所得液體緩緩注入肺內, 如此反復3次, 最后1次注入后回收灌洗液,置于10 mL的離心管中(放于冰浴中)。重復上述操作3次。
1.2檢測指標與方法
1.2.1血氣分析造模24 h后,經腹主動脈取血,用血氣分析儀檢測PaO2、PaCO2值。
1.2.2W/D取右肺下葉組織,置于干燥稱量紙上稱得濕重,置60 ℃恒溫箱,烘烤72 h后稱量干重,以W/D表示肺組織含水量。
1.2.3肺灌洗液總蛋白濃度采用二喹啉甲酸(bicinchoninic acid,BCA)蛋白測定法。將所得BALF,于4 ℃,300×g,離心10 min, 取離心后支氣管肺泡灌洗液的上清液為待測樣品,加入蛋白檢測試劑盒中相應試劑,可見分光光度計比色,波長570 nm,參考標準曲線得出樣品蛋白質含量。每個標本均測定,取平均值即為各組動物支氣管肺泡灌洗液的總蛋白含量。
1.2.4肺灌洗液總細胞數將BALF離心后的細胞團重新懸浮,并計數。每只大鼠單獨計數,取平均值作為該組細胞計數總結果。
1.2.5BALF細胞組成將BALF細胞團離心,300×g離心10 min,將細胞團均勻涂抹在載玻片上,放于4%多聚甲醛固定10 min,晾干,瑞氏-姬姆薩染色,顯微鏡下觀察不同細胞比例。中性粒細胞胞漿顆粒呈淡紫紅色,細胞核多葉;肺泡巨噬細胞胞漿呈淡紫色,細胞核為完整的圓形。
1.2.6肺組織病理變化取肺組織,4%多聚甲醛固定24 h后,放入0.5%多聚甲醛保存。脫水、包埋和切片后行蘇木精-伊紅(HE)染色,鏡下觀察肺組織病理變化。
1.3統計學方法
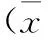
2結果
2.1血氣分析
造模后24 h,LPS-IT組和LPS-IP組PaO2低于正常組以及相應的假手術組(P<0.05),而CLP組與其余各組比較,差異無統計學意義(P>0.05),LPS-IT組與LPS-IP組比較,差異無統計學意義(P>0.05);正常組與各假手術組比較,差異也無統計學意義(P>0.05);各組間PaCO2比較,差異均無統計學意義(P>0.05)(表1)。
2.2W/D
造模后24 h,與正常組及假手術組相比,LPS-IT組和LPS-IP組肺組織W/D明顯增高(P<0.05),而CLP組變化不明顯(P>0.05);LPS-IT組與LPS-IP組比較,差異無統計學意義(P>0.05)(表1)。結果表明LPS-IT組和LPS-IP組出現明顯肺水腫,但CLP組未出現此現象。
2.3肺灌洗液總蛋白濃度
LPS-IT組和LPS-IP組的肺灌洗液總蛋白濃度均高于正常組和假手術組(P<0.05),但LPS-IT組與LPS-IP組比較,差異無統計學意義(P>0.05);CLP組、正常組和假手術組比較,差異無統計學意義(P>0.05);CLP組的蛋白濃度明顯低于LPS-IP組和LPS-IT組(表1),其中與LPS-IP組比較,差異有統計學意義(P<0.05)。
2.4肺灌洗液總細胞數
除CLP組外,來源于LPS-IT組和LPS-IP組中的肺灌洗液總細胞數均高于正常組和假手術組(P<0.05),LPS-IT組和LPS-IP組比較,差異無統計學意義(P>0.05),CLP組、正常組和假手術組比較,差異無統計學意義(P>0.05)(表1)。
2.5BALF細胞瑞氏-姬姆薩染色
LPS-IT組和LPS-IP組出現中性粒細胞浸潤,且比例大于細胞總數的80%;各假手術組及 CLP組未出現中性粒細胞浸潤(圖1)。
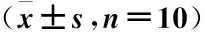
表1 不同模型肺損傷指標比較
注:1 mm Hg=0.133 KPa;與自身假手術組比較,aP<0.05;與正常組比較,bP<0.05;與LPS-IT組比較,cP<0.05;與LPS-IP組比較,dP<0.05
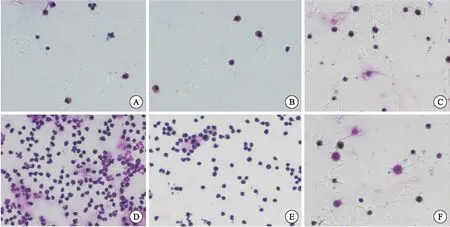
圖1肺泡灌洗液中細胞的瑞氏-姬姆薩染色(×200)
注:A:SHAM-1組;B:SHAM-2組;C:SHAM-3組;D:LPS-IT 組;E:LPS-IP組;F:CLP組
2.6HE染色
各假手術組肺泡結構完整,無損傷表現;LPS-IT組和LPS-IP組出現肺間質水腫、肺泡結構紊亂和肺泡壁變厚等病理學改變;CLP組未見明顯病理學改變(圖2)。
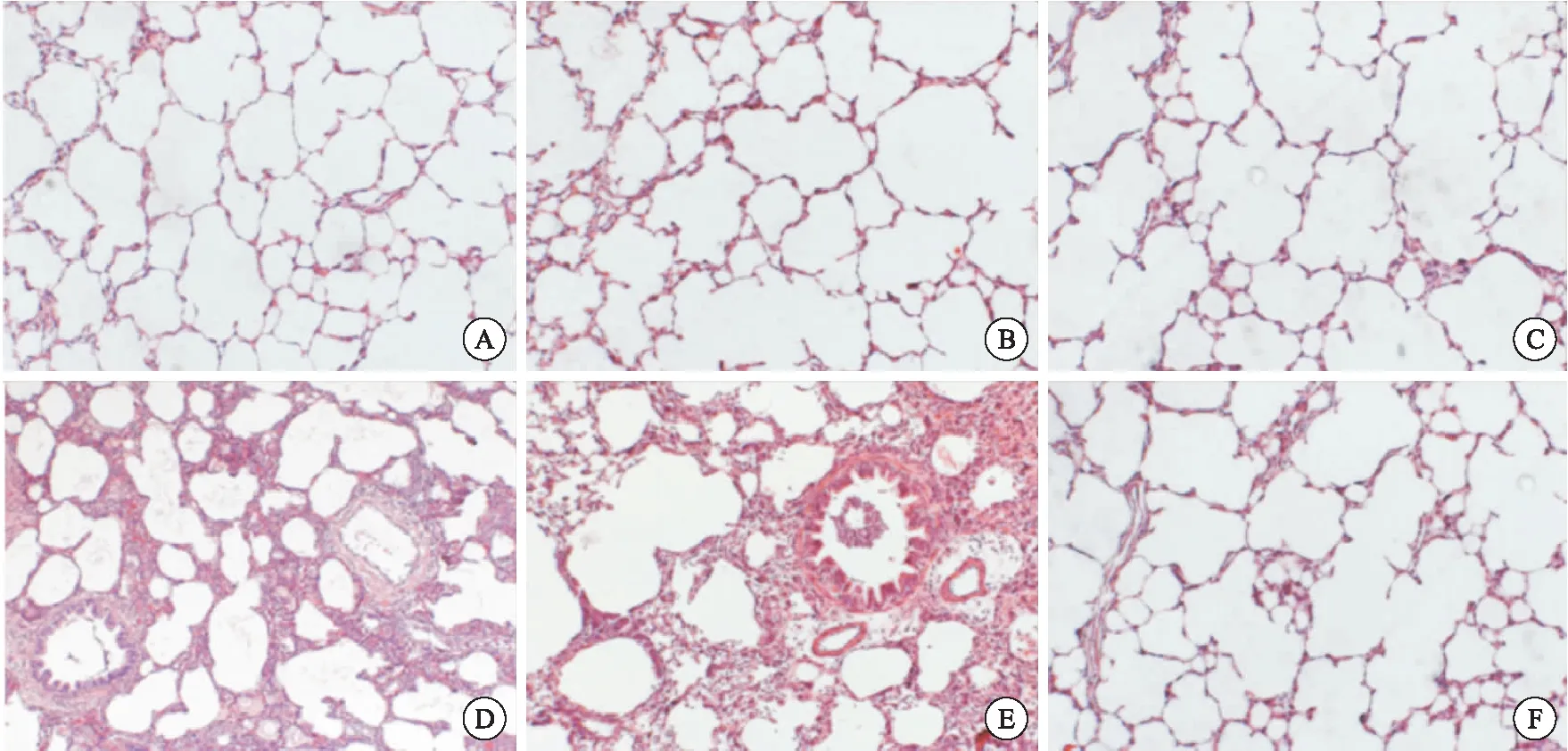
圖2光鏡下觀察不同模型組的組織病理學變化(×100)
注:A:SHAM-1組;B:SHAM-2組;C:SHAM-3組;D:LPS-IT 組;E:LPS-IP組;F:CLP組
3討論
急性肺損傷動物模型是研究ALI/ARDS發病機制及有效療法的重要實驗手段。本研究所討論的腹腔注射LPS、氣管滴注LPS以及CLP 3種急性肺損傷模型均是典型的原發性或繼發性急性肺損傷模型。它們分別具有各自的優勢:LPS-IP模型的實驗操作簡單穩定,動物無需進行麻醉或有創操作,并且LPS經腹腔注射后會隨血流均勻分布于臟器中,因此臟器相同部位具有較強的可比性,可減少實驗誤差,節約標本[8];LPS經氣管直接注入肺部后,會使得局部炎癥反應加劇,造成更加嚴重的局部損傷,組間差異明顯[9];CLP因能較好地模擬人類膿毒癥發病過程而被視作膿毒癥動物模型的“金標準”,并被廣泛應用于急性肺損傷等膿毒癥相關并發癥的研究[10-11]。
評價一個動物模型是否合格主要取決于它是否能較好地模擬該疾病的發生、發展過程,包括組織病理學和生理學變化[12]。ALI/ARDS的主要病理學特征表現為上皮細胞損傷、中性粒細胞等炎性細胞浸潤和滲透性肺水腫的形成[13]。本研究LPS-IT組和LPS-IP 組W/D、肺灌洗液總蛋白濃度和細胞總數均明顯增加,通過HE染色發現兩組肺臟組織結構出現明顯異常,表現為不同程度的肺泡壁增厚、肺泡間隔加寬、肺泡結構遭到嚴重的破壞(圖2),但是CLP 組僅觀察到肺泡灌洗液中含有巨噬細胞。由此可見,氣管滴注或腹腔注射LPS 均可造成上皮細胞損傷、肺水腫以及以中性粒細胞為主的炎性細胞浸潤,表明這兩種模型均能成功模擬ALI的病理學特征。在功能性指標方面,血氣分析發現,僅LPS-IT組和LPS-IP組的PaO2與正常組相比有所降低,其余指標均正常,這有可能是機體代償效應所致。
本研究意外發現,LPS-IT組與LPS-IP組所造成的肺部損傷程度并無明顯差異,且CLP 組未出現明顯肺損傷。CLP組實驗結果與Iskander等[14]的結果相似,Iskander等檢測了CLP后肺平均動脈壓等多個相關指標,明確提出CLP模型不能造成動物ALI。結合本課題組的實驗,分析出現上述現象的原因可能為:1)觀察點的選取。文獻報道,氣管滴注LPS誘導的肺損傷模型,肺泡灌洗液中中性粒細胞數量在造模后24~96 h都維持在較高水平,隨后恢復正常[13]。而通過LPS間接引發肺損傷模型出現明顯炎性細胞浸潤是在損傷后24 h[12]。因此,本研究選取24 h作為模型最后終止時間,但LPS-IT組、LPS-IP組和CLP組出現肺損傷的高峰期并非都是24 h,尤其對于CLP模型,肺損傷的高峰期可能出現在48 h以后[15-17]。2)造模方式。在急性肺損傷模型建立過程中,CLP通常不單獨引發肺損傷,而是通過聯合免疫復合物、失血性休克[17]等措施造成小鼠二次打擊來促使肺損傷的發生[18]。3)嚴重程度差異。由于盲腸結扎長度以及穿孔大小均會影響CLP的嚴重程度,進而影響急性肺損傷等并發癥的發生率[17,19]。
綜上所述,針對24 h這一時間節點,腹腔注射LPS以及氣管滴注LPS均能較好地模擬急性肺損傷的發病過程,而在本課題組實驗條件下CLP卻不能很好模擬上述過程。表明腹腔注射LPS以及氣管滴注LPS更適合用于急性肺損傷模型的建立。
參考文獻
[1]Erickson S, Schibler A, Numa A,etal. Acute lung injury in pediatric intensive care in Australia and New Zealand: a prospective, multicenter, observational study[J]. Pediatr Crit Care Med, 2007, 8(4): 317-323.
[2]梁華平, 姚詠明, 王正國. 創傷后膿毒癥的治療現狀不容樂觀——預警研究值得重視[J]. 第三軍醫大學學報, 2011, 33(21):2223-2226.
[3]Jesús V, Fernández RL, Alfonso A,etal. A clinical classification of the acute respiratory distress syndrome for predicting outcome and guiding medical therapy[J]. Critical Care Medicine, 2015, 43(2):346-353.
[4]Rocco PR, Zin WA. Pulmonary and extrapulmonary acute respiratory distress syndrome: are they different[J]. Curr Opin Crit Care, 2005, 11(1): 10-17.
[5]韓楓, 凌心. 吡非尼酮及鹽酸氨溴索對百草枯誘導的大鼠急性肺損傷保護作用的比較[J]. 成都醫學院學報, 2014, 9(1):15-17,73.
[6]Tsujimoto H, Ono S, Mochizuki H,etal. Role of macrophage inflammatory protein 2 in acute lung injury in murine peritonitis[J]. J Surg Res, 2002, 103(1): 61-67.
[7]Wu R, Dong W, Zhou M,etal. Ghrelin attenuates sepsis-induced acute lung injury and mortality in rats[J]. Am J Respir Crit Care Med, 2007, 176(8): 805-813.
[8]Zhao LL, Hu GC, Zhu SS,etal. Propofol pretreatment attenuates lipopolysaccharide-induced acute lung injury in rats by activating the phosphoinositide-3-kinase/Akt pathway[J]. Braz J Med Biol Res, 2014, 47(12): 1062-1067.
[9]Ma CH, Liu JP, Qu R,etal. Tectorigenin inhibits the inflammation of LPS-induced acute lung injury in mice[J]. Chin J Nat Med, 2014, 12(11): 841-846.
[10] Zhai Y, Zhou X, Dai Q,etal. Hydrogen-rich saline ameliorates lung injury associated with cecal ligation and puncture-induced sepsis in rats[J]. Exp Mol Pathol, 2015, 98(2): 268-276.
[11] 周長喜.膿毒癥肺損傷大鼠鞭毛蛋白含量變化及其意義探討[D].重慶:第三軍醫大學,2004.
[12] 王俏, 朱虹, 朱健, 等. TLR4在膿毒癥大鼠急性肺損傷中作用[J]. 中華實用診斷與治療雜志, 2011, 25(2):157-158,161.
[13] Janssen WJ, Barthel L, Muldrow A,etal. Fas determines differential fates of resident and recruited macrophages during resolution of acute lung injury[J]. Am J Respir Crit Care Med, 2011, 184(5): 547-560.
[14] Iskander KN, Craciun FL, Stepien DM,etal. Cecal ligation and puncture-induced murine sepsis does not cause lung injury[J]. Crit Care Med, 2013, 41(1): 159-170.
[15] Asaduzzaman M, Rahman M, Jeppsson B,etal. P-selectin glycoprotein-ligand-1 regulates pulmonary recruitment of neutrophils in a platelet-independent manner in abdominal sepsis[J]. British Journal of Pharmacology, 2009, 156(2):307-315.
[16] Doerschug KC, Powers LS, Monick MM,etal. Antibiotics delay but do not prevent bacteremia and lung injury in murine sepsis[J]. Crit Care Med, 2004, 32(2): 489-494.
[17] Czermak BJ, Breckwoldt M, Ravage ZB,etal. Mechanisms of enhanced lung injury during sepsis[J]. Am J Pathol, 1999, 154(4): 1057-1065.
[18] Lomas-Neira J, Chung CS, Perl M,etal. Role of alveolar macrophage and migrating neutrophils in hemorrhage-induced priming for ALI subsequent to septic challenge[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(1): 51-58.
[19] Gold JA, Parsey M, Hoshino Y,etal. CD40 contributes to lethality in acute sepsis: in vivo role for CD40 in innate immunity[J]. Infect Immun, 2003, 71(6): 3521-3528.
Comparison of Three Rats′ Models of Acute Lung Injury
WangTing1,LiangHuaping2,ChaiJianshen2,CaiKangxing2,HouFengyan2,FanXia2,LiYi1△.
1.SchoolofPharmacy,ChengduMedicalCollege,Chengdu610083,China;2.StateKeyLaboratoryofTrauma,BurnsandCombinedInjury,ResearchInstituteofSurgery,DapingHospital,theThirdMilitaryMedicalUniversity,Chongqing400042,China
【Abstract】ObjectiveTo compare the difference among three models of acute lung injury induced by intraperitoneal injections with Lipopolysaccharide(LPS), intratracheal instillation with LPS and cecal ligation and puncture(CLP). Methods70 adult SD rats were randomly divided into 7 groups i.e. normal group; sham group 1, secondary ALI group (LPS-IP group, intraperitoneal injection of 10 mg/kg of LPS); sham surgery group 2, primary ALI group (LPS-IT group, intratracheal instillation 5 mg/kg of LPS); sham group 3, cecal ligation and puncture group (CLP group). 24 hours after operation, arterial blood, lung lavage, lung tissue were collected and rat′s blood, wetmassto dry mass ratio, lung lavage fluid protein content, cell count and cell grouping were detected via BCA protein assay, blood cell count plate and Wright′s Giemsa staining, respectively. Pathological changes in lung tissues were evaluated with hematoxylin-eosin staining. ResultsCompared with normal group, the pulmonary edema and pulmonary permeability of LPS-IT and LPS-IP groups were higher, protein content and total cell volume were increased and neutrophil infiltration was obviously more severe in lung lavage(P<0.05). Meanwhile, PaO2 was significantly lower than the normal group and the corresponding sham surgery group (P<0.05). There were obvious pathological changes in lung, including edema and thickening of alveolar walls, infiltration of inflammatory cells, and obvious bleeding in the local lung tissue. No obvious lung damage appeared in CLP group. Conclusion Both intraperitoneal injection and intratracheal instillation of LPS can induce obvious lung injury, and the latter can cause more severe lung injury while CLP did not cause obvious lung damage. Intraperitoneal injection and intratracheal instillation of LPS are more suitable for establish acute lung injury models and the following animal experiments using drugs.
【Key words】Acute lung injury;Cecal ligation and puncture;Intraperitoneal injection;Intratracheal instillation
doi:10.3969/j.issn.1674-2257.2016.01.002
*基金項目:國家重點基礎研究發展計劃973項目(No:2012CB518102); 軍隊“十二五”重點項目(No:BWS11J038)
通信作者:△李羿,E-mail:lychengdu@aliyun.com
【中圖分類號】R363.2
【文獻標志碼】A
網絡出版地址:http://www.cnki.net/kcms/detail/51.1705.R.20160301.0944.008.html
·論著·

