改良FLAG與HAA方案治療復發難治性急性髓系白血病療效的對比研究*
曹翊雄,李君君,羅澤宇,文 鋒
(南華大學附屬第一醫院血液內科,湖南衡陽421001)
?
改良FLAG與HAA方案治療復發難治性急性髓系白血病療效的對比研究*
曹翊雄,李君君,羅澤宇,文鋒
(南華大學附屬第一醫院血液內科,湖南衡陽421001)
摘要:目的對比分析改良氟達拉濱聯合阿糖胞苷和粒細胞集落刺激因子方案(FLAG)與高三尖杉酯堿、Ara-C和阿柔比星聯合方案(HAA)對復發難治性急性髓系白血病(AML)的療效及安全性。方法回顧性分析29例復發難治性成年非M3型AML患者的臨床資料,按化療方案分為改良FLAG組(17例)和HAA組(12例),觀察兩組的療效及不良反應。結果改良FLAG組完全緩解(CR)10例(58.80%),部分緩解(PR)1例(5.88%),總有效率(OR^)為64.68%(11/17)。HAA組CR 6例(50.00%),PR 1例(8.33%);OR^為58.33%(7/12)。兩組有效率比較差異無統計學意義(P>0.05)。兩組患者的主要不良反應為骨髓抑制、感染,改良FLAG組骨髓抑制作用較HAA組重,但兩組在并發感染、出血、肝臟及心臟毒性等非血液學不良反應發生率方面比較,差異無統計學意義。結論改良FLAG方案和HAA方案均為復發難治性AML的有效治療方案,兩者療效相近,心臟毒性低,不良反應可耐受,可作為復發難治性AML的一線治療方案。
關鍵詞:白血病;急性;髓樣;復發;難治;氟達拉濱
復發難治是目前導致急性髓系白血病(acute myelocytic leukemia,AML)患者治療失敗的主要原因,是當前AML治療的重點和難點。目前,國際上對于復發難治性AML尚無首選的化療方案。近年來FLAG方案[氟達拉濱(Fludarabine,Flud)聯合阿糖胞苷(arabinosyl cytosine,Ara-C)和粒細胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)]用于治療復發難治性AML,取得較好的療效[1]。由于使用該方案后骨髓抑制重,易出現重度感染,治療相關死亡率(treatment related mortality,TRM)較高,限制該方案的臨床應用。HAA[高三尖杉酯堿(Homohar ringtonine,HHT)、Ara-C和阿柔比星(Aclacinomycin,Acla)3藥聯合]在初治AML誘導治療中有較好的臨床療效,在復發難治AML中的應用也越來越多,獲得較好的療效[2]。本研究將FLAG方案中的Ara-C大劑量改為中劑量,作為改良的FLAG方案,并對比分析改良FLAG方案與HAA方案治療復發難治AML的療效和不良反應。
1 資料與方法
1.1 病例資料
回顧性分析2012年7月-2015年1月本院收治的29例復發難治成年AML(M3除外)患者的臨床資料。所有患者經骨髓細胞形態學、免疫學、細胞遺傳學、分子生物學分型診斷明確。均符合復發、難治診斷標準[3]:復發性AML定義為完全緩解(complete response,CR)后,外周血重新出現白血病細胞或骨髓原始細胞>0.05(除鞏固化療后骨髓重建等其他原因外)或髓外出現白血病細胞浸潤。難治性AML定義為:①標準方案誘導化療2個療程未獲CR;②第1次CR后6個月內復發;③第1次CR后6個月后復發,經原方案再誘導化療失敗;④≥2次復發;⑤髓外白血病持續存在。
29例患者按化療方案分為改良FLAG組和HAA組。其中,改良FLAG組17例,男性7例,女性10例;中位年齡45歲(23~62歲);按法美英分型標準,M2 12例,M4 1例,M5 4例;其中復發性患者3例,難治性患者14例。HAA組12例,男性6例,女性6例;中位年齡48.7歲(25~60歲);按法美英分型標準,M1 1例,M2 7例,M4 1例,M5 3例;其中復發性患者5例,難治性患者7例。兩組患者在化療前除白細胞計數(white blood count,WBC)HAA組較FLAG組高外,骨髓幼稚細胞比例、中位血小板計數(Platelets,PLT)、血紅蛋白(Hemoglobin,Hb)比較,差異無統計學意義(P>0.05)。所有患者體力狀態評分≤2分;無嚴重的呼吸、循環系統疾病及肝腎功能損害。兩組患者的一般資料見表1。

表1 兩組患者一般資料比較
1.2 治療方案
1.2.1 改良FLAG方案Flud 30 mg/(m2·d),靜脈滴注,第1~5天;Ara-c 1g/(m2·d),Flud 4h后靜脈滴注,第1~5天;G-CSF 200μg/(m2·d),皮下注射,第1~5天。WBC>20×109/L時停用G-CSF。
1.2.2 HAA方案HHT 2 mg/(m2·d),靜脈滴注,第1~5或1~7天;Ara-c 100~150 mg/(m2·d),靜脈滴注,第1~5或1~7天;Acla 12~15 mg/(m2·d),靜脈滴注,第1~5或1~7天。根據外周血白細胞計數及PLT減少程度決定化療時間長短(5~7天)。
1.2.3 后續治療以上兩方案治療1療程后如獲得CR,繼續使用1療程鞏固治療。如獲得部分緩解(partial response,PR),再使用1療程,觀察緩解情況。如未緩解則改用其他方案或臨床試驗。
1.3 支持治療
所有患者化療的同時予以護肝、護心、止吐、水化、堿化治療。治療期間予以生理鹽水與碳酸氫鈉交替漱口,高錳酸鉀坐浴;病房常規進行紫外線消毒,2次/d。監測患者血常規及肝腎功能、電解質。當患者有發熱、咳嗽、腹瀉等感染癥狀時,予以行病原學檢查如血培養、痰培養等,并根據經驗和藥敏結果予以廣譜抗生素治療,并加強營養支持治療。如檢出真菌或使用廣譜抗生素>96 h仍發熱,則同時予以抗真菌治療。骨髓抑制期當WBC<2×109/L時使用G-CSF;PLT<20×109/L予以輸注血小板;血紅蛋白<60 g/L時輸注紅細胞。
1.4 療效及不良反應判斷
化療后結束后4周予以骨髓細胞形態學檢查,復發難治性急性髓系白血病療效標準參照文獻[3-4],分為:CR、PR、未緩解(Nonresponse,NR);以CR和PR的患者數之和計算總有效率(overall response,OR)。血液學和非血液學不良反應參照世界衛生組織藥物不良反應分級。化療后4周內死亡為早期死亡。
1.5 統計學方法
采用SPSS 20.0統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,用t檢驗;計數資料以用百分比或率表示,用Fisher’s確切概率法,P<0.05為差異有統計學意義。
2 結果
2.1 臨床療效
改良FLAG組17例患者中CR 10例(58.80%),PR 1例(5.88%),總有效率為64.70%;HAA組12例患者中CR 6例(50.00%),PR 1例(8.30%);總有效率為58.30%。兩組CR率及總有效率比較,差異無統計學意義(P=0.716和0.728)。改良FLAG組3例復發患者中2例CR(66.7%),HAA組5例復發患者均為CR,緩解率為100.0%;改良FLAG組14例難治患者中8例CR(57.1%),1例PR,總有效率為64.3%,HAA組7例難治患者,僅1例CR(14.3%),1例PR,總有效率為28.6%,FLAG方案對于難治AML患者CR率優于HAA組(P=0.024)。見表2。
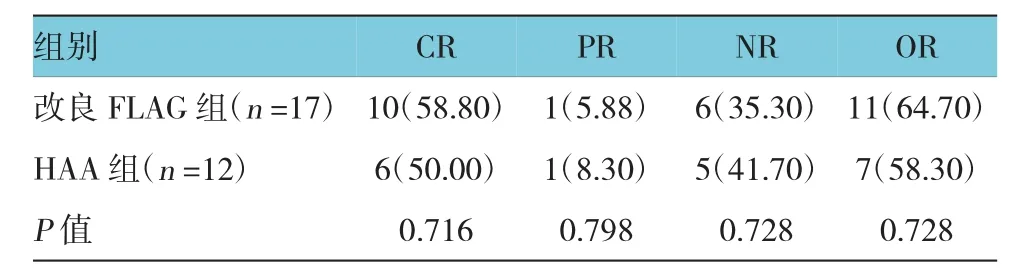
表2 兩組患者療效比較 例(%)
2.2 不良反應
2.2.1 血液學不良反應血液學不良反應主要表現為骨髓抑制,改良FLAG組和HAA組4級血液不良反應發生率分別為100.00%和91.67%,差異無統計學意義(P>0.05);但改良FLAG組患者血細胞減少的持續時間較HAA組長。改良FLAG組有3例患者中性粒細胞(absolute neutrophil count,ANC)重度減低未恢復;其余14例患者ANC<0.5×109/L持續的中位時間為14 d(10~28 d);有3例患者PLT重度減低未恢復,剩余14例患者PLT<20×109/L持續的中位時間為12 d(4~28 d);HAA組12例患者ANC<0.5×109/L持續的中位時間為12 d(0~20 d);PLT<20×109/L持續的中位時間為10 d(3~21 d)。改良FLAG組出血8例(47%),多為皮膚黏膜出血、牙齦出血及鼻衄,重度出血1例,為嘔血;HAA組出血4例(33%),重度出血1例,為咯血,兩組出血發生率比較差異無統計學意義(P>0.05)。
2.2.2 感染雖然改良FLAG組患者中性粒細胞減少的持續時間較HAA組長,但兩組感染發生率比較差異無統計學意義(P>0.05):改良FLAG組感染發生率為82.4%(14/17);HAA組感染發生率為83.3% (10/12)。敗血癥、肺部感染為主要感染并發癥。HAA 組1例出現結核感染,1例肛周膿腫,3例腸道感染。兩組各有1例患者因嚴重感染出現早期死亡。
2.2.3 其他非血液學不良反應化療期間兩組患者均有不同程度惡心、嘔吐、肝功能損害等不良反應。改良FLAG組與HAA組均發生1例肝功能損傷,為谷丙轉氨酶輕度升高,在護肝治療后均恢復正常。改良FLAG組有1例患者發生陣發性室上性心動過速,予以控制心室率治療,血象恢復后轉心內科行射頻消融術后好轉。兩組患者嘔吐、心臟毒性、肝毒性發生率比較,差異無統計學意義(P>0.05)。見表3。

表3 兩組患者非血液學不良反應比較 例(%)
3 討論
近年來,成年AML患者的化療已取得明顯效果。一線藥物可使80%的患者獲得CR,但復發難治性AML治療效果差,是導致AML治療失敗的最根本原因,迄今為止,復發難治性AML尚無理想的化療方案。近年來,FLAG方案被應用于治療復發難治性急性髓系白血病,并取得令人滿意的效果。Flud是第二代嘌呤核苷類似物,通過作用于DNA聚合酶和核苷酸還原酶,能有效抑制多種腫瘤細胞的DNA、RNA和蛋白質合成,并且與Ara-C具有協同作用。G-CSF可以動員G0期細胞進入G1期,從而增強骨髓白血病細胞對Ara-C的敏感性,因而由Flud、Ara-C、G-CSF組成的FLAG方案在復發難治AML的治療中療效顯著,文獻報道其治療復發難治性急性髓系白血病的緩解率可達50%~80%[5-6]。但是傳統的FLAG方案骨髓抑制較重,易出現嚴重感染等不良反應。LEE等[7]研究發現,61例復發難治的AML患者CR率達47.5%,但是治療相關死亡率也達11.4%,主要為侵襲性真菌感染。因此,如何在保證FLAG顯著療效的前提下,減少其不良反應,也是眾多學者思考的問題。國內一項多中心試驗報道改良的FLAG方案[Ara-c 1 g/(m2·d)]CR率為47.62%,FLAG方案[Ara-c 2 g/(m2·d)]CR率為50.00%,TRM率分別為3.57% 和10.34%[8],可見改良FLAG方案在減少不良反應的同時,臨床療效未受明顯的影響。本研究應用改良FLAG方案治療17例復發難治AML患者,CR率為58.8%,TRM率為5.88%,與國內外報道的傳統FLAG方案療效相當,且嚴重不良反應發生率低,進一步證實改良FLAG方案具有良好的臨床療效及安全性。
HHT是從三尖杉植物中提取的生物堿類抗癌藥,其作用機制為抑制腫瘤細胞DNA和蛋白質合成。與其他抗白血病化療藥相比,具有較低的心臟和骨髓毒性,已被廣泛使用。研究表明,HHT與Acla不存在交叉耐藥[9],而體外實驗也進一步證實HHT 與Acla之間存在協同效應。MAI等[10]研究發現,HHT有將白血病細胞阻滯于S期的作用,而S期正是DNA合成期,可能加強Ara-c的誘導凋亡作用,從而起到協同抗白血病效應。因此由HHT、Acla、Ara-c組成的HAA被廣泛應用于臨床,且在初治及復發難治性AML治療中表現出良好的療效[2,11]。本研究應用HAA方案治療復發難治白血病12例患者,CR率達50%,效果良好,與相關報道結果一致。
基于改良FLAG方案和HAA均為復發難治AML切實有效的化療方案,筆者將兩者進行療效對比研究,分析其對復發難治AML的療效與不良反應。本研究證實,改良FLAG方案對于復發難治AML的CR率達58.8%,總有效率為64.7%,而HAA 組CR率也達50.0%,總有效率為58.3%,療效相當。在復發組兩方案均表現出極高的CR率,HAA組CR率達100%,改良FLAG組CR率達80%。但是對于難治組患者,改良FLAG組CR率達57.1%,總有效率為64.3%;而HAA組CR率僅為14.3%,總有效率為28.6%,改良FLAG組對難治AML患者的療效優于HAA組。
在不良反應方面,兩組均表現出來較強的骨髓抑制。改良FLAG組3例患者中性粒細胞未恢復,3例患者PLT未恢復,均為未緩解患者,考慮與化療無效有關。改良FLAG組血液學不良反應雖較HAA方案重,但兩組患者的感染率比較,差異無統計學意義。在積極抗感染和強力支持治療下,大部分患者能安全度過骨髓抑制期,兩組僅各出現1例患者早期死亡。同時在心、肝、腎毒性方面也未出現明顯的不良反應,耐受性良好。
綜上所述,改良FLAG方案和HAA方案治療復發難治性AML總療效相近,均有較好的療效,對于難治性AML,改良FLAG方案療效更佳。兩者非血液學不良反應較小,耐受性良好。雖然改良FLAG方案骨髓抑制作用更強,但其感染發生率并未增加。在目前復發難治性AML尚無標準化療方案的情況下,改良FLAG與HAA方案均為不錯的選擇。由于本研究病例數較少,有待大規模、多中心的前瞻性隨機臨床試驗進一步證實。
參考文獻:
[1]FIEGL M,UNTERHALT M,KERN W,et al. Chemomodulation of sequential high-dose cytarabine by fludarabine in relapsed or refractory acute myeloid leukemia: a randomized trial of the AMLCG[J]. Leukemia,2014,28(5): 1001-1007.
[2]胡小山,宮立眾,岑堅,等. HAA方案誘導治療初治及復發、難治急性髓系白血病臨床分析[J].白血病?淋巴瘤,2013,22(4): 226-229.
[3]中華醫學會血液學分會.急性髓系白血病(復發難治性)中國診療指南(2011年版)[J].中華血液學雜志,2011,32(12): 887-888.
[4]張之南,沈悌.血液病診斷及療效標準[M].第3版.北京:科學出版社,2007: 131-134.
[5]CAMERA A,RINALDIC R,PALMIERI S,et al. Sequential continuous infusion of fludarabine and eytarabine associated with liposomal daunorubicin(Dauno Xome(R)(FLAG)in primary refractory or relapsed adult acute myeloid leukemia patients[J]. Ann Hematol,2009,88(2): 151-158.
[6]KANTARJIAN H,WANG X,PLUNKETT W K,et al. Treatment of core-binding-factor in acute myelogenous leukemia with fludarabine,cytarabine,and granulocyte colony-stimulating factor results in improved event-flee survival[J]. Cancer,2008,113(11): 3181-3185.
[7]LEE S R,YANG D H,AHN J S,et al. The clinical outcome of FLAG chemotherapy without idarubicin in patients with relapsedor refractory acute myeloid leukemia[J]. J Korean Med Sci,2009,24(3): 498-503.
[8]李軍民.改良劑量的FLAG方案在復發或難治的急性髓系白血病治療中的療效及安全性研究:一項中國多中心隨機對照臨床研究中期報告[A].中華醫學會血液學分會,第十一屆全國白血病淋巴瘤學術會議論文匯編[C];2011年.
[9]林茂芳,曾波航,吳佳麗,等. 61例成人急性非淋巴細胞白血病誘導化療HA和DA的比較[J].臨床血液學雜志,1992,5(1): 1-4.
[10]MAI W Y,LIN M F. Induction of apoptosis by homoharringtonine in G1 phase human chronic myeloid leukemia cells[J]. Chin Med J,2005,118(6): 487-492.
[11]葉佩佩,牧啟田,陳菲菲,等. HAA方案誘導治療成人初發急性髓系白血病236例療效觀察[J].中華血液學雜志,2013,34(1): 825-829.
(童穎丹編輯)
Curative effects of modified FLAG and HAA on relapsed refractory acute myeloid leukemia*
Yi-xiong Cao,Jun-jun Li,Ze-yu Luo,Feng Wen
(Department of Hematology,the First Hospital,University of South China,Hengyang,Hunan 421001,China)
Abstract:Objective To investigate the efficacy and toxicity of modified FLAG and HAA on relapsed refractory acute myeloid leukemia(AML). Methods Retrospective analysis was used to observe the therapeutic effects and side effects of 29 cases of relapsed refractory adult AML,which were divided into modified FLAG group(17 cases)and HAA group(12 cases)according to chemotherapy regimens. Results In the modified FLAG group,the complete remission(CR)rate was 58.80%(10/17),the partial remission(PR)rate was 5.88% (1/17),the overall response(OR^)rate was 64.68%(11/17). In the HAA group,the CR rate was 50.00%(6/12),the PR rate was 8.33%(1/12),and the overall response OR^rate was 58.33%(7/12);there were no statistical differences between the two groups(P>0.05). The main toxicities of the two groups were myelosupression and infection. Myelosupression in the modified FLAG group was severer than that in the HAA group. There was no significant difference in the incidence of secondary infection,haemorrhagia,hepatic toxicity or cardiac toxicities between both groups. Conclusions Both HAA regimen and modified FLAG regimen are effective for treatment of relapsed refractory adult acute myeloid leukemia with similar efficacy and low cardiac toxicity,and their side effects can be well tolerated. Thus,modified FLAG regimen and HAA regimen can be used as first-line treatment for this disease.
Keywords:leukemia,myeloid,acute;relapsed;refractory;Fludarabine
中圖分類號:R733.71
文獻標識碼:B
DOI:10.3969/j.issn.1005-8982.2016.11.015
文章編號:1005-8982(2016)011-0072-05
收稿日期:2016-01-15
*基金項目:湖南省自然科學基金(No:2016JJ4078);湖南省衛生計生委科研計劃課題(No:B2016131)

