46例胃腸道間質瘤臨床病理分析及免疫組織化學研究
聶瑜 付耒 呂國慶
46例胃腸道間質瘤臨床病理分析及免疫組織化學研究
聶瑜 付耒 呂國慶
目的 分析胃腸道間質瘤臨床病理并研究其免疫組織化學特點。方法 選擇胃腸道間質瘤患者46例為研究對象,觀察腫瘤的發生部位、大小及生長方式,評價不同部位胃腸道間質瘤的風險度,同時研究胃腸道間質瘤的免疫組織化學特點。結果 46例胃腸道間質瘤發生在胃部28例,占比為60.9%,發生在小腸10例,占比為21.7%,發生在大腸5例,占比為10.8%,發生在胃腸外3例,占比為6.6%。胃腸道間質瘤的生長方式主要分為腔內/外、腔內、腔外3種,其中腔內/外的生長方式占的比例最高為39.1%,且腔內/外生長方式的胃腸道間質瘤診斷為惡性的概率也大,而腔內生長方式的胃腸道間質瘤診斷為惡性的概率最小;腫瘤直徑在0.5~28cm。發生在胃部的胃腸道間質瘤的風險度較低,而發生在大腸和小腸的胃腸道間質瘤的風險度較高。免疫組織化學檢測顯示胃腸道間質瘤具有Vimentin、CD117、CD34高表達的特點,分別為100.0%(47/47)、93.6%(44/47)、85.1%(40/47),而SMA、S-100呈現出低表達的特點,分別為12.8%(6/47)和6.4%(3/47)。結論 胃腸道間質瘤主要發生在胃部,但是胃部的胃腸道間質瘤的風險度較低,而大腸和小腸部位的胃腸道間質瘤的風險度較高,需要引起臨床的重視;CD117、CD34等免疫組化指標在胃腸道間質瘤的診斷中具有較高的應用價值,但是仍需結合患者的生物學行為、腫瘤組織學特點等方面確診。
胃腸道間質瘤;臨床病理;免疫組織化學特點
胃腸道間質瘤屬于胃腸道間葉源性腫瘤,常見于中老年人群,研究認為胃腸道間質瘤的發生與飲食習慣、生活環境、遺傳等因素存在緊密的聯系[1]。良性胃腸道間質瘤早期無明顯的癥狀體征,病程可能長達10~20年,而惡性胃腸道間質瘤的病程較短,且病情的進展速度快,容易出現癌細胞的轉移。然而胃腸道間質瘤早期缺乏特異性的表現,且生物學行為變化較大,缺乏統一的診斷標準,因而臨床上常常出現誤診的現象,延誤了疾病治療的最佳時機,故如何有效提高胃腸道間質瘤診斷的準確率是現階段臨床研究的熱點[2]。研究發現結合組織形態學與免疫組織化學檢測能夠提高胃腸道間質瘤診斷的準確率,降低誤診率,但是目前臨床上對胃腸道間質瘤臨床病理與其免疫組織化學特點的研究報道并不多見[3],故本研究對胃腸道間質瘤臨床病理及其免疫組織化學特點展開研究分析,旨在為胃腸道間質瘤的診斷提供參考和借鑒,現報道如下。
1 資料與方法
1.1 一般資料 選擇2011年7月~2014年7月在新疆昌吉州人民醫院接受治療的胃腸道間質瘤患者46例作為研究對象,其中男21例,女25例;年齡18~82歲,平均年齡(58.3±7.1)歲;患者主要表現出腹部疼痛、消化道出血、失血貧血、腹部包塊等癥狀體征,部分患者合并腹腔內出血、腫塊感染、肝轉移、黃疸等癥狀。45例患者均接受完整病灶切除手術,1例患者由于病變嚴重轉移而接受姑息性減瘤治療。
1.2 方法 收集46例胃腸道間質瘤的腫瘤標本,放置于4%中性甲醛溶液中固定,石蠟包埋切片,使用免疫組織化學與HE染色。其中免疫組化選擇EnVision兩步法,操作過程:切片脫蠟至水,然后通過高壓修復,3%過氧化氫滅活內源性過氧化物酶15min,50μL稀釋后的一抗4℃過夜,嚴格按照試劑盒操作步驟展開,二氨基聯苯胺(DAB)顯色,蘇木精復染。免疫組化標記CD34、CD117、Vimentin、SMA以及S-100,使用已知陽性切片進行對照,磷酸鹽緩沖液(PBS)則替代一抗作陰性對照。EnVision等試劑盒及一抗、二抗均購自福州邁新生物技術開發有限公司。
1.3 評價標準 細胞膜或細胞質呈現為棕黃色顆粒且陽性細胞數超過10%判定為陽性;腫瘤風險度分級:主要分為極低風險性、低風險性、中度風險性和高度風險性4個等級,極低風險性:核分裂數<5個/50HPF且腫瘤直徑<2cm;低風險性:核分裂數<5個/50HPF且腫瘤直徑在2~5cm;中度風險性:核分裂數6~10個/50HPF且腫瘤直徑<5cm,或者核分裂數<5個/50HPF且腫瘤直徑在5~10cm;高度風險性:核分裂數>5個/50HPF且腫瘤直徑>5cm,或者滿足腫瘤直徑>10cm和核分裂數不計、核分裂>10個/50HPF腫瘤大小不計3個條件中的1個[4]。
2 結果
2.1 腫瘤發生部位 46例胃腸道間質瘤發生在胃部28例,占比為60.9%,發生在小腸10例,占比為21.7%,發生在大腸5例,占比為10.8%,發生在胃腸外3例,占比為6.6%。
2.2 腫瘤生長方式和直徑 胃腸道間質瘤的生長方式主要分為腔內/外、腔內、腔外3種,其中腔內/外的生長方式占的比例最高為39.1%,且腔內/外生長方式的胃腸道間質瘤診斷為惡性的概率也大,而腔內生長方式的胃腸道間質瘤診斷為惡性的概率最小;腫瘤直徑在0.5~28cm。見表1。
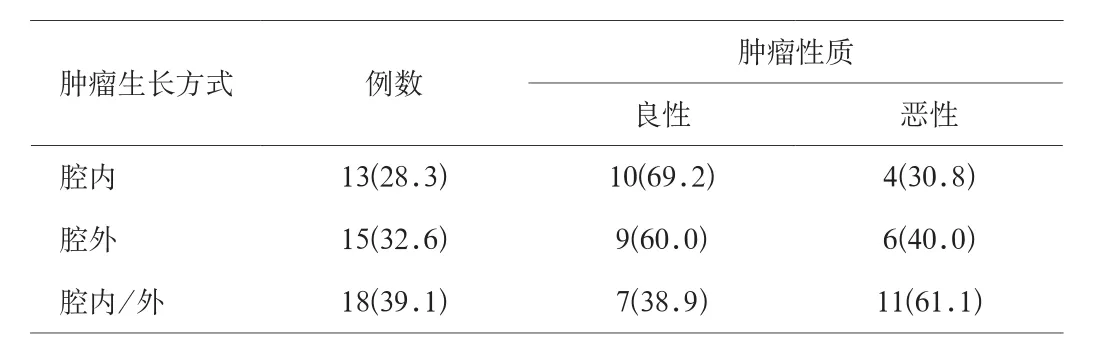
表1 腫瘤生長方式與腫瘤性質的關系[n(%)]
2.3 不同部位胃腸道間質瘤的腫瘤風險度 發生在胃部的胃腸道間質瘤的風險度較低,而發生在大腸和小腸的胃腸道間質瘤的風險度較高。見表2。
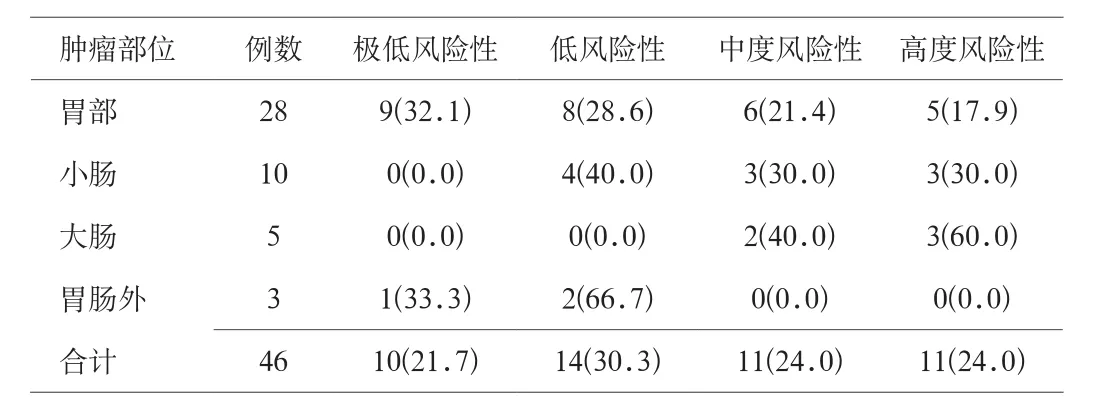
表2 不同部位胃腸道間質瘤的腫瘤風險度分析[n(%)]
2.4 胃腸道間質瘤組織學特征和免疫組織化學特點 顯微鏡下觀察顯示腫瘤的組織形態主要表現為上皮樣細胞和梭形細胞,其中上皮樣細胞腫瘤伴隨透明樣形態變異,梭形細胞腫瘤則伴有核端空泡;腫瘤組織的排列方式呈現出多樣化,分別有束狀(見圖1)、彌漫狀、旋渦狀以及編織狀(見圖2);另外,腫瘤細胞存在明顯的異型性與核分裂像,甚至部分腫瘤細胞與周圍組織粘連、出血囊性變及壞死。免疫組織化學檢測顯示胃腸道間質瘤具有Vimentin、CD117、CD34高表達的特點,分別為100.0%(47/47)、93.6%(44/47)、85.1%(40/47),而SMA、S-100呈現出低表達的特點,分別為12.8%(6/47)和6.4%(3/47)。
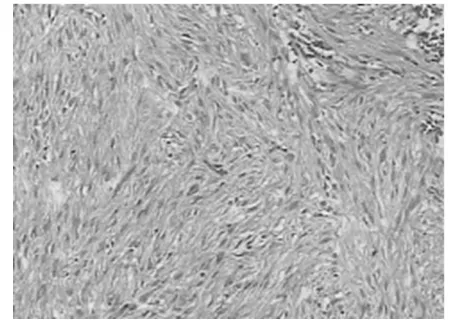
圖1 小腸間質瘤,高度危險性圖
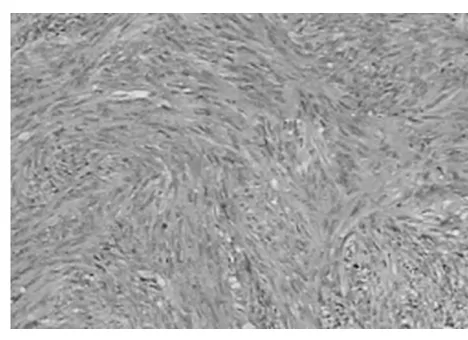
圖2 胃部間質瘤,中度危險性
3 討論
胃腸道間質瘤是20世紀80年代才首次被命名的胃腸道肉瘤,雖然調查發現胃腸道間質瘤的發病率并不高,但是胃腸道間質瘤的形態表現較為復雜,可見于任何年齡段的人群,且發病率不受性別的影響[5]。
本研究結果顯示,胃部的胃腸道間質瘤發生率最高為60.9%(28/46),其余依次是小腸、大腸等部位,與付娟娟等[6]的研究基本一致。
胃腸道間質瘤的腫瘤組織形態主要表現為上皮樣細胞和梭形細胞,兩種細胞可同時存在,上皮樣細胞和梭形細胞會發生形態學上的變異,例如透明樣、核端空泡等,而腫瘤的排列方式則包括束狀、彌漫狀、旋渦狀以及編織狀[7]。本研究結果顯示,胃腸道間質瘤具有Vimentin、CD1l7、CD34高表達的特點,分別為100.0%、93.6%、85.1%,但是神經組織與平滑肌不表達CD34和CD117。CD34與CD117的陽性表達是胃腸道間質瘤診斷的重要參考條件,但是在各項標記呈現為陰性而組織學特征符合胃腸道間質瘤的情況下也不能完全排除胃腸道間質瘤的可能性,只有在SMA或S-100陽性且CD34與CD117為陰性的情況下,可以考慮為平滑肌腫瘤、神經源性腫瘤。雖然Vimentin的陽性表達率為100.0%,然而Vimentin幾乎在大部分的間葉性腫瘤中均呈陽性,所以缺乏特異性。
研究表明,絕大部分的胃腸道間質瘤具有由小到大、從良性到惡性轉變的特點,且胃腸道間質瘤的發生發展與PDGFRA、c-kit等基因突變存在密切的聯系[8]。目前,臨床上通過分析腫瘤細胞的組織形態表現和免疫組織化學特點,有效提高了胃腸道間質瘤的確診率,但是如何判斷胃腸道間質瘤的良性和惡性仍是臨床上的一大難點。陳丹果等[9]研究發現,胃腸道間質瘤不同的生長方式會對腫瘤的性質產生影響,其中腔內/外生長方式的胃腸道間質瘤診斷為惡性的可能性最大,其余依次是腔外、腔內生長方式的胃腸道間質瘤[10]。本研究結果顯示,腔內/外、腔外、腔內3種生長方式的胃腸道間質瘤的惡性率分別為61.1%、40.0%、30.8%,與王鈞等[11]的報道結果基本相似,表明腫瘤的生長方式可以作為胃腸道間質瘤良性、惡性診斷的參考指標。蘇海霞等[12]應用胃腸道間質瘤的4級分級標準分析不同部位腫瘤的風險度,發現發生在大腸和小腸的胃腸道間質瘤的風險度多為中高度,而發生在胃部的胃腸道間質瘤的風險度多為低風險[13],本研究結果與此吻合,說明腫瘤的發生部位也能作為胃腸道間質瘤良性、惡性診斷的參考指標之一。
綜上所述,胃腸道間質瘤主要發生在胃部,但是胃部的胃腸道間質瘤的風險度較低,而大腸和小腸部位的胃腸道間質瘤的風險度較高,需要引起臨床的重視;CD117、CD34等免疫組化指標在胃腸道間質瘤的診斷中具有較高的應用價值,但是仍需結合患者的生物學行為、腫瘤組織學特點等方面確診。
[1] 吳蓮香,劉月泉,鄧作梅,等.胃腸道間質瘤手術的護理對策[J].當代醫學,2014,20(34):129-130.
[2] Rediti M,Pellegrini E,Molinara E,et al.Complete pathological response in advanced extra-gastrointestinal stromal tumor after imatinib mesylate therapy:a case report[J].Anticancer Res,2014,34(2):905-907.
[3] 榮春紅,王揚,凌斌,等.4例惡性胃腸道間質瘤婦科誤診分析(附文獻復習)[J].中日友好醫院學報,2014,28(3):131-133,138.
[4] Rotert JV,Leupold J,Hohenberger P,et al.Src activity is increased in gastrointestinal stromal tumors--analysis of associations with clinical and other molecular tumor characteristics[J].J Surg Oncol,2014,109(6):597-605.
[5] Huang Z,Li Y,Zhao H,et al.Prognositic factors and clinicopathologic characteristics of small gastrointestinal stromal tumor of the stomach:a retrospective analysis of 31 cases in one center[J].Cancer Biol Med,2013,10(3):165-168.
[6] 付娟娟,宋新蘭,賀家勇.胃腸道間質瘤的臨床病理特征分析和免疫組化研究[J].新疆醫科大學學報,2011,34(2):155-157.
[7] 徐宏偉,劉慶猛,朱秀益,等.胃腸道間質瘤的CT表現與免疫組化分型的關系[J].中華腫瘤雜志,2014,36(6):440-445.
[8] Lee JH,Kim Y,Choi JW,et al.Correlation of imatinib resistance with the mutational status of KIT and PDGFRA genes in gastrointestinal stromal tumors:a meta-analysis[J].J Gastrointestin Liver Dis,2013,22(4):413-418.
[9] 陳丹果.胃腸道間質瘤MRI診斷價值及病理組織學特點分析[J].中國中西醫結合消化雜志,2014,22(1):24-26.
[10] Zhou Z,Chen Z,Chen M,et al.Clinicopathologic factors predicting outcomes in patients with gastrointestinal stromal tumors of the rectum and colon[J].Tumour Biol,2014,35(5):4357-4362.
[11] 王鈞.32例胃腸道間質瘤的病理學及免疫組化研究[J].當代醫學,2012,18(12):4-5.
[12] 蘇海霞,潘海虹,張蕾.胃腸道間質瘤CT影像特征對照病理危險度評估的相關性研究[J].中國醫學計算機成像雜志,2014,20(6):511-516.
[13] Hellara O,Toumi O,Hadhri R,et al.Epidemiological,clinical features therapeutic results and evolution of gastrointestinal stromal tumour:about 25 cases[J].Tunis Med,2014,92(6):391-398.
10.3969/j.issn.1009-4393.2016.18.059
新疆 831100 新疆昌吉州人民醫院病理科 (聶瑜 付耒 呂國慶)

