南方鲇尾部神經分泌系統的形態、結構及繁殖前后的變化
譚娟,蒲德永,張耀光
(1.西南大學生命科學學院/淡水魚類資源與生殖發育教育部重點實驗室/水產科學重慶市市級重點實驗室,重慶400715;2.懷化學院生物與食品工程學院,湖南懷化418008)
南方鲇尾部神經分泌系統的形態、結構及繁殖前后的變化
譚娟1,2,蒲德永1,張耀光1
(1.西南大學生命科學學院/淡水魚類資源與生殖發育教育部重點實驗室/水產科學重慶市市級重點實驗室,重慶400715;2.懷化學院生物與食品工程學院,湖南懷化418008)
以重要經濟大型魚類南方鲇為實驗材料,采用解剖學、組織學方法和透射電鏡技術對其尾部神經分泌系統(caudal neurosecretory system,CNSS)的形態結構和繁殖前后的結構變化作了比較研究.結果顯示:南方鲇CNSS主要由尾垂體、軸突和Dahlgren細胞3部分組成;尾垂體體積較大,屬于單個連續型,有倒三角錐形和近似蝌蚪形兩種形態;軸突主要是無髓神經纖維;Dahlgren細胞主要分布在尾部最后3段脊髓中,可分為Ⅰ型和Ⅱ型細胞,兩種細胞大小形態存在顯著差異,在繁殖前后形態結構也存在顯著變化.繁殖前,Dahlgren細胞突起及末梢內充滿電子密度高和低兩種類型的分泌顆粒,細胞器豐富;繁殖后,細胞內分泌顆粒及核糖體急劇減少,線粒體空泡化,RER管腔膨大.
南方鲇;尾部神經分泌系統;形態;結構;繁殖
尾部神經分泌系統(Caudal Neurosecretory System,CNSS)是類似于脊椎動物下丘腦-神經垂體的一種結構,是魚類所特有的一個神經分泌系統,位于脊髓末端,包括神經分泌細胞、軸突和神經分泌區(尾垂體)3部分[1,2].已有大量研究表明,CNSS可分泌一種稱為尾緊張素(Urotensin)的多肽,通過血液循環在魚類的生殖生理調控及滲透壓調節、心血管調節等多方面發揮重要作用[3-6].此外,陳恒[7-9]等報道CNSS與魚類繁殖也有密切關系,CNSS中Dahlgren細胞的大小及其分泌顆粒的多少以及蛋白質含量的變化均隨季節更替而發生改變,且結構和內含物變化過程與魚類卵巢發育過程有著明顯的平行關系.朱洪文[10]等發現鯽魚CNSS隨著性腺的周期性變化其分泌物也有周期性的變化,從恢復、累積到充滿和釋放;Sharma[11]、徐根興[12]、Chen[13]和Bentley[14]等在麗塔鲇(Rita rita)、團頭魴(Megalobrama amblycephala)、印度鲇(Silurus wynaadensis)和雙斑絢鲇(Ompokbi maculatus)的尾垂體中亦發現類似狀況;另外,梁子卿[15]、Berlind[16]等研究均發現魚類CNSS的粗提液或尾緊張素通過協同誘導蟾蜍體外跌卵或致使輸精導管收縮等對生殖系統起作用.盡管CNSS功能和作用機制研究已有大量相關報道,但仍存在很大爭議,暫未形成統一定論.
南方鲇(Silurus meridionalis Chen)屬鲇形目,鲇科,鲇屬,是我國特有大型經濟魚類,個體大,生長快,肉鮮昧美,深受廣大民眾喜愛,具有很高的市場價值.張耀光[17]、王德壽[18]、謝碧文[19]等對該魚的生物學特性、形態發育等各方面都作了大量研究,有關該魚CNSS的形態結構等研究國內外尚未見報道.作者通過比較成魚不同時期CNSS的形態、結構初步探討CNSS與繁殖的相關性,為豐富鲇形目魚類CNSS的形態結構、生殖生理等研究奠定基礎,也為進一步開發鲇魚養殖提供參考資料.
1 材料與方法
1.1 實驗材料
南方鲇系采自嘉陵江合川-北碚江段的野生個體,以及銅梁等地網箱養殖個體,體長65~103 cm,共計50尾.繁殖前材料(性腺發育至Ⅴ期)為性成熟個體,經人工催產,輕壓腹部能排卵或排精,繁殖后材料(性腺發育為Ⅵ期)于排出卵粒或精液24 h至7 d之間取材.
1.2 實驗方法
1.2.1 CNSS形態學材料處理
本實驗采用健康活潑南方鲇個體,測量常規生物學數據,脊椎骨鑒定年齡.從倒數10-12個脊椎骨處斷尾,依次向后剝離一側椎弓,暴露脊髓,Nikon C-BD230體式鏡下觀察外部形態,照相,測量.
1.2.2 組織學的顯微結構觀察
不同個體脊髓段分別用Bouin’s液固定,石蠟包埋,連續切片,5-7μm,分別做H.E染色、Mallory以及Heidenhain AZAN三色法染色.以上所有結果均在Nikon Eclipse 80i顯微觀察,Nikon ACT-2U系統下照相.
1.2.3 CNSS超微結構材料的處理
選取性腺分別處于Ⅲ期、Ⅴ期和Ⅵ期的個體,斷尾,取出最后一段尾部脊髓及其相連的尾垂體,置于預冷的2.5%戊二醛固定,將材料塊修整成1mm*1mm*1mm大小,4℃過夜.1%鋨酸(4℃)后固定3-4 h,丙酮脫水,環氧丙烷透明,Epon812包埋,40-60 nm超薄切片,檸檬酸鉛和醋酸鈾雙重染色,H-300型透射電鏡觀察,照相. Image-proPlus 5.1圖象處理軟件下隨機挑選20個細胞及其內部細胞器進行測量、統計.
2 結果
2.1 南方鲇CNSS的解剖結構
南方鲇尾部脊髓逐漸變細,在最后一個脊椎骨所對應脊髓的腹面有明顯膨大,即尾垂體,與脊髓過渡連續,共用外層脊膜,相應脊椎骨的椎體背面也具特有的凹陷結構,尾垂體背部往后延伸為終絲.南方鲇尾垂體的形態主要有3個特點:(1)屬單個尾垂體,與脊髓過渡無明顯分界,但可分為兩種形態(圖版Ⅰ:1,2),一種近似倒三角錐形,側面觀前端圓脹,往后逐漸縮小;另一種近似蝌蚪形,分為連續的兩部分,前部分突起明顯,近圓形,體積較大,往后陡然下陷與脊髓平行,形成一段背腹扁平突起,尾部仿如錘頭柄部,柄部中間縱軸方向可見明顯淺溝.(2)不同生活環境來源的南方鲇的脊髓外包的脊膜上均有黑色素細胞分布,但養殖個體呈明顯黑色,而野生個體表面呈淡灰色.推測可能與光照時間和光照強度有關,江河野生個體長期生活在深水底層,陽光照射到深水區時光線已經很弱導致其產生較少黑色素細胞,而人工養殖個體大多生活在淺塘,受光照影響較大故產生較多黑色素細胞.(3)比較同一年齡段尾垂體大小,發現野生個體的尾垂體比養殖個體的稍大,如同屬4+齡,體長體重相近的兩尾南方鲇,野生個體的尾垂體大小為3 053 μ m×1 282 μ m×1 446 μ m,而人工養殖的大小為3 049 μ m×1 162 μ m×1 333 μ m,動物的形態與功能是統一的,推測可能是由于江河個體周圍環境較人工養殖環境變化大,用進廢退,故尾垂體較大.
2.2 南方鲇CNSS的顯微結構及繁殖前后變化
南方鲇CNSS主要由Dahlgren細胞、軸突和尾垂體3部分組成(圖Ⅰ:3).
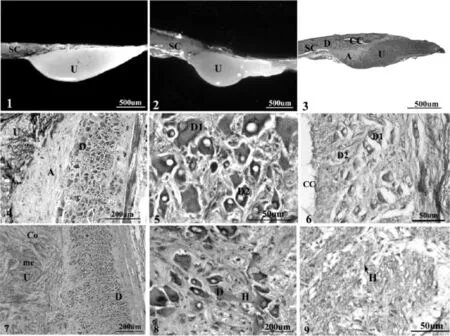
圖版Ⅰ 南方鲇CNSS的形態和顯微結構
2.2.1 尾部神經分泌細胞
南方鲇Dahlgren細胞集中于最后3個脊椎骨所對應脊髓的背面灰質內,緊鄰中央管,特征明顯,胞體較大,大多有3-4個突起,具有圓形、梭形、三角形等各種形狀,還有方形和多邊形(圖Ⅰ:4).胞質染色不均勻,H. E染色為紅紫色,可能成堿性.核較大,形狀不規則,近圓形或橢圓,單核或多核.核內核仁明顯,H.E染成藍黑色,強嗜堿性.Dahlgren細胞根據胞體大小、形態、著色性及分布位置等可分為兩類(圖Ⅰ:5,6):一類細胞胞體較大,橫切面形態不規則,多為多邊形,一般具2胞核,偶爾可見3胞核,H.E染色胞質較淡,稱為大型尾部神經分泌細胞即DahlgrenⅠ型細胞,其分布范圍較廣,遍及3段脊髓,但每一段脊髓內DahlgrenⅠ型細胞分布數量有所不同,從前往后先是靠近中央管,往尾部方向細胞數量逐漸增多且遠離中央管,靠近尾部末端時DahlgrenⅠ型細胞數量又逐漸減少.經測量統計,3+齡個體春季時DahlgrenⅠ型細胞橫切面平均面積為867.03±474.44 μ m2(n=20).另一類稱為DahlgrenⅡ型細胞,胞體橫切面積明顯小于Ⅰ型細胞,通常呈梭形或圓形,一般是1個核,H.E染色胞質較Ⅰ型細胞深,分布區域相對狹窄,主要集中在中央管腹面的脊髓灰質內,從中央向四周成索狀排列,春季時3+齡個體Ⅱ型細胞橫切面面積平均為228.47±92.61 μ m2(n=20).
Dahlgren細胞軸突從脊髓腹面向后下方延伸入尾垂體,主要是無髓神經纖維,平行整齊排列,進入尾垂體前集合成束.
2.2.2 尾垂體
連續切片表明尾垂體主要由脊髓灰質內的Dahlgren細胞發出的軸突及毛細血管組成,但在尾垂體與脊髓之間,有不連續的結締組織將其分隔,并在尾垂體內將其分成若干個大小不等的類似腔室的區間,由此將尾垂體分為“皮質”和“髓質”.皮質除結締組織纖維外還有Dahlgren細胞軸突以及少量毛細血管組成,從外層包裹住尾垂體并向內逐漸分支,像網格一樣穿插其中,分隔出大小不等的腔室就是髓質,染色較深,主要由軸突末梢和毛細血管組成,還有部分神經膠質細胞(圖Ⅰ:7).
2.2.3 CNSS繁殖前后主要顯微結構變化
南方鲇CNSS繁殖前后顯微結構差異主要表現在以下3個方面:(1)細胞胞體的變化:Dahlgren細胞從繁殖前胞體較大變成較小,從充滿內含物、染色較深變成胞質內空泡化,推測可能是繁殖時期胞體內含物排出,導致胞體體積減小(圖Ⅰ:5,6).(2)繁殖前,在最后一段脊髓神經分泌細胞間可見染色均勻、充滿分泌物泡狀結構,即Herring小體,而繁殖后在胞體周圍大多是空泡狀(圖Ⅰ:8,9).(3)不同類型的神經分泌細胞形態大小測量結果在繁殖前后顯示出明顯差異,詳見表1.DahlgrenⅠ型細胞繁殖前后胞體面積分別為604.10±355.30 μ m2和262.57±115.23 μ m2(n=40),DahlgrenⅡ型細胞在繁殖前后胞體面積分別為136.77±42.21 μ m2和87.00± 34.69 μ m2(n=40),均有顯著差異,其胞體周長和胞核的面積、周長等各項指標在繁殖前、后也均有極顯著差異(P<0.001).
表1 繁殖前、后不同類型Dahlgren細胞胞體的形態大小比較(n=20,±SD)
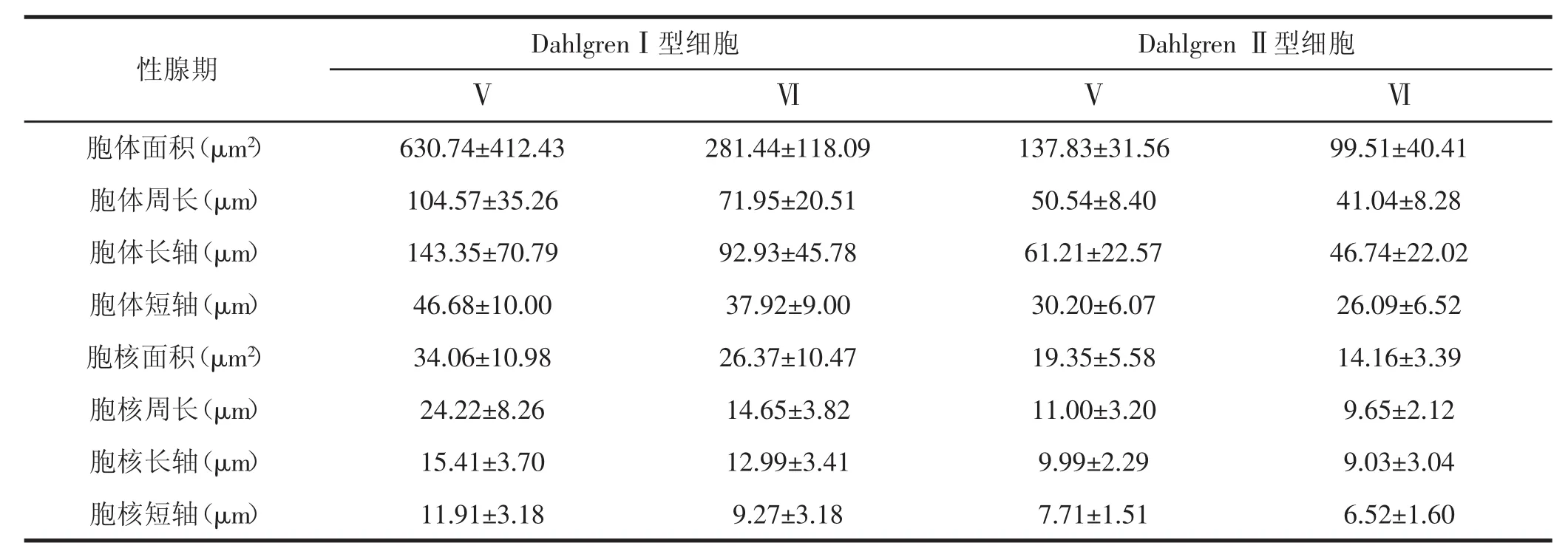
表1 繁殖前、后不同類型Dahlgren細胞胞體的形態大小比較(n=20,±SD)
性腺期D a h l g r e nⅠ型細胞ⅤD a h l g r e nⅡ型細胞ⅥⅥ胞體面積(μ m2)6 3 0 . 7 4 ± 4 1 2 . 4 3 9 9 . 5 1 ± 4 0 . 4 1胞體周長(μ m)1 0 4 . 5 7 ± 3 5 . 2 6 4 1 . 0 4 ± 8 . 2 8胞體長軸(μ m)1 4 3 . 3 5 ± 7 0 . 7 9 4 6 . 7 4 ± 2 2 . 0 2胞體短軸(μ m)4 6 . 6 8 ± 1 0 . 0 0 2 6 . 0 9 ± 6 . 5 2胞核面積(μ m2)3 4 . 0 6 ± 1 0 . 9 8 1 4 . 1 6 ± 3 . 3 9胞核周長(μ m)2 4 . 2 2 ± 8 . 2 6 9 . 6 5 ± 2 . 1 2胞核長軸(μ m)1 5 . 4 1 ± 3 . 7 0 9 . 0 3 ± 3 . 0 4胞核短軸(μ m)1 1 . 9 1 ± 3 . 1 8 6 . 5 2 ± 1 . 6 0 2 8 1 . 4 4 ± 1 1 8 . 0 9 7 1 . 9 5 ± 2 0 . 5 1 9 2 . 9 3 ± 4 5 . 7 8 3 7 . 9 2 ± 9 . 0 0 2 6 . 3 7 ± 1 0 . 4 7 1 4 . 6 5 ± 3 . 8 2 1 2 . 9 9 ± 3 . 4 1 9 . 2 7 ± 3 . 1 8Ⅴ1 3 7 . 8 3 ± 3 1 . 5 65 0 . 5 4 ± 8 . 4 06 1 . 2 1 ± 2 2 . 5 73 0 . 2 0 ± 6 . 0 71 9 . 3 5 ± 5 . 5 81 1 . 0 0 ± 3 . 2 09 . 9 9 ± 2 . 2 97 . 7 1 ± 1 . 5 1
2.3 CNSS的超微結構
2.3.1 Dahlgren細胞胞體的超微結構
超微結構顯示Dahlgren細胞兩種類型結構差異顯著(圖版Ⅱ:1,2),Ⅰ型Dahlgren細胞染色較Ⅱ型細胞深,胞質內各種細胞器包括RER、線粒體、核糖體、溶酶體等非常豐富,且Ⅰ型Dahlgren細胞胞體內RER排列整齊,而Ⅱ型細胞RER明顯減少且排列雜亂;Ⅰ型Dahlgren細胞核糖體分布密集且大多以多聚核糖體的形式存在,而Ⅱ型細胞多聚核糖體明顯減少;Ⅰ型Dahlgren細胞細胞核形狀不規則,富含異染色質且分布不均勻;而Ⅱ型細胞細胞核表面相對平滑,染色質分布相對均勻.兩種類型的Dahlgren細胞也有相同之處,兩者均有不同密度的電子致密顆粒(圖版Ⅱ:3).電子致密顆粒多近似圓形,無規律的散布在胞體和突起之中,染色的深淺表明電子密度的大小,因此,根據電子密度大小將分泌顆粒分為Ⅰ型和Ⅱ型顆粒,兩者形態大小無顯著性差異,直徑約165.33±34.58 nm(n=148).
2.3.2 Dahlgren細胞軸突的超微結構
超微結構表明Dahlgren細胞軸突內主要包含神經原纖維、線粒體等結構,還有少量神經分泌顆粒及一些電子透明小泡(圖版Ⅱ:4).其分泌顆粒與胞體內的電子密度相似.電鏡下還可見部分有髓神經纖維,髓鞘厚度因其髓鞘板層數不同而不同,約0.06-4.37 μ m,平均0.32±0.74 μ m(n=34).有髓神經纖維軸突內包含物與無髓神經纖維類似(圖版Ⅱ:5).南方鲇Dahlgren細胞軸突末端根據內含物的不同可分為3種類型,一種末端內含物主要由電子透明小泡組成,透明小泡直徑為21.13-77.67 nm(n=42);另一種末端除包含部分類似電子透明小泡外,還有電子致密顆粒,顆粒大小為29.13-157.47 nm(n=40);第3種末端是只含有幾個大空泡,大小為70.42-147.05 nm(n=30)(圖版Ⅱ:6).
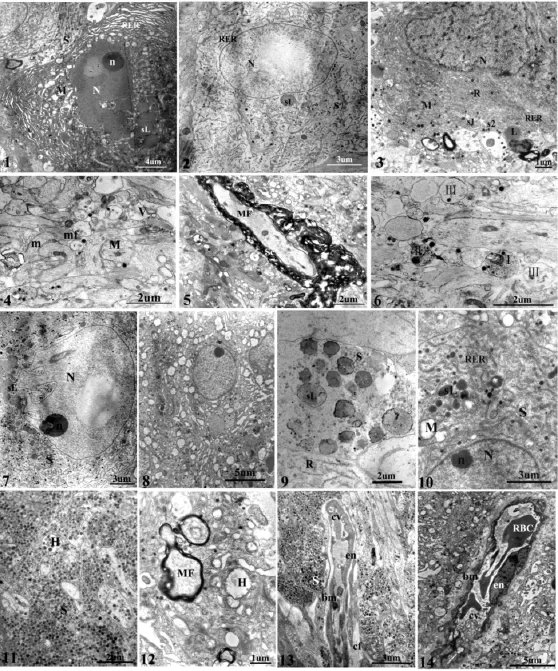
圖版Ⅱ 南方鲇CNSS的超微結構
電鏡下,Dahlgren細胞軸突末梢形成的比較常見的突觸是“軸-體”突觸,也可見“軸-樹”突觸和“軸-軸”突觸.突觸后膜與突觸前膜之間形成對稱性突觸.
2.3.3 尾垂體的超微結構
尾垂體內富含突觸和毛細血管.突觸內含物與胞體軸突末端類似,主要是分泌顆粒和不同大小的透明小泡,軸突之間以及軸突與血管之間經常可見細胞間連接——橋粒.毛細血管管道壁很薄,內皮細胞核呈扁平狀或方形,胞質較少.毛細血管管腔內偶爾可見一些電子密度偏低的類似溶酶體的小泡,小泡內可見透明顆粒樣內含物.
2.3.4 CNSS繁殖前后超微結構變化
南方鲇CNSS繁殖前后超微結構異同主要表現在以下6個方面:(1)Dahlgren細胞胞質內細胞器在繁殖前非常豐富且排列緊密,而繁殖后出現大量空泡,線粒體內嵴減少,幾乎呈空泡狀,RER管腔膨大,核糖體數量也明顯減少(圖版Ⅱ:7,8).(2)胞質內溶酶體的變化:繁殖前后Dahlgren細胞胞體內初級溶酶體和次級溶酶體數量及體積均明顯減少,尤其是初級溶酶體顯著減少,但染色加深,繁殖前有時可見溶酶體內吞分泌顆粒的現象(圖版Ⅱ:9,10).(3)細胞核的變化:一般情況下,細胞核表面平滑,但繁殖前,部分Dahlgren細胞胞核形成復雜內陷,深度可占胞核短徑三分之一,內陷處可見RER、核糖體、分泌顆粒等胞器,在內陷最深處還可見大量染色很深的次級溶酶體聚集(圖版Ⅱ:7,8).(4)分泌顆粒的變化:繁殖前后Dahlgren細胞突起及末梢內分泌顆粒急劇減少,繁殖后突起內主要包含神經原纖維和空泡狀的線粒體及電子密度極低的球形小泡.(5)繁殖前,Herring小體體積較大且充滿分泌顆粒;繁殖后,體積明顯縮小并空泡化(圖版Ⅱ:11,12).(6)毛細血管在繁殖前后結構變化也比較明顯,開始管腔較大,平滑,而后呈萎縮狀,可能主要是由于內皮細胞向管腔內形成較多皺褶(圖版Ⅱ:13,14).
4 討論
4.1 CNSS的形態結構
尾部神經分泌細胞在脊髓中的分布位置隨著魚種的不同而有明顯差異.Fridberg[20]等報道北梭魚(Albula vulpes)的Dahlgren細胞主要分布在最后6個脊椎骨對應的脊髓中,而真鰩(Raja batis)Dahlgren細胞幾乎在55個脊椎骨范圍內均有分布;Richard[21]、Carla[22]等分別觀察到川鰈(Poecilia sphenops)、巴林口孵非鯽(Oreochromis niloticus)CNSS的Dahlgren細胞分布在最后8個和5個脊椎骨對應的脊髓部位.系統比較發現,軟骨魚類Dahlgren細胞分布比較分散[23],而硬骨魚類Dahlgren細胞分布比較集中[2],但暫時還沒有直接證據表明Dahlgren細胞的多少以及分布位置與功能或分類地位相關.與其它硬骨魚相比,南方鲇的Dahlgren細胞分布區域更加集中,且胞體較大,可能與CNSS的功能水平有關.
尾垂體是CNSS的重要組成部分和功能發揮區域.根據尾垂體與脊髓間的形態差異可分為3類,分別是與脊髓過渡連續、在過渡帶有明顯收縮以及與脊髓完全分開[2].據已有報道,發現軟骨魚類脊髓末端無明顯膨大,即神經血管區(此處不能稱尾垂體)與脊髓無明顯區分;部分原始硬骨魚類如海鰱(Pachycormus)、白斑狗魚(Esox lucius)、鰻鱺(Anguilla japonica)等尾部脊髓末端有膨大,但是與脊髓過渡連續,缺乏明顯差異[20,24];部分硬骨魚如北梭魚既有明顯的尾垂體膨大,與脊髓間有明顯收縮,同時也有離散的神經血管集中區,介于分散與集中的過渡類型[20];但多數硬骨魚類如鯽魚、川鰈等都是具有明顯的尾垂體結構[11,20].南方鲇與多數硬骨魚一樣,尾垂體形成明顯膨大,與脊髓間有明顯的收縮.已有推測,CNSS中尾垂體的形態特征表現出系統進化的一致性[23],但至今未形成定論.除此之外,目前已描述的尾垂體在不同物種間具有不同的形態,比如鱸(Perca fluviatilis)的尾垂體呈圓球形,青魚及草魚尾垂體分為左右兩葉[25].但已有報道表明一個物種僅有一種類型的尾垂體,而南方鲇尾垂體明顯具有兩種形態,一種腹面觀近似倒三角錐形;另一種近似蝌蚪形.這種情況目前國內外均未見報道,具體功能有待于深入研究.
4.2 CNSS結構變化與繁殖的關系
魚類尾部神經分泌系統及其分泌物參與機體多種生理功能調節,其中包括參與繁殖調控.比如朱洪文[10]等觀察鯽魚的CNSS時發現其與性腺的發育周期變化密切相關,其分泌物具有積累、釋放、恢復再積累的周期性變化.Sharma[26]等在麗塔鲇中也發現類似情況,同時觀察到繁殖期間Herring小體內分泌物消失,只剩下空腔,而毛細血管管腔擴張,推測可能是Herring小體的內含物排入毛細血管,然后通過血液循環運送到全身行使其生理功能.本文通過比較南方鲇繁殖前后CNSS的變化,與已報道結果類似,但更精確的將性腺發育時期與CNSS緊密對應,并從超微結構證實了CNSS結構及其分泌物與繁殖間的關系.繁殖前、后Dahlgren細胞的細胞核、胞體和軸突內的內質網、核糖體等胞器以及分泌顆粒都有顯著變化.超微結構表明,繁殖前,南方鲇Dahlgren細胞胞體和軸突以及軸突末梢內都有大量不同電子密度的致密顆粒;而繁殖后,原來充滿分泌顆粒的部位多已排空,代替充滿的是電子透明小泡,偶爾有殘留的致密顆粒與電子空泡并存.故推測南方鲇尾部神經分泌顆粒可能由高爾基體分泌或軸突內管狀系統泡狀化后在原地形成,經過軸突到達軸突末梢,然后分泌出內含物形成殘余物電子空泡,內含物通過內皮細胞作用后轉運至毛細血管腔中行使與繁殖相關生理功能.
[1]呂為群,劉爽,鐘英斌.魚類尾部神經分泌系統研究進展[J].上海海洋大學學報,2012,21(5):743-749.
[2]陳恒,劉書朋,谷平.魚類尾部神經分泌系統研究進展[J].上海大學學報(自然科學版),2000,6(3):248-254.
[3]陳阿琴,張影,陳松林,等.不同光周期條件下日本牙鲆尾部神經分泌系統轉錄組分析[J].水產學報,2016,40(6):833-843.
[4]呂為群,程若冰,蘭兆輝.電生理技術在魚類尾部神經分泌系統研究中的應用[J].水生生物學報,2014,38(4):780-785.
[5]Winter MJ,Ashworth A,Bond H,et al.The caudal neurosecretory system:control and function of a novel neuroendocrine system in fish[J].Biochemistryand Cell Biology,2000,78(3):193-203.
[6]Catherine R M,Weiqun L,Matthew J.Fish caudal neurosecretory system:A model for the study of neuroendocrine secretion[J]. General and Comparative Endocrinology,2007,153,243-250.
[7]陳恒,姜建明.鯽魚尾部神經分泌系統Dahlgren cell季節性變化的細胞計量學研究[J].上海大學學報(自然科學版),1998,4(4):398-405.
[8]傅更鋒,姜建民,徐根興,等.鯽魚(Carassius auratus)尾部神經分泌系統形態計量學的季節性變化[J].南京大學學報(自然科學版),1998,34(2):132-138.
[9]陳恒,姜建明,從默.鯽魚尾部神經分泌系統Dahlgren細胞的糖類、脂類、蛋白質計量的季節性變化研究[J].生物學雜志,2000,17(2):11-12.
[10]朱洪文,徐根興.鯽魚尾部神經分泌系統顯微和亞顯微結構的季節性變化[J].動物學報,1987,33(1):67-72.
[11]Sharma S,Sharma A.Anote on the caudal neurosecretorysystem and seasonal changes observed in the Urophysis of Rita rita(Bleeker)Can[J].J Zool,1975,53:357-369.
[12]徐根興,朱洪文.團頭魴的尾部神經分泌系統[J].水產學報,1986,10(2):205-210.
[13]Chen H,Mu R.Seasonal morphological and biochemical changes of Dahlgren cells implies a potential role of the caudal neurosecretory system(CNSS)in the reproduction cycle of teleostean fish[J].Fish Physiology and Biochemistry,2008,34(1):37-42.
[14]P.J.Bentley著.方永強,汪敏,周家澄譯.脊椎動物比較內分泌學[M].北京:科學出版社,1984.
[15]Berlind,A.Teleost caudal neurosecretory system:Sperm duct contraction induced by urophysial material[J].J.Endocrinol. 1972,52:567-574.
[16]梁子卿,朱洪文.鯉魚尾部神經分泌系統的精提液對蟾蜍體外跌卵作用以及對泥鰍催產作用的初步研究[C].中國第一屆神經內分泌學術會議摘要匯編,生理通訊,1988,3:8-83.
[17]張耀光,楊桂枝,金麗.南方鲇卵巢濾泡細胞和卵膜生成的超微結構研究[J].西南師范大學學報(自然科學版),2004,29(6):1009-1015.
[18]王德壽,林浩然.鲇類生殖內分泌研究[J].水產學報,1996,20(2):151-158.
[19]謝碧文,岳興建,張耀光,等.南方鲇腦垂體發育的研究[J].水生生物學報,2004,28(6):599-606.
[20]FridbergG,BernHA.TheUrophysisandthecaudal neurosecretorysystemoffishes[J].Biol.Rev,1968,43:175-199.
[21]Richard M K.The caudal Neurosecretory System of Poecilia sphenops(Poecillidae)[J].Journal of Morphology.1980,165:157-165.
[22]Carla C,Nadia F,Alessandra Greco,et.al.Development of the Caudal Neurosecretory System of the Nile Tilapia Oreochromis niloticus:An Immunohistochemical and Electron Microscopic Study[J].Journal ofMorphology.2000,243:209-218.
[23]Asish,C.Nag.Functional Morphology of the caudal region of certain clupeiform and perciform fishes with reference to the taxonomy[J].Journal ofMorphology,1967,123(4):529-558.
[24]ImaiK.Developmentofthecaudalandhypothalamic neurosecretorysystemoftheeel,Anguillajaponica[J]. Embryologia,1965,9:66-77.
[25]孟慶聞,蘇錦祥,李婉端.魚類比較解剖[M].科學出版社,1987,280-310.
[26]SharmaS.Studiesontheurophysisandthecaudal neurosecretorysystemin a teleost fish[J].(Ompokbim aculatus)Acta Anat,1973,86:83-95.
Changes on the Morphology and Structure and Pre-reproduction and Postreproduction of Caudal Neurosecretory System of Silurus meridionalis Chen
TAN Juan1,2,PU Deng-yong1,ZHANG Yao-guang1
(1.Key Laboratory of Aquatic Organism Reproduction and Development,Ministry of Education;The Key Laboratory of Aquatic Science of Chongqing;School of Life Science,Southwest University;Chongqing,400715;2.The College of Biology and Food Engineering,Huaihua University,Huaihua,Hunan 418008)
The changes on the morphology and structure and pre-reproduction and post-reproduction of caudal neurosecretory system(CNSS)from Silurus meridionalis were comparative studied by using the technology of anatomy,histology and transmission electron microscope(TEM).The results showed:The CNSS of Silurus meridionalis is mainly composed by urophysis,axon and Dahlgren cell.The urophysis is large,single style and continuousness,and it has two forms,semi-heart-shaped and hammer-shaped.The axon is usually amyelinated nerve fibers.The Dahlgren cell mainly distributes in the last three caudal spinal cord,and have two type,typeⅠand typeⅡ.There are significant different in size and morphology and the changes of pre-reproduction and post-reproduction between the two type cell.In prereproduction,the processes and endings of Dahlgren cell are full of two types of secretory granules which are electron dense-density and low-density.It contained abundant organelles in soma.In post-reproduction,secretory granules and ribosome declined sharply,mitochondrial vacuolization and RER lumen enlarge.
Silurus meridionalisChen;caudal neurosecretory system(CNSS);morphology;structure;reproduction
Q954
A
1671-9743(2016)11-0064-06
2016-09-16
水產科學重慶市重點實驗室開放課題基金項目(KLAS-2015-01).
譚娟,1982年生,女,湖南株洲人,講師,研究方向:動物的生長和發育.
*通訊作者:張耀光,1955年生,男,四川蓬溪人,教授,博士生導師,研究方向:魚類繁殖生物學、發育生物學等.

