大黃素對人肝癌HepG2細胞遷移侵襲能力及E—鈣黏蛋白、Slug蛋白表達的影響
高俊霞 呂強
摘要:目的 觀察大黃素對人肝癌HepG2細胞遷移侵襲能力及E-鈣黏蛋白(E-cadherin)、Slug蛋白表達的影響,探討其相關作用機制。方法 體外培養HepG2細胞,大黃素低、高劑量組分別加入10、20 μmol/L大黃素,陰性對照組加入等體積RPMI-1640培養液,陽性對照組加入10 μmol/L 5-氟尿嘧啶。分別采用細胞-基質黏附實驗、劃痕修復實驗、Transwell小室體外侵襲實驗觀察HepG2細胞黏附率、遷移、侵襲能力;Western blot檢測E-cadherin和Slug蛋白表達。結果 與陰性對照組比較,大黃素低、高劑量組顯著抑制HepG2細胞黏附率、遷移、侵襲能力,E-cadherin蛋白表達水平顯著升高,Slug蛋白表達水平顯著降低(P<0.05,P<0.01),并呈濃度依賴性。結論 大黃素能明顯抑制HepG2細胞遷移和侵襲能力,其機制可能與增強E-cadherin及抑制Slug蛋白表達有關。 關鍵詞:大黃素;肝細胞癌;遷移;侵襲;E-鈣黏蛋白;Slug蛋白
DOI:10.3969/j.issn.1005-5304.2016.06.017
中圖分類號:R285.5 文獻標識碼:A 文章編號:1005-5304(2016)06-0064-04
Abstract: Objective To investigate the effects of emodin on the migration and invasion ability and expressions of E-cadherin and Slug of human hepatoma cell lines HepG2; To discuss the possible mechanisms of anti-hepatocellular carcinoma. Methods HepG2 cells were cultured in vitro. The experimental group was treated with emodin at concentrations of 10 μmol/L and 20 μmol/L as. The negative control group was treated with the same volume of RPMI-1640 medium, while the positive control group was treated with 10 μmol/L floxuridine. The cell matrix adhesion assay, wound healing and transwell chamber in vitro invasion assay were used to observe the effects of emodin on HepG2 cell adhesion rate and migration and invasion ability. Western blot analysis was used to observe the changes of expressions of E-cadherin and Slug. Results Compared with the negative control group, emodin inhibited significantly HepG2 cell adhesion rate and migration and invasion ability were in a dose-dependent manner (P<0.05, P<0.01); Western blot analysis showed that the protein expression of E-cadherin increased significantly, and the level of Slug decreased significantly in a dose-dependent manner (P<0.05, P<0.01). Conclusion Emodin can significantly inhibit migration and invasion of HepG2 cells, which mechanism may up-regulate expressions of E-cadherin and down-regulate Slug.
Key words: emodin; hepatocellular carcinoma; migration; invasion; E-cadherin; Slug protein
大黃素是從大黃中提取的有效單體,具有抗腫瘤、抗病毒、免疫調節等功效功效[1-2]。近年研究發現,大黃素抗腫瘤作用明顯,對宮頸癌、大腸癌、肝癌細胞等腫瘤細胞具有殺傷和抑制作用[3-5],大黃素還可通過促進人肝癌HepG2細胞的凋亡而發揮抗腫瘤作用[6]。肝細胞癌(hepatocellular carcinoma,HCC)是我國目前十分常見的消化道惡性腫瘤之一,具有起病隱匿、早期癥狀不典型、惡性程度高、臨床治療困難、預后不良、病死率高等特點,遷移和侵襲是患者死亡和治療效果不理想的主要原因[7]。目前放療、化療等治療HCC的手段已經進入平臺期,然而其分子機制尚未明了。雖然大黃素具有促進HepG2細胞凋亡作用,但是有關其對HepG2細胞遷移和侵襲的影響國內鮮見報道。另外,E-鈣黏蛋白(E-cadherin)和Slug蛋白被證實是與多種惡性腫瘤遷移和侵襲相關的蛋白。因此,本研究采用體外培養HepG2細胞,觀察大黃素對HepG2細胞遷移侵襲能力及E-cadherin、Slug蛋白表達的影響,探討其相關作用機制。
1 實驗材料
1.1 細胞
人肝癌HepG2細胞,哈爾濱醫科大學第三附屬醫院消化內科惠贈。
1.2 藥物及制備
大黃素購自中國食品藥品檢定研究院,批號140675-201410。1 mg大黃素溶于200 μL 0.1%二甲基亞砜(DMSO)溶液,溶解后依次加入7.4 mL滅菌三蒸水、50 μL 5 mol/L NaOH溶液,過濾后溶液作為母液,濃度為500 μmol/L,-20 ℃冰箱保存備用,臨用時以滅菌三蒸水稀釋至所需濃度。
1.3 主要試劑及儀器
5-氟尿嘧啶(5-Fu),上海海普藥廠,批號150073; DMSO,徐州試劑二廠,批號150217;牛血清白蛋白(BSA),PAA公司,批號715396;Matrigel基質膠和RPMI-1640培養液,美國HyClone公司;E-cadherin、Slug多克隆抗體,美國ProMab公司;辣根過氧化物酶標記抗鼠IgG二抗,美國Santa Cruz公司;Trizol試劑盒,美國Invitrogen公司。CO2培養箱(MCO-20AIC),日本SANYO;紫外可見分光光度計(Libra S22),英國Biochrom;移液槍(Thermo F2),美國Thermo;倒置顯微鏡(CKX41),日本Olympus;熒光顯微鏡(IX51),日本Olympus。
1.4 細胞培養
HepG2細胞培養于含有10%BSA和5%青-鏈霉素雙抗的RPMI-1640培養液中。置于37 ℃、5%CO2及飽和濕度培養箱中培養。2~3 d更換培養液,當HepG2細胞達80%匯合度時,用0.05%胰蛋白酶/0.02%EDTA消化。37 ℃、5%CO2及飽和濕度培養48 h。收集懸浮細胞經EDTA處理制備成單細胞懸液,然后用RPMI-1640培養液洗滌細胞。收集對數生長期細胞,用于后續實驗。
2 實驗方法
2.1 細胞-基質黏附實驗
參照文獻[8]及預實驗結果,低劑量組加10 μmol/L大黃素50 μL,高劑量組加20 μmol/L大黃素50 μL,陽性對照組加10 μmol/L 5-Fu 50 μL,陰性對照組加50 μL RPMI-1640培養液,37 ℃、5%CO2及飽和濕度培養24 h。調整細胞密度1×105個細胞/mL,接種于涂有10 μg/mL Ⅳ型膠原500 μL的24孔板中,37 ℃、5%CO2及飽和濕度培養30 min。PBS洗滌去除未結合的懸液細胞,乙醇固定貼壁細胞。0.1%結晶紫染色,0.2%Triton X-100固定,于波長550 nm處紫外分光光度法測定吸光度(A)值,計算細胞黏附率。細胞黏附率(%)=實驗組細胞A值÷陰性對照組細胞A值×100%
2.2 劃痕修復實驗
HepG2細胞按照細胞密度1×105個/孔接種于6孔板中,待細胞單層生長鋪滿板底時,用移液槍頭沿培養板底部劃“一”字型劃痕。各組給藥同“2.1”項。37 ℃、5%CO2及飽和濕度培養24 h。鏡下檢測細胞向致傷區遷移的相對距離并拍照,計算細胞遷移率。細胞遷移率(%)=實驗組細胞遷移面積÷陰性對照組細胞遷移面積×100%。實驗重復3次,取其平均值。
2.3 Transwell小室體外侵襲實驗
Transwell小室用前鋪上50 ?L 0.5%Matrigel膜基質37 ℃孵育過夜。HepG2細胞各組給藥同“2.1”項。調整細胞密度1×105個/mL,分別取200 ?L接種于Transwell小室內室,并在Transwell小室下室加入含有10%BSA的RPMI-1640培養液。孵育24 h后,取出Transwell小室,去除未穿膜細胞。甲醇固定15 min。OlympusIX51熒光顯微鏡計數穿過微孔膜的細胞數。每組細胞隨機選取10個視野計數,取其平均值。實驗重復3次。
2.4 Western blot檢測E-鈣黏蛋白和Slug蛋白表達
HepG2細胞各組給藥同“2.1”項。37 ℃、5%CO2及飽和濕度培養24 h。按細胞總蛋白抽提試劑盒說明書提取細胞總蛋白,Bradford法測定蛋白質含量。取50 ?g蛋白質進行10%~12%SDS-PAGE凝膠電泳。電泳后,濕法電轉印至PVDF膜,用含1%脫脂奶粉TBS和0.1%TBST封閉超過2 h,TBST洗膜3次,每次3 min,加E-cadherin或Slug多克隆抗體(1∶1000),4 ℃孵育過夜,TBST洗膜3次,每次3 min。加辣根過氧化物酶標記的二抗(1∶2000),常溫孵育2 h,TBST洗膜3次,每次3 min。β-actin作為內參照。ECL化學發光試劑顯色,通過富士生物圖像處理軟件進行目的條帶的表達檢測及分析。
3 統計學方法
采用Graphpad5.0軟件進行描述性統計。實驗數據以—x±s表示,正態分布資料組間比較采用t檢驗,多樣本均數比較采用方差分析。P<0.05表示差異有統計學意義。
4 結果
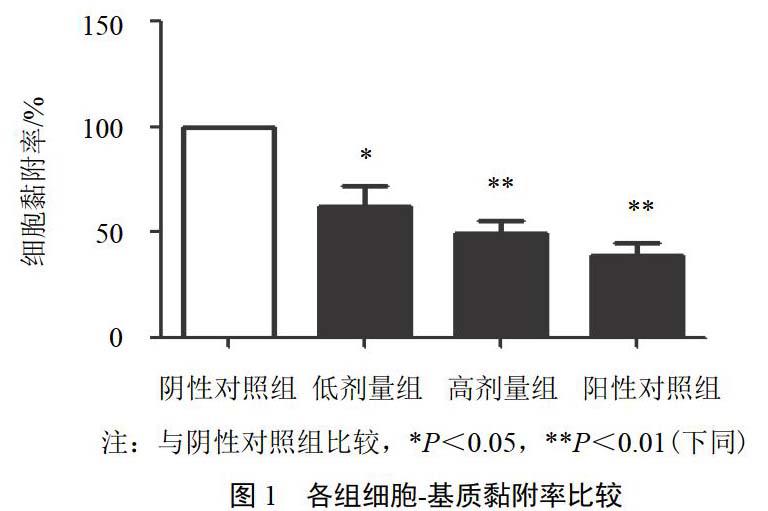
4.1 大黃素對HepG2細胞黏附能力的影響
與陰性對照組比較,大黃素低、高劑量組對HepG2細胞黏附率具有明顯抑制作用,差異有統計學意義(P<0.05,P<0.01),并呈濃度依賴性,見圖1。
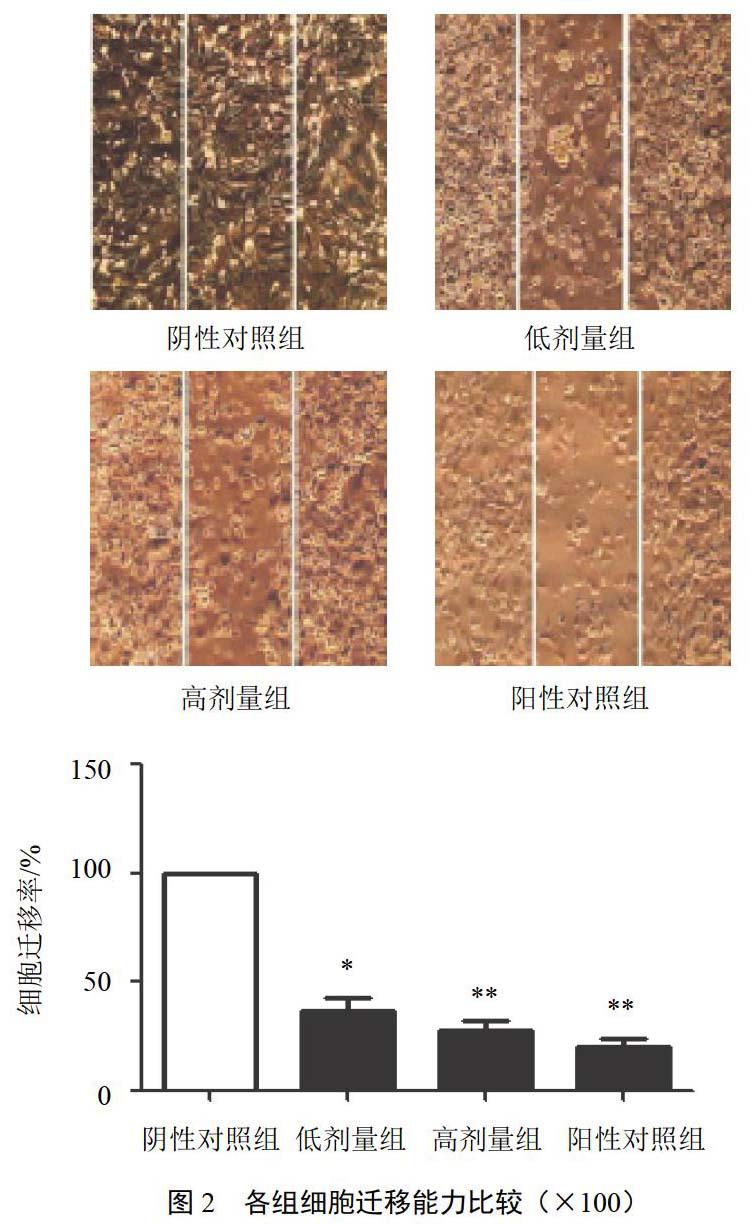
4.2 大黃素對HepG2細胞遷移能力的影響
與陰性對照組比較,大黃素低、高劑量組對HepG2細胞遷移具有明顯抑制作用,差異有統計學意義(P<0.05,P<0.01),并呈濃度依賴性,見圖2。
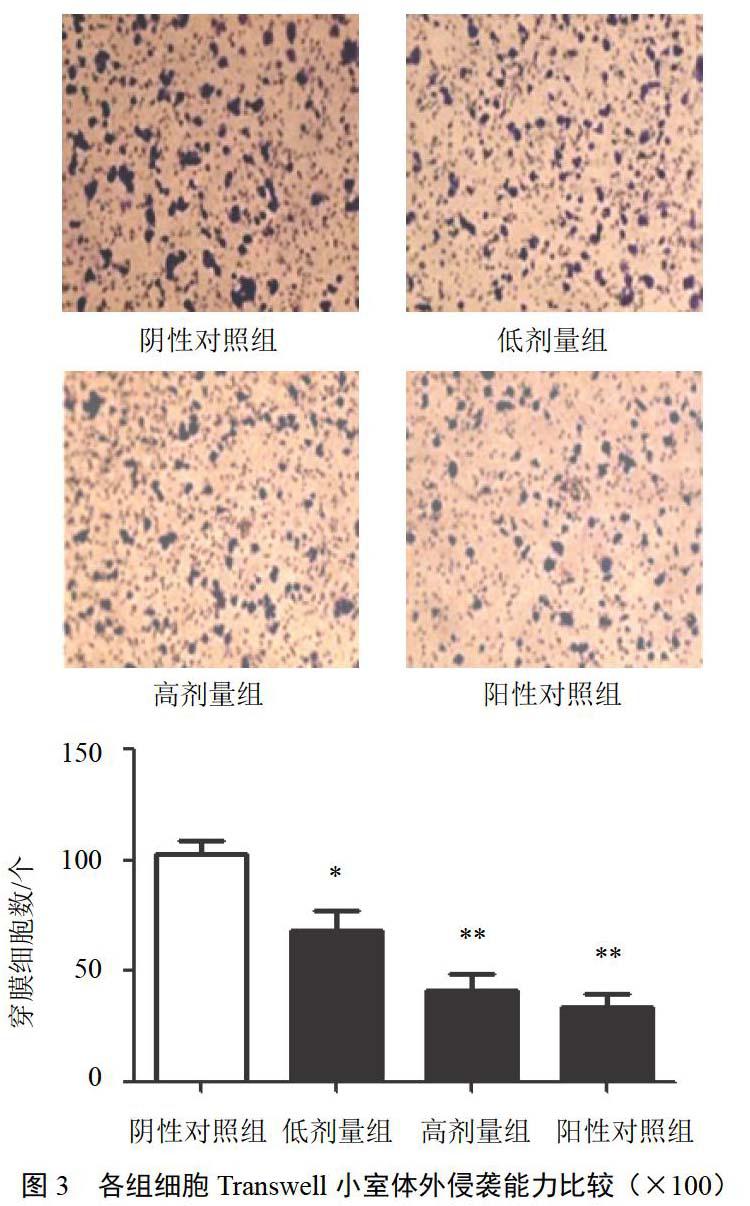
4.3 大黃素對HepG2細胞體外侵襲能力的影響
與陰性對照組比較,大黃素低、高劑量組對HepG2細胞侵襲能力具有明顯抑制作用,差異有統計學意義(P<0.05,P<0.01),并呈濃度依賴性,見圖3。
4.4 大黃素對HepG2細胞E-鈣黏蛋白、Slug蛋白表達的影響
與陰性對照組比較,大黃素低、高劑量組HepG2細胞E-cadherin蛋白表達明顯升高(P<0.01),Slug蛋白表達明顯降低(P<0.01),并呈濃度依賴性,見圖4。
5 討論
HCC高死亡率的主要因素之一是遷移和侵襲特別迅速,而上皮-間質轉變(epithelial-to-mesenchymal transitions,EMT)是增強癌細胞的原位侵襲和遠處遷移以及抑制癌細胞凋亡的一個關鍵因素。
EMT最主要的標志性變化是E-cadherin表達的減少或丟失。E-cadherin是一類主要介導細胞之間相互黏附的鈣依賴性跨膜蛋白,主要表達在上皮細胞,廣泛參與細胞間的連接,對于維持正常上皮細胞的完整性十分重要。研究表明,E-cadherin結構和功能異常可致癌細胞間黏附松散,癌細胞極易從原發部位脫落,并沿淋巴管血管外膜及組織間隙浸潤蔓延,破壞鄰近正常組織并繼續生長,形成轉移癌[9]。E-cadherin的表達下調或抑制和功能喪失均可啟動EMT,癌細胞經過這種細胞表型的轉化獲得更高的侵襲性。在對E-cadherin表達調控的研究中發現,Slug起到決定性作用。Slug是Snail超家族成員之一,能識別E-cadherin基因啟動子上E2-box元件以抑制靶基因E-cadherin的轉錄,下調E-cadherin蛋白表達,共同促進癌細胞的原位侵襲和遠處轉移。有研究表明,Slug的過表達同時伴有E-cadherin的低表達或缺失與誘發胰腺癌、骨肉瘤、結直腸癌、口腔鱗癌等腫瘤的發生、發展和轉移高度相關[10-13]。
本研究發現,大黃素可顯著抑制HepG2細胞基質黏附能力,提示大黃素可能具有潛在抑制HepG2細胞遷移和侵襲的能力。劃痕修復實驗和Transwell小室體外侵襲實驗結果顯示,大黃素可顯著降低HepG2細胞遷移率和侵襲細胞數,提示大黃素可抑制HepG2細胞遷移和侵襲能力。為了進一步驗證大黃素抑制HepG2細胞遷移和侵襲的機制,本研究對E-cadherin和Slug的表達進行了分析。Western blot分析結果顯示,大黃素可顯著增強E-cadherin蛋白表達并且抑制Slug蛋白表達,提示大黃素抑制HepG2細胞遷移和侵襲能力可能是通過增強E-cadherin的蛋白表達以及抑制Slug的蛋白表達而實現的。
參考文獻:
[1] 李杰玉,陳澤奇,林源,等.大黃素對人肝癌HepG2細胞AIF和EndoG蛋白表達的影響[J].現代生物醫學進展,2009,9(5):829-831.
[2] 黨中峰,黨雅梅,陳城,等.大黃素誘導對內質網應激相關蛋白表達及肝癌HepG2細胞凋亡的影響[J].蘭州大學學報(醫學版),2015,41(2):50-54.
[3] THACKER P C, KARUNAGARAN D. Curcumin and emodin down-regulate TGF-β signaling pathway in human cervical cancer cells[J]. PLoS One,2015,10(3):e0120045.
[4] POOJA T, KARUNAGARAN D. Emodin suppresses Wnt signaling in human colorectal cancer cells SW480 and SW620[J]. Eur J Pharmacol, 2014,742:55-64.
[5] 謝丹,林源,楊阿莉.大黃素抑制人肝癌裸鼠移植瘤生長機制探討[J].中華腫瘤防治雜志,2015,22(1):28-33.
[6] HSU C M, HSU Y A, TSAI Y, et al. Emodin inhibits the growth of hepatoma cells:finding the common anti-cancer pathway using Huh7, Hep3B, and HepG2 cells[J]. Biochem Biophys Res Commun,2010, 392(4):473-478.
[7] FLORES-TELLEZ T N, LOPEZ T V, VASQUEZ GARZON V R, et al. Co-expression of Ezrin-CLIC5-Podocalyxin is associated with migration and invasiveness in hepatocellular carcinoma[J]. PLoS One,2015,10(7):e0131605.
[8] 尹春梅,王慧蓮,王琦.大黃素、小檗堿對胰島素抵抗HepG2細胞的影響[J].中藥藥理與臨床,2009,25(2):27-29.
[9] JEMAL A, BRAY F, CEBTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[10] 趙志娟,袁宏偉,韋玄,等.上皮間質轉化相關基因在口腔鱗癌中的相關性及其與臨床病理特征的關系研究[J].臨床口腔醫學雜志,2014, 30(9):515-519.
[11] 孟憲魁,張雷.沉默Slug抑制胰腺癌細胞遷移和侵襲能力[J].西安交通大學學報(醫學版),2014,35(1):69-72.
[12] 伍鋒,尹科,龍秋平,等.骨肉瘤組織中Slug和E鈣粘蛋白的表達意義[J].中國現代醫學雜志,2014,24(13):28-32.
[13] 史江波,鄭繪霞,肖虹,等.Slug蛋白在結直腸腺癌中的表達及意義[J].中國藥物與臨床,2014,14(15):584-587.
(收稿日期:2015-08-17)
(修回日期:2015-09-03;編輯:華強)

